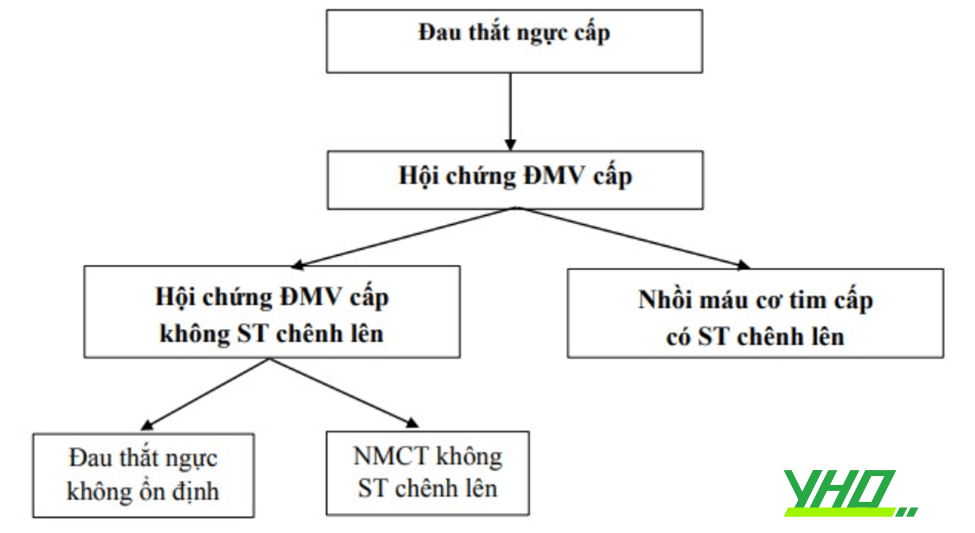
Đường tiếp cận mạch máu trong tim mạch can thiệp
Từ lúc ban đầu, việc tiếp cận mạch máu trong chụp mạch vành chẩn đoán được thực hiện bằng đường động mạch (ĐM) chi trên hoặc ĐM đùi. ĐM cánh tay, một vị trí tiếp cận cho chụp mạch vành chọn lọc, được miêu tả lần đầu tiên bởi Dr Mason Sones năm 1962 tại Cleveland Clinic, dùng kĩ thuật bộc lộ mạch máu (cut-down technique) [1]. Sau đó Dr Sones phát triển kĩ thuật catheter đơn độc cho chụp chọn lọc ĐM vành trái và phải.Những nhà phát minh khác đã sớm sáng tạo ra cách tiếp cận xuyên da vào động mạch đùi. Dr Melvin Judkins phát triển những catheter mang hình dáng sẵn có thiết kế riêng cho chụp ĐM vành bên trái và phải [2]. Trong suốt thời kì tiên phong này, những hạn chế về kĩ thuật bắt buộc phải sử dụng catheter lỗ lớn và chỉ thảo luận tập trung vào việc lựa chọn chất liệu nhựa nào đảm bảo đủ lực xoắn và cho phép thao tác mạnh.
Phương pháp chọc ĐM và thay nhanh wire bằng Kĩ thuật Seldinger [3] làm cho việc tiếp cận ĐM đùi được ưu tiên thực hiện hơn vì tương đối đơn giản và giảm những biến chứng tại chỗ liên quan đến kĩ thuật bộc lộ ĐM cánh tay. Sau khi trường hợp nong bóng mạch vành đầu tiên thực hiện bởi Dr Andreas Gruentzig năm 1977 tiếp cận ĐM đùi qua da, vị trí tiếp cận này hoàn toàn đạt được địa vị mặc định trên thế giới.
Những người tiên phong ban đầu, như Dr Bruce Radner ở Thụy Điển, đã đề nghị sử dụng đoạn xa ĐM quay làm vị trí tiếp cận thực hiện chụp ĐM chủ ngay từ năm 1948 [4]. Tương tự như Dr Werner Forssman, Dr Radner thậm chí còn thí nghiệm cách tiếp cận này trên bản thân ông ta (theo Dr G Olivecrona, thông tin cá nhân, tháng 11 năm 2010). Ứng dụng đầu tiên của kĩ thuật này trên chụp ĐM vành chọn lọc được thực hiện những năm 1970 tại Pháp. Dr Michel Bertrand quan tâm đến những chấn thương tiềm năng quanh các tĩnh mạch và thần kinh giữa ở khu vực xung quanh ĐM cánh tay, đã phát triển kĩ thuật bộc lộ đoạn gần ĐM quay, ở trị trí cách nơi tiếp cận ĐM cánh tay vài centimetre [5]. Điều đáng chú ý là khi kết thúc thủ thuật, ĐM quay được khâu lại. Theo kinh nghiệm hơn 100 ca của ông, bằng chứng khách quan của thiếu máu cục bộ đoạn xa cánh tay không hề gặp. Ngoài ra, ông còn quan sát thấy mạch quay vẫn còn hiện diện dù đã nối đoạn gần ĐM quay, điều này có thể là do sự huy động tuần hoàn bàng hệ từ ĐM trụ và cả cung ĐM gan tay nông lẫn sâu (theo Dr M Bertrand, thông tin cá nhân, tháng 11 năm 2010).
Tại Canada, Dr Lucien Campeau vẫn luôn hứng thú với cách tiếp cận bộc lộ ĐM quay khi chứng kiến nỗ lực của đồng nghiệp ông, Dr Martia Bourassa, người đã phát minh ra những catheter mạch vành mềm mại sử dụng với cách tiếp cậnĐM đùi qua da tiêu chuẩn [6]. Khoảng 10 năm sau trường hợp nong ĐM vành qua da (percutaneous transluminal coronary angioplasty – PTCA) đầu tiên, Dr Campeau, vốn không phải là bác sĩ tim mạch can thiệp, đã báo cáo một loạt những trường hợp ban đầu chụp ĐM vành chẩn đoán ở 100 bệnh nhân (BN) sử dụng cách tiếp cận đoạn xa ĐM quay qua da [7]. Điều thú vị là trong loạt ca báo cáo sơ bộ này, chụp mạch vành chọn lọc thực hiện trên 88 BN, không thành công 12 ca do chọc mạch thất bại (n=10) và không vào được mạch vành chọn lọc (n=2). Tại thời điểm đó catheter chẩn đoán 7Fr là tiêu chuẩn cho chụp mạch vành qua ĐM đùi, trong khi Campeau dùng catheter chẩn đoán 5Fr. Vào năm 1992, Dr M Otaki ứng dụng kĩ thuật tiếp cận ĐM quay qua da tương tự bằng catheter Judkins và Amplatz 5Fr cho các BN người Nhật [8]. Mặc dù có kháng đông, cả hai Dr Campeau và Otaki đều ghi nhận có những ca tắc động mạch quay. Tuy nhiên, những BN này đều không có triệu chứng.
Ngay từ đầu thập niên 1990, Dr Ferdinand Kiememeij và cộng sự ở Hà Lan đã thực hiện PTCA và đặt stent ngay sau đó đầu tiên bằng đường quay [9]. Trong nghiên cứu ACCESS, so sánh ngẫu nhiên 3 vị trí tiếp cận đùi, cánh tay và quay cho PTCA, Kiememeij và cộng sự cho thấy thủ thuật thành công như nhau, với biến chứng mạch máu thấp hơn có ý nghĩa ở mạch quay [10]. Căn cứ vào chế độ chống đông cực kì mạnh mẽ nhằm ngăn ngừa huyết khối trong stent ở giai đoạn này, Kiememeij và nhóm của ông chứng minh rằng BN có thể được đặt stent mạch vành trong khi được điều trị bằng các dẫn xuất của coumadin. Sau đó, họ cũng chỉ ra rằng việc xuất viện cùng ngày sau khi PTCA hoặc đặt stent đều an toàn và dễ dàng ở những BN được chọn lựa [11]. Những kinh nghiệm đầu tiên này khiến nhiều phẫu thuật viên áp dụng tiếp cận mạch quay, đặc biệt ở Canada, châu Âu và châu Á, trong khi ở Mỹ, tiếp cận mạch đùi vẫn là tiêu chuẩn.
Sau khi nhận thức về ảnh hưởng lâm sàng của các biến chứng liên quan đến vị trí mạch máu tiếp cận được tăng cường, kĩ thuật chọc động mạch được cải thiện, dụng cụ được làm nhỏ đi, các thiết bị đóng mạch máu(vascular closure device – VCD)cho đường đùi và dụng cụ cầm máu cho đường quay được phát triển. Trong khi các dữ liệu gần đây gợi ý tiếp cận mạch quay có thể trở nên phổ biến hơn trong tương lai gần, người phẫu thuật viên hiện đại chắc chắn cần phải nắm vững những kĩ thuật chuyên môn liên quan đến cách tiếp cận cả quay và đùi cải tiến để cung cấp chăm sóc tối ưu cho BN của mình.
Bài này sẽ xét lại các đặc điểm tiếp cận đường quay và đùi, bàn luận các vấn đề kĩ thuật để tối ưu hóa cách chọc ĐM và so sánh biến chứng mạch máu liên quan đến vị trí tiếp cận quay và đùi cũng như phương pháp dự phòng và điều trị những biến chứng đó.
Tiếp cận mạch máu liên quan đến thay van ĐM chủ qua da và can thiệp mạch ngoại biên sẽ bàn luận trong những bài tương ứng.
2. Tiếp cận động mạch đùi
Phương pháp ngược dòng

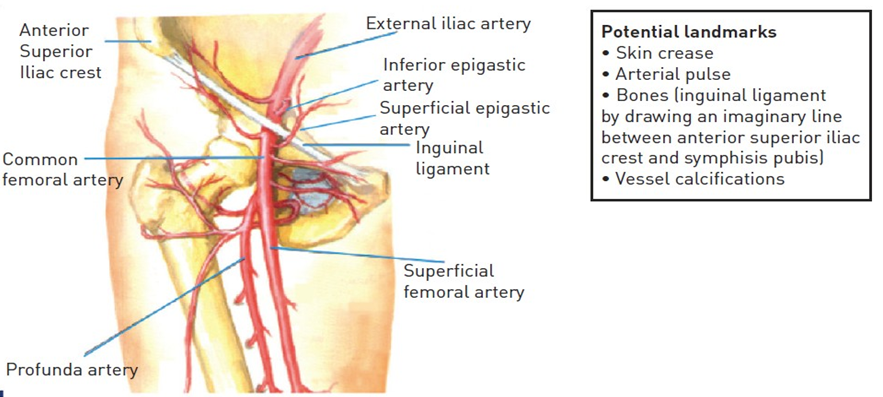
Hình 1: giải phẫu ĐM vùng đùi
Nói vị trí tiếp cận là ĐM đùi thì không chính xác vì dữ liệu gần đây đã chứng minh vị trí lý tưởng để chọc kim là ĐM đùi chung (common femoral artery – CFA) [12]. CFA nằm giữa ĐM chậu ngoài và chỗ chia đôi ĐM đùi chung thành ĐM đùi nông (superficial femoral artery) và ĐM đùi sâu (profunda femoris artery) (hình 1). Mạch máu này liên quan thân cận với tĩnh mạch và thần kinh đùi (hình 2A và 2B).
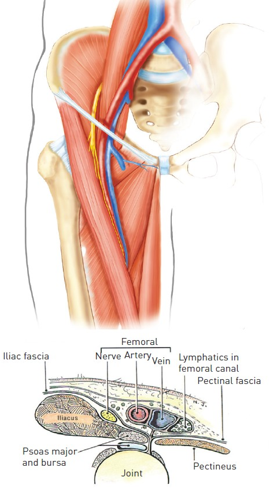
Hình 2A và 2B:tam giác đùi
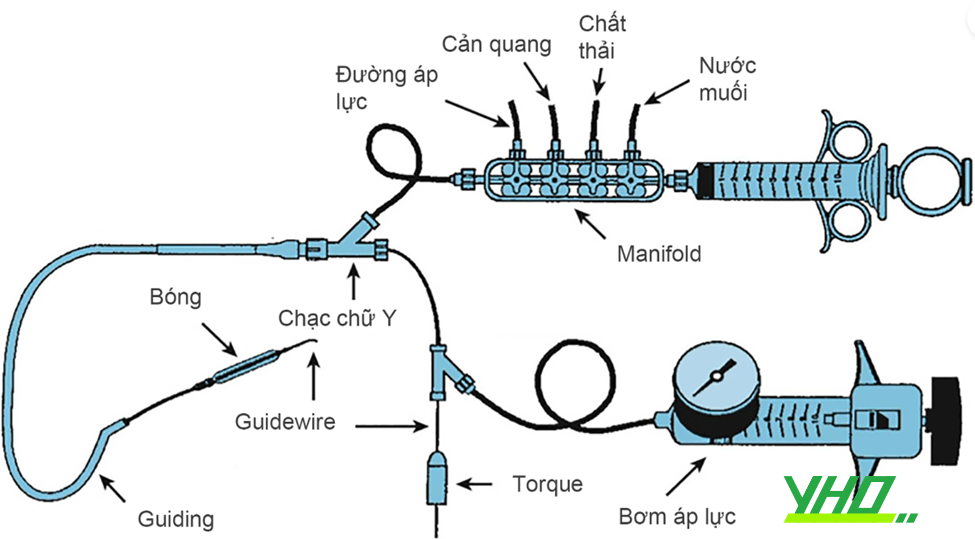
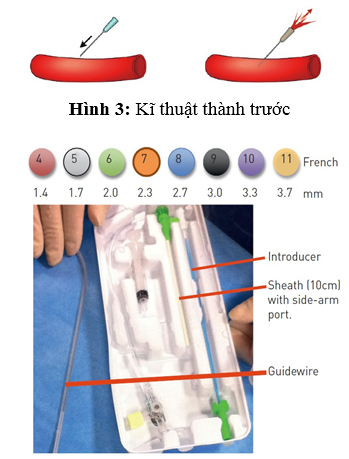
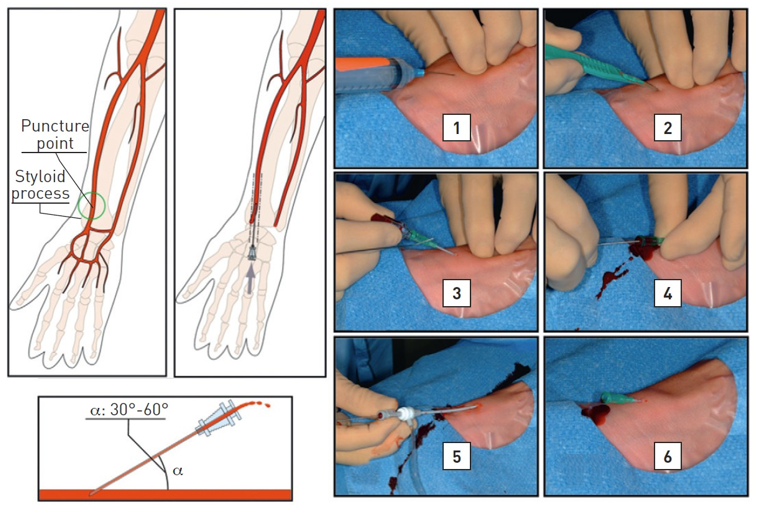
Trong nhiều năm, các phẫu thuật viên hầu như chỉ sử dụng các mốc giải phẫu bên ngoài, được gọi là mốc hướng dẫn giải phẫu truyền thống. Mốc quan trọng nhất là dây chằng bẹn, mặc dù không nhìn thấy, được biểu diễn bằng đường nối từ gai chậu trước trên vốn sờ được trên lâm sàng đến khớp mu. Những bác sĩ tim mạch can thiệp thường khuyên đâm vào 1-2 cm phía dưới đường nối không nhìn thấy này, nơi sờ thấy mạch đùi và có thể đè ép lên đầu xương đùi khi cầm máu. Thực hiện đâm mạch máu bằng kim tiêm (mặt vát hướng lên trên) ở góc 30-45 độ. Khi kim tiến vào ĐM đùi nó sẽ “nhảy”. Để an toàn hơn, chọc ĐM đùi chỉ nên đâm thủng thành trước (hình 3). Khi nòng trung tâm tiến vào, máu bắn ra theo mạch đập dưới áp lực ĐM qua lỗ kim. Lúc này góc kim đâm vào nên cẩn thận hạ thấp xuống về hướng da để chỉnh trục kim với trục trung tâm của CFA. Sau đó luồn dây dẫn nhẹ nhàng qua đầu kim vào động mạch, rút kim (dây dẫn vẫn giữ nguyên vị trí), và luồn bộ shealth vào ĐM (hình 4).
Hình 4: Bộ sheath đường ĐM quay
Một quan niệm sai lầm phổ biến là căn cứ vào nếp gấp da, vốn không phản ánh được vị trí của dây chằng bẹn ở những BN thừa cân và hiếm khinằm trên đường giữa của đầu xương đùi.Cũng quan trọng tương tự, bản thân dây chằng bẹn không nằm ở phía trên bờ trên đầu xương đùi ở tất cả BN.
Biến chứng khi đâm kim thấp là đâm xuyên qua hay luồn sheath vào trong ĐM đùi chung hoặc ĐM đùi sâu, tăng nguy cơ tạo thành giả phình, rách hoặc huyết khối [13]. Thật ra, cầm máu đầy đủ khó đạt được hơn khi vị trí chọc kim ở dưới đầu xương đùi bởi vì ở đây không có sự hỗ trợ ổn định từ cấu trúc mô để chống lại trong khi đè ép và các VCD không thể sử dụng ở phía dưới chỗ chia đôi của ĐM đùi. Ngoài ra, mạch máu chia đôi nhỏ dần về phía xa làm tăng nguy cơ biến chứng tắc nghẽn. Tuần hoàn tĩnh mạch đùi chạy song song và thường băng ngang qua chỗ chia đôi, do đó tạo khuynh hướng vô ý đâm xuyên qua và thành lập thông nối động tĩnh mạch [14]. Vị trí chọc kim cao có thể dẫn đến xuyên qua hoặc luồn sheath vào ĐM chậu ngoài hoặc ĐM thượng vị dưới, tương tự làm khó khăn khi đè ép mạch máu để cầm máu kèm theo gia tăng gấp 18 lần nguy cơ chảy máu sau phúc mạc [15]. Để đảm bảo đâm trúng CFA và hạn chế nguy cơ biến chứng mạch máu, có 2 kĩ thuật được đề xuất để hỗ trợ phương pháp sờ thủ công truyền thống. Phương pháp thứ nhất là sử dụng màn hình huỳnh quang, trong khi phương pháp thứ hai là dựa vào siêu âm hướng dẫn đâm kim. Mặc dù sử dụng màn huỳnh quang được đề xuất sớm từ năm 1978 bởi Dr Charles Dotter, số nghiên cứu ngẫu nhiên ít đáng ngạc nhiên [16]. Tuy một số tác giả đã chứng minh mối quan hệ giải phẫu nhất quán giữa đầu xương đùi và CFA, Grier và cộng sự khảo sát các kiểu thực hành trong những năm 1990 và thấy rằng hầu hết bác sĩ vẫn thích dùng nếp gấp da (39.2%) hoặc nơi mạch đùi mạnh nhất (24.7%) làm nơi đâm kim mặc định. Họ chỉ ra rằng nếp gấp da nằm xa chỗ chia đôi của CFA 71.9% trường hợp trong khi vị trí mạch đùi mạnh nhất nằm trên CFA 92.7% trường hợp. Theo một nghiên cứu rất gần đây, chỗ chia đôi CFA nằm dưới dây chằng bẹn và đường giữa đi qua đầu xương đùi ở gần như tất cả 126 hình chụp mạch được nghiên cứu (hình 5). Chỗ chia đôi này trung bình khoảng 7.5 cm dưới dây chằng bẹn, 2.9 cm dưới đường giữa đi ngang qua đầu xương đùi, và 0.8 cm dưới bờ dưới đầu xương đùi. Trái lại, nếp gấp bẹn nằm ở dưới chỗ chia đôi CFA trung bình 1.8 cm (3.9-6.5 cm) (không báo cáo cân nặng BN) [12]. Đường đi của CFA hướng vào phía trong đầu xương đùi ở 92% trường hợp.
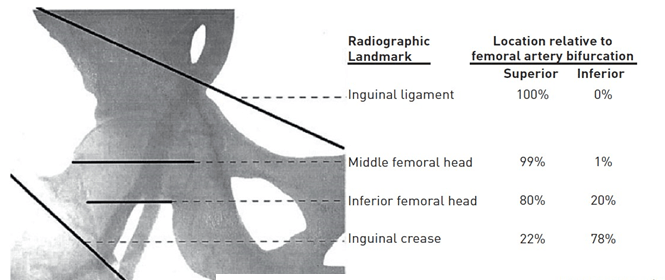
Hình 5:giải phẫu XQ vùng đùi
Fitts và cộng sự đã xem tác tác động của hướng dẫn bằng huỳnh quang ở 2651 BN liên tiếp (cân nặng trung bình 85 kg, thực hiện PCI từ năm 2000 đến năm 2003) [18]. Sử dụng màn huỳnh quang được phân thành nhóm <20%, 35-50% và >70% trong số 8 phẫu thuật viên. Nhìn chung, sử dụng màn huỳnh quang có liên quan đến giảm tỉ lệ phát sinh bị giả phình (0.3% vs 1.1%, P =0.017) và bất kì chấn thương động mạch nào khác, được định nghĩa là tụ máu >8 cm, giả phình, dò động tĩnh mạch, chảy máu sau phúc mạc hay bất kì biến chứng mạch máu khác cần phải can thiệp (0.7% vs 1.9%, P <0.01), giảm thời gian nằm viện (2.1 ngày vs 2.4 ngày, P <0.01). Đáng lưu ý, không có sự khác biệt về chảy máu cần truyền máu (1.6% vs 1.8%, P =0.69). Đối với mỗi bác sĩ, chấn thương mạch máu ít hơn khi có sử dụng màn huỳnh quang. Hiện tại chỉ có một thử nghiệm ngẫu nhiên so sánh đâm kim theo hướng dẫn màn huỳnh quang và đâm kim dưới dây chằng bẹn [19]. Kim đâm 2-3 cm phía dưới đường tưởng tượng nối gai chậu trước trên và khớp mu với góc kim 30-45 độ. Nhìn chung, thời gian trung bình luồn sheath thành công vào CFA trương đương nhau giữa 2 nhóm. Ngoài ra, trong nghiên cứu này, gồm phần lớn các thủ thuật chẩn đoán (khoảng 70%), tỉ lệ biến chứng mạch máu (mặc dù thấp hơn về số lượng trong nhóm hướng dẫn bằng màn huỳnh quang) không đạt được ý nghĩa thống kê. Hướng dẫn huỳnh quang nhằm tránh đâm kim vị trí thấp có tiềm năng ưu thế cho BN nữ và BN béo phì. Có 1 bài luận đi kèm đã nhấn mạnh cần có một “đường cong học tập” (learning curve) nhằm tối ưu hóa kết quả với hướng dẫn huỳnh quang [20]. Hai nghiên cứu ngẫu nhiên khác so sánh đâm kim vào CFA có và không có hướng dẫn huỳnh quang cũng cho kết quả tương tự, lợi ích tiềm năng ở BN có BMI > 30 kg/m2 [21, 22]. Do đó, mặc dù lợi ích lâm sàng thực sự của hướng dẫn huỳnh quang còn cần chứng minh, nó vẫn là kĩ thuật đáng ứng dụng nhằm tránhchỗ chia đôi CFA trong những trường hợp dự định dùng dụng cụ đóng mạch máu [23]. Một nghiên cứu ngẫu nhiên so sánh hướng dẫn của siêu âm với bắt mạch đùi để đâm kim vào CFA ở 112 BN được gửi chụp mạch vành chẩn đoán [24]. Trong nhóm dân số này có nguy cơ biến chứng mạch máu thấp (cân nặng trung bình 74 kg), hướng dẫn siêu âm có ích để luồn sheath thành công vào CFA chỉ ở BN có mạch đùi yếu hoặc chu vi chân ≥ 60 cm. Không tìm thấy lợi ích giảm biến chứng mạch máu.
Seto và cộng sự báo cáo kết quả của thử nghiệm FAUST ((Femoral Arterial Access with Ultrasound Trial), gồm 1004 BN ngẫu nhiên dùng hướng dẫn huỳnh quang hoặc siêu âm tại một vài trung tâm ở Mĩ [25]. Nhìn chung, hướng dẫn siêu âm hỗ trợ tốt đâm kim vào CFA, đặc biệt khi chỗ chia đôi ở vị trí cao (82.6% vs 69.8%, P < 0.01) và giảm nguy cơ đâm vào tĩnh mạch (2.4% vs 15.8%, P < 0.0001). Biến chứng mạch máu (tụ máu >5 cm, giả phình, chảy máu sau phúc mạc, bóc tách động mạch hoặc huyết khối hoặc chảy máu lớn được định nghĩa theo tiêu chuẩn PCI Linking Angiomax to Reduced Clini”>REPLACE-2 gồm mất máu rõ trên lâm sàng làm giảm Hb >3 g/dL, giảm bất kì Hb >4 g/dL, hoặc truyền ≥2 đơn vị hồng cầu lắng hoặc máu toàn phần) giảm có ý nghĩa với hướng dẫn siêu âm khi so với hướng dẫn huỳnh quang (1.4% vs 3.4%, P = 0.04). Điều cần chú ý, trong khi tỉ lệ luồn sheath thành công dưới hướng dẫn huỳnh quang là 83.3%, các tác giả quan sát thấy có hiện tượng “đường cong học tập” ở nhóm dùng hướng dẫn siêu âm vì tỉ lệ thành công cải thiện từ 82.4% nếu thực hiện <6 thủ thuật siêu âm đến 87.6% nếu thực hiện >15 thủ thuật.
Một xem xét quan trọng hơn là đường đi của ĐM thượng vi dưới, một nhánh sau phúc mạc của ĐM chậu ngoài, thường đi một vòng trực tiếp hướng về dưới gần ngay bờ trên đầu xương đùi. Điều này có nghĩa là bất kì trường hợp đâm kim nào phải tránh cả chỗ chia đôi ĐM đùi cũng như ĐM chậu ngoài (bao gồm ĐM thượng vị dưới).
Dựa trên những nghiên cứu về công cụ hỗ trợ hình ảnh học nói trên, ích lợi riêng biệt khi sử dụng hỗ trợ huỳnh quang hoặc siêu âm không thể khuyến cáo là bắt buộc, mặc dù nó có thể có ích ở nhóm dân số chọn lọc có nguy cơ cao, đặc biệt ở BN béo phì. Ở những BN có thể phỏng đoán dây chằng bẹn từ đường nối giữa gai chậu trước trên đến khớp mu, có thể an toàn khi đâm kim vào 2-3 cm phía dưới đường này nơi mạch nảy mạnh nhất, điều cần cẩn thận quan trọng là những mốc này có mối liên hệ thay đổi với đầu xương đùi. Trong trường hợp khó hoặc nghi ngờ, vùng đâm kim an toàn vào CFA dưới huỳnh quang là vị trí ở giữa đường trung tâm ngang qua đầu xương đùi và giới hạn 14 mm phía dưới. Vùng mục tiêu này mang lại cơ hội cao nhất tránh được cả chỗ chia đôi ĐM đùi và các mạch máu sau phúc mạc (hình 6). Hướng dẫn huỳnh quang nên thực hiện ở mặt chiếu trước – sau (vì góc RAO hay LAO làm chỗ chia đôi tương ứng hướng về phía cranial hoặc caudal) và dò thấy kim và guidewire đi vào đúng vùng mục tiêu để đảm bảo kết quả tối ưu.
Chụp mạch vành sheath đùi trước khi bắt đầu can thiệp có thể giúp quyết định cường độ kháng đông điều trị và thậm chí tiến đến can thiệp chương trình, đặc biệt ở những trường hợp đâm kim cao. Hình ảnh giải phẫu ĐM đùi thu được cũng phục vụ cho mục đích hữu ích ở các thủ thuật trong tương lai, vì hiểu biết về vị trí chia đôi ĐM đùi sẽ thay đổi vị trí vùng mục tiêu tối ưu.
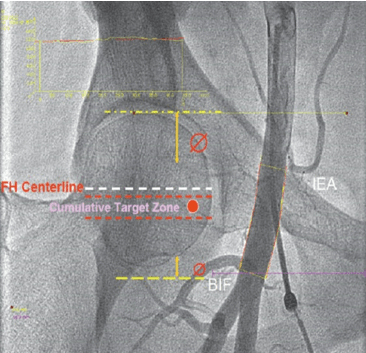
Hình 6: Vùng mục tiêu (target zone)
Kĩ thuật đâm kim nhỏ được đề xuất gần đây là một phương tiện khác để tối ưu hóa đâm kim vào ĐM đùi, đặc biệt khi dự định luồn sheath nòng lớn. Ảnh hưởng chính xác trên lâm sàng còn chưa rõ [26. 27].
Tiếp cận xuôi dòng
Để chẩn đoán và can thiệp xâm lấn hệ ĐM chi dưới, tiếp cận ngược dòng đùi đối bên hoặc tiếp cận xuôi dòng đùi cùng bên đều được sử dụng. Thường thực hành dưới hướng dẫn của siêu âm hoặc huỳnh quang và sheath thường <6 Fr.
Ghi nhớ 1: Tiếp cận ĐM đùi |
| – Đâm kim và luồn sheath phải ở CFA. – Chỗ chia đôi ĐM đùi, ĐM chậu ngoài và ĐM thượng vị dưới phải tránh. – Nếp gấp da, nơi mạch nảy mạnh nhất và dây chằng bẹn, là những cấu trúc giải phẫu có thể gây hiểu lầm. – Trong trường hợp khó khăn về kĩ thuật hoặc giải phẫu, hướng dẫn dưới màn huỳnh quang hoặc siêu âm có thể giúp xác định vị trí CFA. – Dưới màn huỳnh quang, vị trí đâm tối ưu cho CFA nằm giữa đường trung tâm và phần ở dưới ngang qua đầu xương đùi. |
Biến chứng tiếp cận ĐM đùi
Với sự bùng nổ kinh nghiệm trên thế giới, một số yếu tố và tiên đoán độc lập có liên quan đến tăng tỉ lệ mới mắc biến chứng mạch máu sau thủ thuật chẩn đoán và can thiệp (bảng 1). Do cỡ sheath lớn hơn và môi trường chống đông mạnh hơn, tỉ lệ phát sinh biến chứng mạch máu sau PCI cao hơn 2-3 lần so với chụp mạch vành chẩn đoán [28]. Nhìn chung có giảm tỉ lệ phát sinh biến chứng mạch máu có chảy máu nghiêm trọng, đặc biệt trong 5 năm qua, phần lớn nhờ vào một ít cải tiến kĩ thuật và giảm mức độ chống đông quanh thủ thuật. Ảnh hưởng lâm sàng của dụng cụ đóng mạch máu làm giảm biến chứng ĐM đùi còn đang tranh cãi. Nghỉ tại giường thường được khuyến cáo từ 6-8 giờ sau đè ép thủ công, tùy thuộc cỡ sheath nhưng có thể ngắn hơn với dụng cụ đóng mạch máu [29].Tuy nhiên, những protocol rút ngắn thời gian đến khi đi lại được chỉ từ 2-3 giờ cũng đã được chứng minh an toàn. Các nghiên cứu từ những ngày đầu của PTCA hoặc các dụng cụ can thiệp qua da khác báo cáo biến chứng vị trí tiếp cận ĐM đùi từ 2% đến >15% ở BN thực hiện thủ thuật can thiệp hoặc chẩn đoán. Một nghiên cứu trung tâm duy nhất cuối thập niên 90 báo cáo tỉ lệ phát sinh biến chứng mạch máu là 1.8% cho chẩn đoán và 4% cho thủ thuật can thiệp [28]. Gần hơn, dữ liệu từ một trung tâm có lượng bệnh lớn khác báo cáo tỉ lệ phát sinh này là 0.9% cho thủ thuật chẩn đoán và 3.6% sau PCI [30]. Một nghiên cứu gần đây từ Mayo Clinic với 300 BN chụp mạch vành qua đường đùi cho thấy có 13% trường hợp vị trí tiếp cận nằm ngoài vùng đâm tối ưu [31]. Nhìn chung, biến chứng mạch máu xảy ra khoảng 5.7%, với tỉ lệ phát sinh cao hơn có ý nghĩa khi vị trí đâm nằm ngoài vùng tối ưu (18% vs 4%, P <0.001).
Bảng 1: Các yếu tố ảnh hưởng biến chứng mạch máu |
| Không thể thay đổi được – Giới (nữ > nam) – Tuổi (già > trẻ) – Béo phì – Bệnh mạch máu ngoại biên – Bệnh thận mạn – Các bệnh rối loạn tạo máu |
| Có thể thay đổi được – Vị trí đâm (CFA < ĐM đùi nông hoặc sâu) – Cỡ sheath (5-6Fr < 7-8Fr) – Kháng đông (heparin bolus < heparin bolus + truyền, bivalirudin < heparin + kháng tiểu cầu tĩnh mạch) – Kĩ thuật đâm (thành trước < xuyên thành) (với ĐM đùi) – Đâm ĐM kèm tĩnh mạch (tạo dò động tĩnh mạch) |
Biến chứng thường gặp nhất của đâm kim vào ĐM qua da gồm rỉ máu, bầm máu và tụ máu [32]. Mặc dù các trường hợp khối máu tụ tự nó không liên quan đến kết cục lâu dài bị xấu đi, nó vẫn là một nguồn chi phí đáng kể và thường kéo dài thời gian nằm viện. Khi các định nghĩa bắt đầu phát triển, tỉ lệ phát sinh thật sự của tụ máu khó đánh giá qua các thời kì PCI khác nhau [33]. Trong những năm 90, định nghĩa tụ máu lớn bao gồm tụt đáng kể hematocrit, cần phẫu thuật sữa chữa hoặc truyền máu. Khi dùng những định nghĩa này, tỉ lệ báo cáo là 2-5%. Gần đây, tụ máu được định nghĩa khi >5-10 cm và tỉ lệ lưu hành giảm đi trong các nghiên cứu ngẫu nhiên và báo cáo trường hợp cỡ mẫu lớn đánh giá dụng cụ đóng mạch máu hoặc thuốc chống đông. Các yếu tố nguy cơ quan trọng nhất liên quan đến thành lập máu tụ là nữ giới, loại và thời gian dùng chống đông, cỡ sheath. Tỉ lệ lưu hành giả phình ĐM đùi từ 0.7% đến 5.3% ở những nghiên cứu gần đây cho thấy tỉ lệ phát sinh hiện tại <1%. Tuy nhiên, cần chú ý trong một nghiên cứu gần đây gồm 400 BN liên tục sử dụng siêu âm duplex một cách hệ thống, tỉ lệ phát sinh của giả phình là 3.7% [34]. Như đã bàn trước đây, việc tránh đâm kim dưới chỗ chia đôi ĐM đùi và chỉ đâm vào thành mạch trước được khuyến cáo để không tạo giả phình. Lúc đầu những biến chứng này thường cần can thiệp phẫu thuật sau khi đè ép dưới hướng dẫn của siêu âm thất bại. Túi giả phình với phần cổ >3 mm ít có khả năng đóng tự phát hoặc điều trị bằng đè ép mà cần phải can thiệp. Trong thực hành hiện nay, tiêm thrombin trực tiếp là kĩ thuật ưu tiên mặc dù nó phải được thực hiện bởi chuyên gia vì một khi thrombin vào tuần hoàn chính có thể gây ra thảm họa [35]. Dò động tĩnh mạch là một biến chứng hiếm (0.1-0.4%) và liên quan đến việc vô tình chọc vào tĩnh mạch đùi khi đang tìm kiếm động mạch, trong lúc đặt sheath tĩnh mạch hoặc đâm kim tĩnh mạch nhiều lần trong các nghiên cứu về điện sinh lý. Trong hầu hết trường hợp điều trị bảo tồn ban đầu sẽ dẫn đên tự hồi phục. Nếu tốc độ dòng chảy vẫn còn cao, có thể cần phẫu thuật sửa chữa. Bóc tách ĐM đùi khi dùng phương pháp ngược dòng thường lành tính trên lâm sàng bởi vì dòng máu sẽ ép vạt nội mạc bóc tách vào trung mạc và gia tăng tốc độ lành. Tuy nhiên, bóc tách sẽ làm thủ thuật khó tiếp tục nếu cần thay đổi catheter khác và do đó thường phải sử dụng vị trí tiếp cận mạch máu khác. Tắc ĐM đùi dẫn đến huyết khối và thiếu máu cục bộ chi và có thể đe dọa tính mạng, tỉ lệ 0.2-0.4% số ca. Nó cần phải được nhận biết ngay lập tức và can thiệp qua da hoặc phẫu thuật khẩn cấp. Một số loại VCD được báo cáo có liên quan đến huyết khối ĐM đùi hoặc thiếu máu cục bộ chi dưới do thuyên tắc vật liệu từ bên ngoài hoặc thành lập huyết khối tại chỗ trên các thành phần của thiết bị. Nhiễm trùng mặc dù đã được miêu tả không sử dụng VCD (0.6%) thì gần đây liên quan chủ yếu với nhiều loại VCD khác nhau. Như tất cả các thủ thuật mạch máu xâm lấn, kĩ thuật vô trùng bắt buộc phải chú ý nghiêm ngặt. Bất kì khó chịu dai dẳng nào trên chỗ đâm kim ĐM đùi sau khi xuất viện dù có hoặc không dấu hiệu nhiễm trùng huyết đều phải được thăm khám ngay lập tức để loại trừ biến chứng mạch máu và nhiễm trùng tại chỗ
Ghi nhớ 2: Biến chứng tiếp cận ĐM đùi |
| – Đâm kim vào CFA ít biến chứng mạch máu hơn là đâm cao (ĐM chậu ngoài) hoặc thấp (vào ĐM đùi nông hoặc đùi sâu). – Chảy máu lớn giảm đi trong thập kỉ qua khi quản lý vị trí tiếp cận tốt hơn. – Nằm nghỉ tại giường >2 giờ sau khi đâm kim ĐM đùi là cần thiết, làm hạn chế nguy cơ chảy máu nơi đâm kim và các biến chứng. – Các biến chứng mạch máu thường cần truyền máu, phẫu thuật sửa chữa hoặc can thiệp qua da khẩn cấp và kéo dài thời gian nằm viện |
Biến chứng đáng sợ nhất của đâm kim ĐM đùi vẫn là chảy máu sau phúc mạc (retroperitoneal bleeding – RPB). Vị trí đâm kim cao luôn được xác dịnh là yếu tố dự báo RPB, do đó tránh luồn sheath vào ĐM chậu ngoài hoặc tổn thương ĐM thượng vị dưới, cả hai nằm ở khoang sau phúc mạc. Các yếu tố dự đoán khác là nữ giới và diện tích da bề mặt thấp. Tỉ lệ phát sinh RPB từ 0.2 đến 6%. Trong một nghiên cứu hàng loạt ca cỡ lớn với 3508 BN thực hiện PCI báo cáo năm 2005, tỉ lệ phát sinh là 0.74%. Điều này cũng tương tự trong nghiên cứu hàng loạt ca rất gần đây với 11129 BN sau PCI, tỉ lệ phát sinh 0.7% [36, 37]. Tỉ lệ tử vong từ 4 đến 12%. Gần như tất cả BN bị mất máu đáng kể và phải truyền máu (73.5%-100%). Chụp mạch máu đùi trước khi rút sheath có thể phát hiện chảy máu đang diễn tiến, bàng quang bị đè ép từ ngoài bởi khối máu tụ và đôi khi cho phép điều trị khẩn cấp bằng tắc mạch máu chọn lọc. Tuy nhiên, rất hiếm khi chẩn đoán sớm [38]. Hầu hết biến chứng chảy máu thường biểu hiện trong 6 giờ đầu sau khi kết thúc thủ thuật. Cần phải nhấn mạnh rằng, trái với tiếp cận ĐM quay, một tỉ lệ đáng kể các biến chứng mạch máu liên quan đến tiếp cận ĐM đùi cần phải truyền máu hoặc phẫu thuật sửa chữa.
3. Tiếp cận động mạch quay
Thuận lợi giải phẫu chính yếu của ĐM quay so với ĐM đùi là nó nằm tương đối nông, dễ sờ hơn và dễ đè ép hỗ trợ để cầm máu (hình 7). Nguy cơ chảy máu nơi đâm kim do đó hạn chế. Trái với ĐM đùi hoặc ĐM cánh tay, không có thần kinh hay tĩnh mạch chính gần phụ cận ĐM quay, vì thế có thể ngăn ngừa tổn thương thần kinh khi đâm kim. ĐM quay nhỏ hơn CFA. Yoo và cộng sự sử dụng siêu âm 2 chiều ở 1191 trường hợp và thấy rằng đường kính trung bình của ĐM quay là 2.69 ± 0.40 mm ở nam và 2.43 ± 0.38 mm ở nữ (từ 1.15 mm đến 3.95 mm) [39]. Nó trái ngược với đướng kính CFA, trong khoảng 6 mm. ĐM trụ thỉnh thoảng dùng thay thế ĐM quay, cũng có đường kính tương tự động mạch quay nhưng nằm sâu hơn và có thần kinh trụ nằm lân cận.
Vẫn còn bàn cãi nhiều trong y văn và giữa các phẫu thuật viên về việc có nên kiểm tra hệ song tuần hoàn ở bàn tay trước khi đâm kim ĐM quay hay không [40]. ĐM quay và trụ nối với nhau tại bàn tay bằng cung gan tay nông và sâu. Tuy nhiên, một số lượng người đáng kể có kết nối mạch máu không hoàn thiện ở bàn tay. Khuyến cáo sử dụng nghiệm pháp Allen để xác định hệ song tuần hoàn ở bàn tay trước khi đâm kim ĐM quay. Nghiệm pháp được miêu tả đầu tiên vào năm 1929 để đánh giá tuần hoàn bàng hệ bàn tay ở những BN viêm thuyên tắc mạch máu (bệnh Buerger) [41].
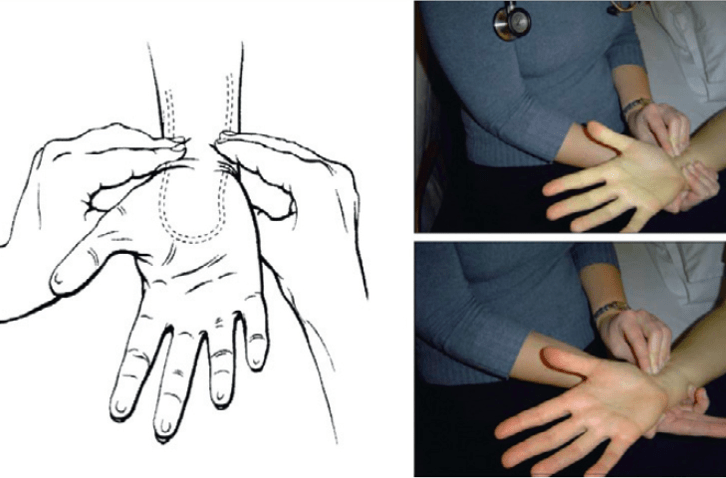
Hình 8:Nghiệm pháp Allen cải tiến
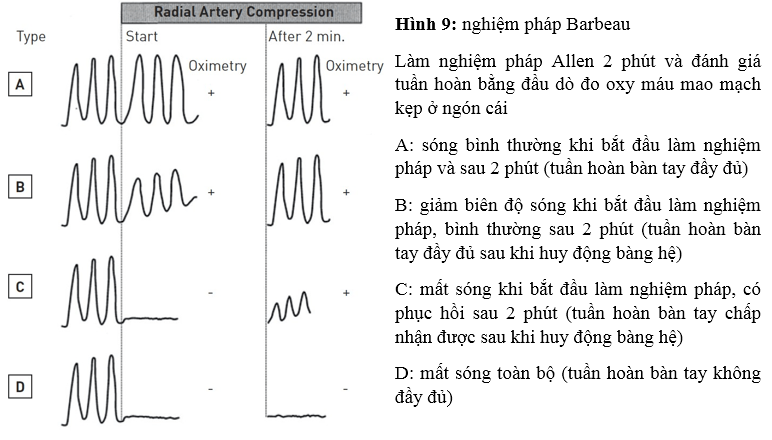
Nó được Wright cải tiến năm 1950 và trở thành “nghiệm pháp Allen cải tiến” áp dụng đến ngày nay (hình 8). Trong khi giữa áp lực làm nghẽn ĐM quay và trụ, bảo BN nắm chặt tay vài lần cho đến khi da lòng bàn tay trở nên “trắng hoặc tái nhợt” do ngưng tuần hoàn ở bàn tay. Sau đó bảo BN mở bàn tay ra, tránh duỗi quá mức. Phẫu thuật viên thả áp lực ở ĐM trụ, quan sát sự đổi màu ở bàn tay do được tái tưới máu trong khi ĐM quay vẫn bị nghẽn. Thởi gian đổi máu được ghi nhận từ 3 đến 15 giây [41]. Lập lại nghiệm pháp khi giữ ĐM trụ (nghiệm pháp Allen ngược). Bất thường khi không thấy sự đổi màu hoặc cần thời gian quá dài. Hạn chế chính của nghiệm pháp Allen liên quan đến tính chủ quan của nó và thiếu bằng chứng chứng minh nó là một yếu tố dự báo đáng tin cậy cho thiếu máu cục bộ bàn tay sau khi đâm kim ĐM quay [41]. Barbeau và cộng sự đề nghị sử dụng biểu đồ oxy máu mao mạch làm một phương pháp khách quan hơnđể đánh giá song tuần hoàn ở bàn tay trước khi đâm kim (hình 9) [42]. Ngoại trừ có đường cong “D” thể hiện dòng chảy bàng hệ từ ĐM trụ bị thiếu hoặc yếu và là chống chỉ định tương đối tiếp cận ĐM quay, biểu đồ oxy máu mao mạch cho phép sử dụng ĐM quay hơn 98% trường hợp. Quan trọng hơn là không có ca nào bị thiếu máu cục bộ bàn tay khi dùng phương pháp này. Mặc dù nghiệm pháp Allen cải tiến và biểu đồ oxy máu mao mạch là những kĩ thuật nhanh, không xâm lấn để đánh giá song tuần hoàn bàn tay trước khi tiếp cận ĐM quay, chúng vẫn còn tranh cãi vì thiếu giá trị dự báo thiếu máu cục bộ bàn tay. Thật ra, biến chứng này cực kì hiếm và ở một vài trường hợp do thuyên tắc xa hơn là do tắc nghẽn ĐM quay (radial artery occlusion – RAO) [43]. Cần những nghiên cứu thêm về cách đánh giá chức năng bàn tay để xác định RAO có hay không gây hậu quả có hại trên lâm sàng và liệu những nghiệm pháp này có dự báo được RAO hay chỉ ra được không sử dụng ĐM quay cho thông tim can thiệp.
Do ĐM quay có cỡ nhỏ và xu hướng co thắt, điều quan trọng là cả BN và phẫu thuật viên phải làm việc trong môi trường yên lặng. Tùy theo sở thích cá nhân, phẫu thuật viên có thể đâm kim khi ngồi hoặc đứng với cánh tay dạng ra hoặc xuôi theo ngườiBN (tiếp cận ĐM quay bên phải). Khi tiếp cận ĐM quay bên trái, cánh tay khép vào và cố định trên bụng để cho phẫu thuật viên làm việc ở bên phải. Đội ngũ phòng lab phải có khả năng chuẩn bị bất kì vị trí tiếp cận nào. Sử dụng tấm ván kê cẳng tay (hình 10A) và để cổ tay duỗi (ngửa) thoải mái sẽ giúp đâm kim mạch quay thành công. Siêu âm hướng dẫn cũng có thể dùng khi sờ mạch yếu, đặc biệt ở những BN bị shock tim.

Hình 10A: Ván kê cẳng tay phải
Một phân tích đa biến gần đây đã xác định các yếu tố dự báo đâm kim mạch quay thất bại ở những BN ổn định và không ổn định; mặc dù những điều này dựa trên kinh nghiệm của một trung tâm cấp cao thực hiện tiếp cận mạch quay thời gian dài, có thể dùng những thông tin này như một mẫu tham khảo (hình 10B và 10C) [44].
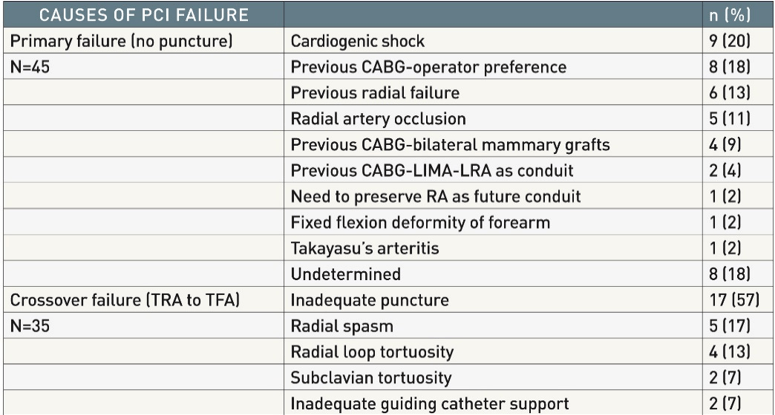
Hình 10B: Nguyên nhân PCI thất bại khi tiếp cận ĐM quay
Lựa chọn tiếp cận bên trái hay bên phải trong hầu hết trường hợp là tùy từng người [45, 46]. Trong nghiên cứu TALENT, thực hiện ở BN có cân nặng bình thường, thủ thuật thành công và phơi nhiễm phóng xạ cho BN và phẫu thuật viên là như nhau, mặc dù phởi nhiễm ít hơn ở những thủ thuật thực hiện bên trái [47, 48]. Điều này có thể là do tiếp cận mạch quay bên trái dễ hơn ở người cao tuổi, phụ nữ hoặc BN dáng người thấp nhờ mạch máu ít xoắn hơn. Chụp cầu nối ĐM vú trong thường ưu tiên làm ĐM quay bên trái hơn.
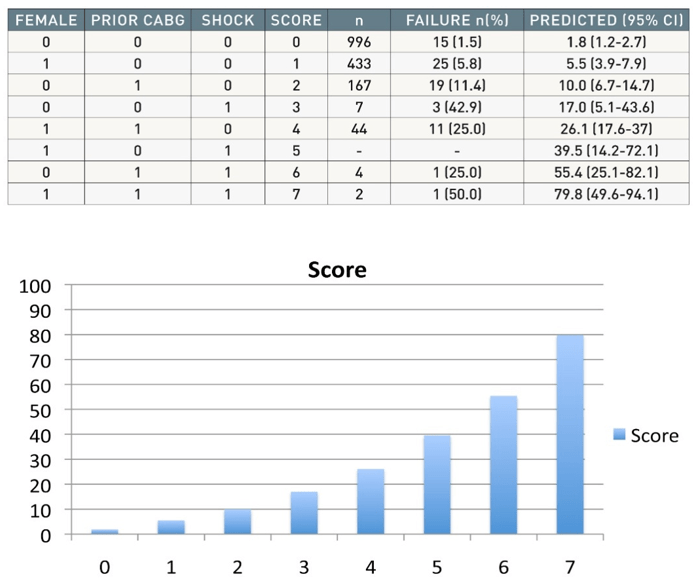
Hình 10C: Tỉ lệ PCI thất bại qua các yếu tố dự báo: nữ (1 điểm), CABG trước đây (2 điểm), shock (3 diểm)
Điều quan trọng khi tiếp cận bên tay phải là catheter bị xoắn bởi 2 điểm áp lực (thành ĐM chủ và thành ĐM dưới đòn), trái ngược với 1 điểm (khi tiếp cận mạch máu đùi hoặc tay trái) sẽ làm cho thao tác catheter khó hơn, đặc biệt khi có những biến thể giải phẫu khác nhau.
Mộ số bộ kit kim nhỏ được phát minh cho ĐM quay (hoặc trụ). Vị trí đâm kim ĐM quay thường cách mỏm trâm 2 cm. Đâm kim ĐM quay có thể thực hiện theo 2 cách. Cách thứ nhất, phẫu thuật viên có thể sử dụng kĩ thuật Seldinger cải tiến chỉ đâm vào thành trước với nòng kim 19-21 và luồn wire ngắn (0.018’’-0.035’’) vào khi thấy dòng phụt ngược (hình 3). Với kĩ thuật “angiocath (kĩ thuật đâm xuyên hay đâm kim thành sau), một khi phẫu thuật viên thấy dòng phụt ngược trên bầu kim, cho kim tiến tới xuyên qua thành sau đến khi dòng máu ngừng chảy ra. Rút kim và từ từ kéo cannula về cho đến khi nhìn thấy máu phụt ngược ra (hình 11). Lúc này, luồn wire vào cannula đã nằm trong lòng mạch. Chưa có nghiên cứu so sánh tỉ lệ thành công giữa 2 kĩ thuật. Do đó, chọn cách nào là tùy vào cá nhân. Kĩ thuật tương tự có thể dùng cho ĐM trụ (hình 12). Đâm kim thành trước cần đường cong học tập (learning curve) dài hơn kĩ thuật đâm xuyên và dễ luồn guidewire thất bại hơn với tỉ lệ bị tụ máu và tắc mạch tương đương [49]. Kim nòng kim loại giúp kĩ thuật thứ hai dễ hơn, trong khi kim dạng cannula có bầu phụt ngược thuận lợi cho kĩ thuật thứ nhất hơn. Siêu âm hướng dẫn giúp cải thiện tỉ lệ thành công của lần đâm kim đầu tiên, đặc biệt ở những trường hợp được xem là khó tiếp cận [50]. Đường kính sheath từ 4 Fr đến 8 Fr có thể sử dụng khi tiếp cận ĐM quay, mặc dù phần lớn thủ thuật chẩn đoán có thể thực hiện với 4-5 Fr và phần lớn PCI hiện nay thực hiện được với 5-6 Fr. Gần đây, kĩ thuật không dùng sheath với các catheter tiêu chuẩn tự làm hoặc các guiding catheter nòng lớn ưa nước được thiết kế đặc biệt (Eucath, ASAHI, Japan) đã được miêu tả dùng trong tiếp cận ĐM quay hoặc trụ [51]. Lợi ích lâm sàng thực thụ của cách tiếp cận này đang được làm rõ. Cần chú ý, sheath có lớp phủ ưa nước trở nên phổ biến trong các kĩ thuật qua đường quay vì chúng làm giảm lực cần thiết khi rút ra và ngăn ngừa co thắt xảy ra, làm BN dễ chịu. Tác dụng của những loại sheath hay catheter phủ lớp ưa nước này trên việc làm giảm nguy cơ RAO sau thông tim chưa được chứng minh. Sheath quay dài, 23 cm chẳng hạn, được ưa sử dụng hơn trong thời kì đầu của tiếp cận mạch quay như là một cách làm giảm co thắt nhưng phần lớn chúng đã bị loại bỏ gần đây và được thay thế bằng những loại ngắn hơn dùng chung với cocktail dãn mạch.
Ghi nhớ 3: Tiếp cận ĐM quay |
| – ĐM quay nằm nông và không có dây thần kinh lân cận, cho phép đè ép dễ dàng và không cần nằm nghỉ tại giường. – Tiếp cận ĐM quay hoặc trụ có thể thực hiện bằng kĩ thuật đâm trực tiếp vào thành trước hoặc kĩ thuật xuyên thành. – Các biến thể giải phẫu của trục quay – cánh tay – dưới đòn có thể làm phức tạp hoặc ngăn chặn quá trình đẩy catheter và thủ thuật. – Dự phòng co thắt ĐM quay luôn dễ hơn điều trị. |
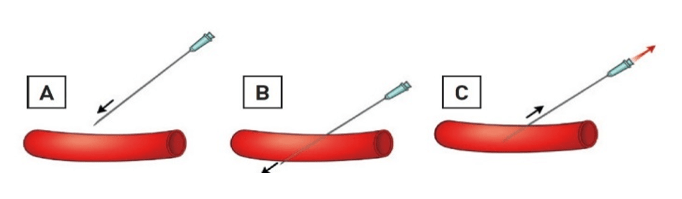
Hình 11:kĩ thuật xuyên thành
Hình 12: Đâm kim ĐM quay
4. Biến chứng tiếp cận ĐM quay
Như các mạch máu khác, đâm kim, luồn sheath, thao tác catheter trên ĐM quay (hoặc trụ) có thể dẫn đến tổn thương và các biến chứng mạch máu [52, 53]. Tuy nhiên, nhờ có đường kính nhỏ và nằm nông, tỉ lệ phát sinh biến chứng mạch máu sau thông tim qua đường quay tương đối hạn chế so với đường đùi, và quan trọng hơn là ảnh hưởng lâm sàng tương đối lành tính. Thậm chí sự hình thành nội mạc mới sau tổn thương (neointima formation) không loại trừ việc sử dụng lại ĐM quay. Tuy nhiên, có một số biến chứng liên quan đến kích cỡ nhỏ của ĐM quay và đặc hiệu cho cách tiếp cận qua đường quay. Ví dụ như sự suy giảm tính dãn mạch phụ thuộc và không phụ thuộc nội mạc sau khi thông tim qua đường quay đã được báo cáo [51]. Nó có thể phục hồi ở tháng thứ 3 và ảnh hưởng trên lâm sàng còn chưa rõ. Bảng 2 là các biến chứng liên quan đến thông tim qua mạch đùi hoặc mạch quay đã được trình bày qua y văn.
| Loại biến chứng | ĐM đùi | ĐM quay | |
| Trước 2000 | Sau 2000 | ||
| Tụ máu (> 5cm) | <10% | <5% | 1-3% |
| RPB | <2% | <2% | Không |
| Giả phình | 0.6-2.1% | <1-2% | <0.1% |
| Dò động tĩnh mạch | 0.1-0.4% | <1-2% | <0.1% |
| Huyết khối/thuyên tắc (thiếu máu cục bộ chi) | <0.5% | <0.1% | 0.8-10% khi xuất viện. Thiếu máu chi cực kì hiếm |
| Nhiễm trùng | <1% | <5% | <0.1% |
| Bóc tách/thủng | <1% | <1% | |
| Phẫu thuật sửa chữa | 1-20% | <5% | <0.1% |
Một phân tích tổng hợp từ nhiều thử nghiệm lâm sàng gần đây báo cáo tỉ lệ phát sinh biến chứng mạch máu lớn là 1.4% (49/3507 ca) khi tiếp cận đường quay so với 3.7% (131/3514 ca) khi tiếp cận đường đùi, giảm nguy cơ tương đối là 63% (OR 0.37, 95% CI 0.27 to 0.52, P <0.0001) [55]. Dữ liệu các nghiên cứu từ trước đến nay đều báo cáo chung tần suất thất bại khi tiếp cận ĐM quay là dưới 5% [56]. Lý do thất bại bao gồm dâm kim không thành công, co thắt và các biến thể giải phẫu (ĐM quay, thân cánh tay đầu bất thường, tạo vòng quá mức…), có thể kể thêm vào là do thiếu kinh nghiệm, kích thước ĐM nhỏ hoặc giảm đường kính mạch máu tạm thời hay vĩnh viễn (bảng 3).
| Phân loại theo thủ thuật | Tỉ lệ phát sinh (khi chụp mạch vành) |
| Trục ĐM quay – cánh tay | |
| Mạch quay không có | <0.03% |
| Hẹp xơ vữa ĐM quay đáng kể (>50%) | 0.4% |
| Xoắn ĐM quay và cánh tay (bẻ cong >45 độ) | 5.9% |
| Vòng ĐM quay (vòng 360 độ trên đường đi ĐM, không nằm ở vị trí thông nối) | 0.3% |
| Vòng quay – trụ (vòng 360 độ ở vị trí thông nối ĐM cánh tay – trụ) | 0.7% |
| Vòng ĐM cánh tay (vòng 360 độ trên đường đi ĐM, không nằm ở vị trí thông nối) | 0.1% |
| ĐM quay nguyên ủy cao (từ ĐM cánh tay hoặc ĐM nách) | 3.4% |
| Bất thường khác (không hoặc ảnh hưởng nhỏ đến tiếp cận ĐM quay) | 0.01% |
| ĐM cánh tay phụ (2 ĐM cánh tay hợp lại rồi phân ra 2 ĐM cẳng tay) | |
| Trục ĐM dưới đòn – ĐM nách | |
| Xoắn nặng (gập >90 độ) | 1.7% |
| Hẹp xơ vữa đáng kể (>50%) | 0.6% |
| Cung ĐM chủ | |
| ĐM dưới đòn phải sau thực quản (arteria lusoria) | 0.1% |
| Cung ĐM chủ kéo dài | 0.1% |
| Bất thường khác (không hoặc ảnh hưởng nhỏ đến tiếp cận ĐM quay) | 0.3% |
| Dãn ĐM chủ lên có liên quan đến rối loạn hướng đi của nó (tạo góc nhọn giữa ĐM chủ lên và trục dài của cung ĐM chủ | |
ĐM quay có tính phản ứng cao với một vài chất hoạt mạch. Các nhà phẫu thuật tim từ lâu đã nhận ra xu hướng co thắt nghiêm trọng và thỉnh thoảng kéo dài của nó và thử nghiệm một số chất dãn mạch cả in vitro lẫn in vivo. Đặc biệt, lớp áo ngoài giàu thụ thể alpha-adreno làm cho ĐM quay rất nhạy cảm với chấn thương cục bộ và gây ra co thắt. Kiemeneij và cộng sự tìm ra tỉ lệ phát sinh của co thắt ĐM quay (radial artery spasm – RAS) là 34% (RAS được dịnh nghĩa là đau kèm theo lực tối đa >1 kg để kéo sheath 6Fr 23 cm khi không sử dụng chất dãn mạch) [56]. Tỉ lệ này giảm còn 14% khi kết hợp verapamil (5 mg) và nitroglycerine tiêm vào trong lòng mạch. Thuốc hoặc hỗn hợp thuốc dãn mạch tối ưu để giảm thiểu nguy cơ RAS vẫn còn đang được xác định, dù vậy trong thử nghiệm ngẫu nhiên SPASM, Varenne và cộng sự thấy tỉ lệ phát sinh RAS là 4.9% khi kết hợp 2.5 mg verapamil + 1 mg molsidomine so với 13% cho verapamil (5 mg) và 22.2% khi không dùng thuốc nào [57]. Những sheath ngắn hơn ít kích thích RAS hơn và dùng sheath phủ lớp ưa nước làm giảm tỉ lệ phát sinh RAS từ 60 đến 100% [52, 59]. Trong trường hợp RAS nghiêm trọng xảy ra khi làm thủ thuật, papaverine, một chất dãn cơ trực tiếp, hoặc giảm đau mạnh với midazolam/sufentanil tĩnh mạch hoặc gây tê vùng là cần thiết. Có những trường hợp rất hiếm ĐM quay bị xé đứt một phần hay hoàn toàn được mô tả, khi phẫu thuật viên rút mạnh catheter hoặc sheath bị kẹt lúc ĐM quay co thắt nặng và lan tỏa [60].
Thất bại khi tiếp cận có thể là do bất thường giải phẫu, xoắn hoặc tạo vòng khó chịu ở ĐM cánh tay và ĐM quay. Tỉ lệ phát sinh của những biến thể giải phẫu gần 5% [61, 62]. Phần lớn phẫu thuật viên tìm cách vượt qua chúng bằng wire ưa nước, wire chỉnh hình mạch máu 0.014” hoặc catheter ưa nước. Nên thực hiện chụp ĐM chi trên trong trường hợp đẩy wire hoặc catheter thấy khó khăn, vì không xác định được vấn đề có thể dẫn đến thủng hoặc bóc tách mạch máu. Bóc tách ĐM quay hoặc cánh tay có thể rất ấn tượng trên hình chụp mạch nhưng cần nhấn mạnh đây là bóc tách ngược dòng. Vì thế, nên thử đẩy wire chỉnh hình mạch máu 0.014” qua. Nếu cố gắng thành công, catheter sẽ chèn được bóc tách hoặc thủng và sẽ không gây hậu quả lâm sàng cho BN. Không nhận ra được thủng mạch máu có thể rất nguy hiểm vì chảy máu trong cơ chậm từ từ sẽ dẫn đến hội chứng chèn ép khoang.
Tỉ lệ phát sinh hội chứng chèn ép khoang sau khi chảy máu trong cơ hoặc tổn thương mạch máu cực kì thấp ngưng phải được nhận ra sớm vì có thể dẫn đến hậu quả tai hại. Một nghiên cứu công bố hội chứng chèn ép khoang là 5 ca trên 250 BN được điều trị (2%), trong khi một nghiên cứu gần đây báo cáo 2 ca trên 51296 thủ thuật (<0.01%) [63]. Phẫu thuật mở cắt cơ có thể tránh được nếu thực hiện sớm những biện pháp dự phòng hữu hiệu ngay khi nghi ngờ chảy máu cục bộ. Gồm (1) ngưng điều trị kháng đông tĩnh mạch, (2) kiển soát huyết áp và đau, (3) Sử dụng chèn ép ngắt quãng bên ngoài bằng bao đo huyết áp.
Hai phân tích gộp cho thấy giảm nguy cơ tương đối chảy máu >75% khi tiếp cận ĐM quay so với tiếp cận ĐM đùi [65, 66]. Lợi ích của tiếp cận ĐM quay vẫn còn ngay cả khi VSD được sử dụng khi tiếp cận ĐM đùi [66]. Chảy máu ở vị trí tiếp cận chiếm 60-80% các trường hợp chảy máu khi tiếp cận ĐM đùi và lợi ích chính của tiếp cận ĐM quay là làm giảm ngoạn mục chảy máu lớn liên quan đến vị trí tiếp cận. Hầu hết những nghiên cứu đầu tiên so sánh chảy máu giữa tiếp cận ĐM quay và đùi không sử dụng phân loại chảy máu tiêu chuẩn. Gần đây, trong nghiên cứu EASY sử dụng tiếp cận mạch quay và heparin với abciximab trên tất cả mẫu được chọn, tác giả báo cáo tỉ lệ phát sinh chảy máu lớn là 1.4% khi sử dụng tiêu chuẩn PCI Linking Angiomax to Reduced Clini”>REPLACE-2 và 0.5% khi sử dụng tiêu chuẩn TIMI [67]. Họ cũng phát triển sơ đồ phân loại máu tụ áp dụng cho tiếp cận đường quay, có thể sánh với phân độ kích thước tụ máu đã được đề xuất gần đây cho tiếp cận đường đùi [66] (hình 13). Trong nghiên cứu thực hiện với kháng kết tập tiểu cầu tối đa này, tỉ lệ phát sinh tụ máu <5 cm (độ I) là 5.3%, <10 cm (độ II) là 2.5%, ở xa khủy tay (độ III) là 1.6% và ở gần khủy tay (độ IV) là 0.1%. Cần lưu ý rằng trong khi độ I và III liên quan trực tiếp đến vị trí đâm kim, phân độ cao hơn thường là hậu quả của tổn thương mạch máu và thủng nhỏ do wire. Chúng có thể tiến triển thành tụ máu rất hiếm như ở cơ ngực, cổ hoặc thậm chí là trung thất. Nên nhớ là sử dụng chất kháng thrombin mới như bivalirudin giảm tỉ lệ phát sinh chảy máu lớn ở đùi nhưng không giảm ở quay [69].
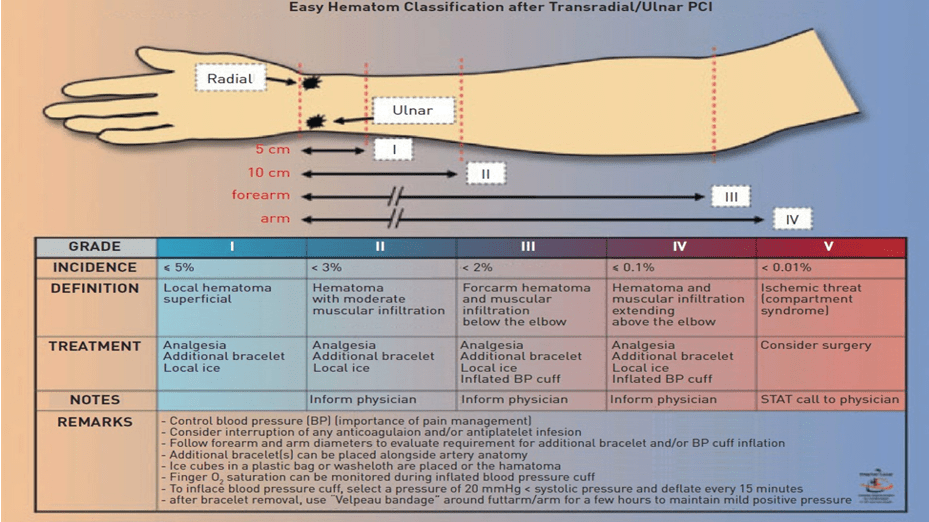
Hình 13: Phân độ tụ máu sau khi PCI qua ĐM quay/trụ theo EASY
Điều trị kháng đông khi tiếp cận đường quay là cần thiết để làm giảm nguy cơ RAO sau khi thông tim. Mặc dù hầu hết không triệu chứng, tỉ lệ phát sinh RAO khi xuất viện khác nhau từ 0% đến >10% phụ thuộc vào kĩ thuật cầm máu, liệu trình kháng đông và phương pháp đánh giá thông dòng chảy ĐM quay. Spaulding và cộng sự đánh giá RAO sau thủ thuật bằng siêu âm Dopper, 4-5 giờ sau khi tiếp cận đường quay với sheath 5Fr ở những liều heparin khác nhau. Không có heparin, tỉ lệ phát sinh RAO là 74%, giảm xuống còn 4.3% với 5000 UI heparin [70]. Một nghiên cứu ngẫu nhiên gần đây sử dụng sheath 5bFr chụp mạch vành chẩn đoánxác định liều 5000 UI heparin hữu hiệu hơn 2500 UI [71]. Các yếu tố khác có liên quan với ĐM quay thông suốt sau thông tim gồm không tương hợp catheter – ĐM, nữ giới, đã điều trị với clopidorel, đái tháo đường và kĩ thuật cầm máu. Thật ra, gần đây dã chứng minh rằng duy trì ĐM quay thông suốt trong khi cầm máu giảm tỉ lệ phát sinh RAO đến 50% [72, 73]. Cần chú ý rằng tỉ lệ phát sinh RAO dường như không bị ảnh hưởng bởi có sử dụng bivalirudin hay heparin trọng lượng phân tử thấp hay không ngoài heparin, cũng như là thuốc đường tĩnh mạch hay ngoài tĩnh mạch [73, 74]. Tại thời điểm hiện tại, mặc dù kĩ thuật cầm máu kèm giữ thông suốt mạch máu có lợi trong việc làm giảm RAO, nhưng nó vẫn chưa xác định được rằng liệu có thể điều chỉnh thêm bởi loại thiết bị cầm máu được sử dụng hay không [46].
Ngoài ra, cần phải nhấn mạnh rằng nên cân nhắc hệ song tuần hoàn bàn tay, phần lớn các trường hợp RAO là không triệu chứng và tỉ lệ phát sinh giảm theo thời gian sau thủ thuật. Ngược lại, kéo dài thời gian đè ép ĐM quay có thể làm RAO dai dẳng và suy giảm phản xạ thần kinh giao cảm (reflex sympathetic dystrophy). Biến chứng do chấn thương mạch máu như giả phình hoặc dò động tĩnh mạch hiếm gặp, có thể là do kích thước mạch máu nhỏ. Chúng thường kiểm soát được bằng đè ép lặp lại và kéo dài, thường không cần phẫu thuật can thiệp. Sử dụng loại sheath phủ lớp ưa nước (Cook Inc., USA) có liên quan đến phản ứng u hạt tại chỗ (granulomatous local reactions ) nghiêm trọng trên da [75]. Tiến hành chụp mạch và can thiệp trên ĐM quay tạm thời làm giảm tưới máu ngón tay trong lúc làm thủ thuật, nhưng không liên quan đến suy chức năng bàn tay vĩnh viễn [76].
Ghi nhớ 4: Biến chứng tiếp cận ĐM quay |
| – Chảy máu chỗ tiếp cận hiếm và dễ kiểm soát. – Biến chứng mạch máu hiếm và thường không cần phẫu thuật. – Kháng đông cần thiết để giảm RAO, ngay cả sau khi chụp mạch vành chẩn đoán. – RAO, hầu hết trường hợp không triệu chứng, có thể liên quan đến thiếu máu cục bộ bàn tay, do đó tần suất xuất hiện của nó sẽ giảm đi bằng cách sử dụng heparin, sheath cỡ nhỏ và cầm máu giữ thông mạch máu. – Hội chứng chèn ép khoang hiếm nhưng là biến chứng đe dọa khi tụ máu cẳng tay tiến triển nhanh. Nó phải được chú ý và kiểm soát mạnh mẽ. |
Tóm lại, biến chứng mạch máu sau chụp mạch vành chẩn đoán và can thiệp qua đường quay hiếm gặp, và hầu như luôn có thể diều trị bảo tồn. Giảm những biến chứng này so với ĐM đùi cũng liên quan đến giảm 15% chi phí chăm sóc sức khỏe [77]. Cần nhấn mạnh rằng kinh nghiệm tích lũy 15 năm qua khi tiếp cận ĐM quay chỉ ra rằng nhận biết nhanh biến chứng là vô cùng quan trọng để ngăn ngừa những hậu quả nghiêm trọng hơn như thiếu máu cục bộ bàn tay hoặc phẫu thuật.
5. Các đường tiếp cận khác
Tiếp cận ĐM trụ
ĐM trụ thường có đường kính lớn hơn ĐM quay. Nó có thển sử dụng như một đường tiếp cận thay thế dễ dàng ngay cả khi tắc mạch quay cùng bên hoặc ngay sau khi thử đường quay thất bại. Báo cáo các trường hợp đầu tiên trong chụp mạch vành là của Terashima và cộng sự [78]. Những nghiên cứu quan sát và ngẫu nhiên tiếp theo ủng hộ tiếp cận qua trụ là an toàn và hiệu quả. Một nghiên cứu ngẫu nhiên nhỏ bởi các phẫu thuật viên kinh nghiệm gợi ý tỉ lệ thành công tương đương khi tiếp cận ĐM quay và ĐM trụ trong thủ thuật chẩn đoán và can thiệp mạch vành mà không gây tổn thương thần kinh trụ nằm gần đó [79]. Một nghiên cứu đa trung tâm lớn hơn gồm 902 BN ngẫu nhiên thực hiện PCI qua ĐM quay hoặc trụ cho thấy rằng kết cục chính (gồm chuyển qua ĐM khác, MACEs và các biến cố mạch máu lớn chi trên ở ngày thứ 60) của ĐM trụ kém hơn, nguyên nhân là do phải chuyển qua ĐM khác nhiều hơn (32.3% so với 5.9%). Một khi tiếp cận ĐM trụ thành công, các biến chứng lớn không khác biệt có ý nghĩa giữa 2 phương pháp [80]. Tổng quan hệ thống và phân tích gộp theo cặp 6 nghiên cứu ngẫu nhiên (n=5267) so sánh tiếp cận qua đường trụ với đường quay không kém hơn ở những kết cục chính có liên quan [81]. Tuy nhiên, phần lớn thủ thuật được thực giện bời những phẫu thuật viên có kinh nghiệm.
Cần thêm những dữ liệu trước khi công nhận đường tiếp cận này tương đương với đường quay trong cộng đồng can thiệp rộng hơn, và sử dụng siêu âm nên cân nhắc bắt buộc để giúp giảm thiểu biến chứng. Mặc dù tần suất bất thường giải phẫu, đặc biệt vòng xoắn quay – trụ, làm cho không thể tiếp cận qua đường quay là thấp (<2%), khả năng thực hiện được đường tiếp cận khác ở chi trên như ĐM trụ là rất đáng quý [82].
Tiếp cận qua ĐM quay ở xa
Kĩ thuật này liên quan đến việc đâm kim vào đoạn xa ĐM quay ở hõm lào giải phẫu. Nó được phát triển bởi Babunashvilli [83] và từ đó sự thuận tiện của nhánh xa ĐM quay bên trái (left distal transradial artery – ldTRA) được truyền bá và cỗ vũ như một phương pháp tiếp cận mặc định bởi những người khai sinh ra nó [84, 85, 86]. Kĩ thuật này cũng dễ dàng cho can thiệp vùng bụng [87].
Những thuận tiện của kĩ thuật gồm thoải mái cho BN (sử dụng tay không thuận và cho phép cử động tự do hơn so với cách tiếp cận ĐM quay truyền thống), hỗ trợ thoải mái khi làm việc, BN nhanh hoạt động lại và nhanh xuất viện hơn [88] và bảo tồn vị trí tiếp cận ĐM quay truyền thống. Nhờ giữ được đoạn gần ĐM quay nên có thể dùng cho phẫu thuật bắc cầu mạch vành tạo dò động tĩnh mạch khi cần điều trị thay thế thận. Những ích lợi này đặc biệt có giá trị ở BN viêm khớp nặng ở chi trên hoặc béo phì.
Cần có những thử nghiệm lâm sàng ngẫu nhiên so sánh ldTRA với can thiệp ĐM quay truyền thống để đánh giá hiệu quả của nó. Các dữ liệu hiện có đã báo cáo tần suất thấp xuất hiện biến chứng nhưng cần những dữ liệu đa trung tâm và ngẫu nhiên để xác định.
Vị trí đâm là hõm lào giải phẫu, nằm xa cung ĐM gan tay nông và gần ĐM ngón cái chính. Tại điềm này đường kính ĐM tương tự như đoạn gần ĐM quay. Bằng cách về phía xa cung ĐM gan tay nông, nếu có tắc mạch xảy ra sẽ không ảnh hưởng đến cấp máu bàn tay. Hõm lào giải phẫu có giới hạn bờ bên trụ là dây chằng cơ duỗi ngón cái dài và bờ bên quay là dây chằng cơ dạng ngón cái dài và cơ duỗi ngón cái ngắn. Nền hõm là xương tháp và xương thang.
6. Khác
Tiếp cận ĐM cánh tay
Bộc lộ ĐM cánh tay từng là kĩ thuật tiếp cận mạch máu tiêu chuẩn trong thời kì tiên phong của tim mạch can thiệp. Kĩ năng yêu cầu đã mất dần theo thời gian do thủ thuật này càng ít được thực hiện và tiếp cận ĐM quay và đùi hiện tại gần như luôn thành công. Có những trường hợp phải tiếp cận ĐM cánh tay như trong bệnh ĐM ngoại biên nặng như viêm mạch Takayasu. ĐM cánh tay nằm gần thần kinh giữa và không có tuần hoàn bàng hệ nên phải thực hiện bởi phẫu thuật viên có đầy đủ kinh nghiệm. Huyết khối ĐM và tổn thương thần kinh giữa là những biến chứng nguy hiểm. Tiếp cận qua da được báo cáo là có nguy cơ biến chứng cao hơn vì bộc lộ ĐM có thể cầm máu tốt hơn.
Tiếp cận qua thắt lưng
Đây chỉ là lịch sử. BN nằm sấp và đâm kim dưới hướng dẫn huỳnh quang vào góc giữa cột sống và xương sườn thứ 12, đi kim dọc theo cột sống cho đến khi chạm vào động mạch chủ.
Tiếp cận qua nách
Thường được miêu tả là tiếp cận dưới đòn, nhưng về mặt giải phẫu là đâm kim qua da (trái với phẫu thuật bộc lộ) vào ĐM nách giữa bờ ngoài xương sườn thứ nhất và bờ trong cơ tròn lớn. Vị trí tiếp cận này có dữ liệu hạn chế và dựa vào kinh nghiệm cá nhân. Trong quá khứ, thủ thuật mạch vành xâm lấn qua đường này có tần suất biến chứng cao, bao gồm tổn thương đám rối cánh tay, nhưng nó được quan tâm gần đây trong thời đại thay van ĐM chủ qua da như một vị trí tiếp cận thay thế đường đùi. Trong trường hợp này, nhiều nghiên cứu hiện tại sử dụng siêu âm hoặc huỳnh quang hướng dẫn cùng với 1 wire dự phòng đặt qua đường đùi, cả hai sẽ giúp xác định ĐM và cho phép phủ stent khi đóng mạch máu thất bại. Tuy nhiên, cần những dữ liệu lớn hơn trong cộng đồng can thiệp để đánh giá sự hữu hiệu và an toàn của phương pháp này.
7. Ảnh hưởng của chảy máu do vị trí tiếp cận và chảy máu không do vị trí tiếp cận
Từ lâu đã nhận ra rằng mất máu và chảy máu trung bình có liên quan đến PCI qua đường đùi. Trong những năm 1980, BN sau PTCA và chông đông heparin bị giảm Hb 1-2 g/dL trong vòng 24 giờ, và 6% BN bị giảm Hb >3 g/dL [88, 89]. Một nghiên cứu gần đây với PCI qua đường quay và heparin + abciximab, Hb trung bình giảm 0.6 ± 1.0 g/dL và chỉ 1.3% BN giảm >3 g/dL trong vòng 24 giờ [90]. Hầu hết biến chứng mạch máu phát sinh từ PCI qua đùi, như tụ máu lớn hoặc RPB, là đáng kể, thỉnh thoản cần truyền máu, can thiệp phẫu thuật xâm lấn và quan trọng hơn là phải ngưng điều trị chống huyết khối sau đặt stent. Chảy máu lớn, dù theo định nghĩa và dùng liệu trình chống đông nào đi nữa thì cũng xác định là yếu tố dự báo độc lập tử vong và các biến chứng có hại sau PCI qua đùi hoặc quay [67, 91]. Cần nhấn mạnh rằng chảy máu liên quan vị trí tiếp cận chiếm >50% trường hợp chảy máu lớn. Gần đây, chảy máu không liên quan vị trí tiếp cận được báo cáo chiếm khoảng 60% chảy máu lớn ở những BN bị hội chứng vành cấp [55]. Doyle và cộng sự xem xét lại tỉ lệ phát sinh chảy máu lớn đường đùi ở 17901 BN tại Mayo Clinic chia làm 3 nhóm: nhóm 1 (1994-95), nhóm 2 (1996-99) và nhóm 3 (2000 to 2005). Nhìn chung, tỉ lệ phát sinh chảy máu lớn (tụ máu >4 cm hoặc chảy máu cần truyền máu, phẫu thuật hay kéo dài thời gian nằm viện; hoặc RPB) giảm từ 8.4% ở nhóm 1 đến 5.3% ở nhóm 2 và 3.5% ở nhóm 3 [92]. Giảm cỡ sheath, cường độ và thởi gian chống dông heparin, thời gian thủ thuật được xác định là yếu tố dự báo độc lập của chảy máu lớn qua đường đùi. Một nghiên cứu quan sát lớn gồm 103070 BN thực hiện PCI đường đùi cho thấy sheath lớn (7Fr và 8Fr) liên quan đến biến chứng mạch máu, chảy máu, truyền máu, tử vong và MACEs nhiều hơn so với sheath 6Fr [93]. Ngoài giảm cỡ sheath, sử dụng chất ức chế thrombin trực tiếp như bivalirudin làm giảm có ý nghĩa chảy máu do vị trí tiếp cận và không do vị trí tiếp cận sau khi PCI qua đường đùi [94]. Ảnh hưởng của chảy máu không do vị trí tiếp cận trên kết cục lâm sàng dường như còn lớn hơn chảy máu do vị trí tiếp cận [95].
Lợi ích chính yếu của tiếp cận qua đường quay là xóa bỏ thực sự chảy máu liên quan vị trí tiếp cận dù sử dụng bất cứ liệu trình kháng đông nào [55, 67, 96]. Trong nghiên cứu quan sát lớn MORTAL, các tác giả đánh giá tỉ lệ phát sinh và ảnh hưởng lâm sàng của việc truyền máu quanh thủ thuật ở 32822 BN sau khi PCI qua đường đùi hoặc quay [97]. Tỉ lệ truyền máu giảm một nửa khi tiếp cận đường quay và điều này tương quan với giảm tử vong 30 ngày và 1 năm sau khi điều chỉnh các yếu tố gây nhiễu. Lợi ích giảm tỉ lệ truyền máu của tiếp cận mạch quay so với đùi cũng thể hiện trong phân tích gộp các nghiên cứu ngẫu nhiên với tỉ lệ là 0.8% (43/5424) sau khi tiếp cận mạch quay so với 1.2% (67/5438) sau khi tiếp cận mạch đùi [55]. Do mối quan hệ giữa chảy máu quanh thủ thuật, truyền máu và tử vong, người ta giả thiết rằng tiếp cận đường quay có thể làm giảm nguy cơ tử vong so với đường đùi. Trong nghiên cứu lớn nhất hiện nay, radial versus femoral trial (RIVAL), Jolly và cộng sự tập hợp ngẫu nhiên 7021 BN hội chứng vành cấp chụp mạch vành chẩn đoán và có thể PCI. Sau 30 ngày, kết cục chính bao gồm tử vong, nhồi máu cơ tim, đột quỵ và CABG không liên quan đến chảy máu (ngưỡng cắt giảm Hb 5 g/gl và chảy máu nhìn thấy được) là 3.7% ở nhóm quay và 4% ở nhóm đùi (p=0.50). Tỉ lệ biến chứng mạch máu lớn giảm có ý nghĩa với 1.4% ở nhóm quay so với 3.7% ở nhóm đùi (p<0.0001). Tỉ lệ từ vong 30 ngày sau khi PCI cho phân nhóm STEMI giảm có ý nghĩa với 1.3% ở nhóm quay so với 3.2% ở nhóm đùi (HR 0.39, 95% CI 0.20-0.76, p=0.006) [55]. Quan trọng hơn, các tác giả quan sát thấy những trung tâm nhiều kinh nghiệm (>300 thủ thuật 1 năm) đạt được kết quả tốt hơn khi tiếp cận đường quay ở nhóm BN nguy cơ cao (STEMI). Sau khi kết quả RIVAL được công bố, cộng đồng can thiệp khuyến cáo cần giáp dục và đào tạo tiếp cận mạch quay tốt hơn, bây giờ là class IIa trong khuyến cáo ACC/AHA/SCAI [52, 98]. Nghiên cứu gân đây hơn RIFLE-STEACS gồm 1001 BN bị STEMI ngẫu nhiên tiếp cận đường quay hoặc đùi. Các tác giả thấy lợi ích khi tiếp cận đường quay về mặt kết cục chính là các biến cố lâm sàng NACE (MACE + biến chứng chảy máu lớn) (21% vs 13.6% p=0.003). MACE sau 30 ngày tốt hơn ở nhóm tiếp cận đường quay (7.2% vs 11.4% p=0.029), được thúc đẩy bởi giảm tử vong tim mạch [99]. Biến chứng chảy máu cũng giảm, hoàn toàn là do giảm 47% chảy máu liên quan vị trí tiếp cận. Nghiên cứu STEMI-RADIAL gồm 707 BN bị STEMI ngẫu nhiên tiếp cận đường quay hoặc đùi cũng thấy giảm ngoạn mục biến chứng liên quan đến vị trí tiếp cận (1.4% vs 7.2% p=0.0001) nhưng không giảm MACE giữa 2 nhóm [NACE 4.6%vs 11.0% p=0.0028, MACE3.5% vs 4.2% p=0.7] [100].Cần chú ý những nghiên cứu này có sự khác nhau về điều trị kháng đông, tần suất sử dụng bivalirudin thấp (<10%) và sử dụng VDS đùi thấp (<30%). RIFLE-STEACS được đề cập cụ thể trong những nghiên cứu ngẫu nhiên SAFARI-STEMI và MATRIX sắp tới.
Nghiên cứu ngẫu nhiên SAFE-PCI đánh giá tiếp cận ĐM quay và đùi ở phụ nữ thực hiện PCI hoặc chụp mạch vành (chủ yếu là thủ thuật cho nonSTE-ACS và thủ thuật chương trình nguy cơ thấp hơn). Các tác giả trình bày một số bằng chứng giảm chảy máu theo phân độ BARC ở toàn bộ BN (0.6% vs 1.7% p=0.03), nhưng không thấy ở nhóm BN làm PCI (1.2% vs 2.9% p=0.12). Tỉ lệ giảm chảy máu phù hợp với những nghiên cứu trước đây. Bivalirudin được dùng trong 59.1% trường hợp quay và 65.8% trường hợp đùi. VCD được sử dụng trong 5.1% trường hợp (chuyển từ quay sang đùi) và 65.5% trường hợp phân bố ngẫu nhiên ban đầu là nhóm đùi [TCT 2013 Rao S].
Những BN nguy cơ cao dường như có lợi nhất. Ngay cả shock tim không phải là chống chỉ định khi tiếp cận đường quay ở những trung tâm kinh nghiệm nhưng thách thức vì mạch bắt yếu [101]. Hơn nữa thời gian door – device trong PCI tiên phát không tăng có ý nghĩa khi so sánh với tiếp cận đường đùi ở những nghiên cứu quan sát sổ bộ lớn [102].
Cho dù tiếp cận mạch quay có bằng chứng giảm biến chứng liên quan vị trí tiếp cận và có tiềm năng sử dụng trong STEMI, một số dữ liệu quan sát gần đây gợi ý rằng những phẫu thuật viên thường dùng mặc định ĐM quay có thể gặp nhiều biến chứng liên quan đến vị trí tiếp cận khi phải chuyển qua đường đùi [103].
Do sự gia tăng sử dụng tiếp cận ĐM quay, những khuyến cáo đồng thuận cập nhật hiện tại từ châu Âu hoặc Bắc Mĩ đã cung cấp cho các bác sĩ lâm sàng một cơ cấu về định nghĩa kĩ thuật, chỉ định tối ứu và kinh nghiệm đào tạo [104, 105].
Tóm lại, mặc dù tiếp cận ĐM đùi vẫn là vị trí thông dụng nhất cho thông tim can thiệp, lợi ích của đường quay làm giảm biến chứng mạch máu và chảy máu quanh thủ thuật có thể chuyển thành xu thế trong tương lai. Chất ức chế thrombin trực tiếp như bivalirudin hoặc liệp pháp kháng đông mới trong tương lai có làm giảm chảy máu không liên quan vị trí tiếp cận là quay hay đùi sẽ được thử nghiệm trong các ngiên cứu ngẫu nhiên. Quan trọng là phải có đường cong học tập (learning curve) và lượng bệnh thủ thuật cần thiết để thực hành kĩ thuật thực hiện an toàn và hiệu quả. Điều này có nghĩa là phẫu thuật viên làm đùi số lượng lớn khi tình cờ phải làm quay có thể gặp tỉ lệ thành công và biến chứng không thể chấp nhận được, ngược lại tương ứng với những người chuyên làm quay. Dưới những tình huống này, không có kĩ thuật nào là duy nhất. Thay vào đó là tiếp cận cân bằng dựa trên các yếu tố về lâm sàng, giải phẫu, kĩ thuật và phẫu thuật viên.
| Ghi nhớ 5: Chảy máu do vị trí tiếp cận và chảy máu không do vị trí tiếp cận |
| – Chảy máu lớn sau khi tiếp cận quay hoặc đùi là yếu tố dự báo tử vong độc lập. – Đường ĐM quay giảm đáng kể biến chứng và chảy máu liên quan đến vị trí tiếp cận. – Ảnh hưởng lâm sàng của chảy máu không do vị trí tiếp cận mạnh hơn chảy máu do vị trí tiếp cận. |
Câu hỏi tự lượng giá
1. Tiếp cận động mạch đùi trong tim mạch can thiệp
A. Căn cứ đâm kim giữa nếp gấp bẹn và nơi mạch nảy mạnh nhất
B. Vị trí đâm kim vào động mạch đùi chung là lý tưởng và ít biến chứng nhất
C. Dưới màn huỳnh quang, vị trí đâm tối ưu nằm giữa đường trung tâm và phần ở dưới ngang qua đầu xương đùi.
D. A, B, C đúng
E. B và C đúng
2. Biến chứng tiếp cận động mạch đùi
A. Hay xảy ra ở những BN bất động tại giường không đủ 24 giờ.
B. Chảy máu sau phúc mạc thường phát hiện dễ dàng ngay sau can thiệp
C. Đâm kim vào ĐM đùi chung ít biến chứng mạch máu hơn là đâm cao (ĐM chậu ngoài) hoặc thấp (vào ĐM đùi nông hoặc đùi sâu)
D. Chỉ một số ít biến chứng mạch máu do đâm kim động mạch đùi là phải phẫu thuật
E. Tất cả đều đúng
3. Tiếp cận động mạch quay trong tim mạch can thiệp
A. Dễ tổn thương thần kinh quay
B. Xu hướng dễ co thắt làm trở ngại can thiệp
C. Phải thực hiện các nghiệm pháp đánh giá hệ tuần hoàn mạch máu bàn tay trước khi tiếp cận động mạch quay để tránh biến chứng thiếu máu cục bộ bàn tay
D. Kĩ thuật đâm kim xuyên thành dễ thành công hơn nhưng gây tụ máu nhiều hơn
E. Tất cả đều sai
4. Biến chứng tiếp cận động mạch quay
A. Co thắt ĐM quay xảy ra nhiều hơn khi dùng sheath ngắn, không có cocktail dãn mạch
B. Tắc ĐM quay thường dẫn đến hậu quả lâm sàng nghiêm trọng
C. Biến chứng chảy máu hiếm và thường không cần phẫu thuật
D. Tất cả các thuốc chống đông làm giảm biến chứng tắc ĐM quay
E. Phân độ tụ máu theo EASY gồm 4 độ, độ 4 nặng nhất
5. Về tiếp cận ĐM quay
A. Có giảm tỉ lệ tử vong ở BN STEMI thực hiện PCI so với đường đùi
B. Chảy máu do tiếp cận hiếm và dễ kiểm soát hơn đường đùi
C. Choáng tim không phải là chống chỉ định tiếp cận đường quay
D. Tất cả đều đúng
E. Tất cả đều sai
Đáp án: 1E, 2C, 3B, 4C, 5D
Tài liệu tham khảo
1. Sones FM, Jr., Shirey EK. Cine coronary arteriography. Mod Concepts Cardiovasc Dis. 1962;31:735-738.
2. Judkins MP. Selective coronary arteriography. I. A percutaneous transfemoral technic. Radiology. 1967;89(5):815-824.
3. Seldinger SI. Catheter replacement of the needle in percutaneous arteriography; a new technique Acta radiol. 1953 May;39(5):368-76.
4. Radner S. Thoracal aortography by catheterization from the radial artery; preliminary report of a new technique. Acta radiol. 1948;29(2):178-180.
5. Bertrand ME, Ketelers JY, Carre A, Ginestet A, Lemaire P, Warembourg H. [A new approach in the hemodynamic exploration of the left cardiac cavities via the radial artery below the elbow]. Coeur Med Interne. 1974;13(2):345-346.
6. Bourassa MG, Lesperance J, Campeau L, Bois MA, Saltiel J. Selective coronary angiography using a percutaneous femoral technique. Can Med Assoc J. 1970;102(2):170-173.
7. Campeau L. Percutaneous radial artery approach for coronary angiography. Cathet Cardiovasc Diagn. 1989;16(1):3-7.
8. Otaki M. Percutaneous transradial approach for coronary angiography. Cardiology. 1992;81(6):330-333.
9. Kiemeneij F, Laarman GJ. Percutaneous transradial artery approach for coronary stent implantation. Cathet Cardiovasc Diagn. 1993;30(2):173-178.
10. Kiemeneij F, Laarman GJ, Odekerken D, Slagboom T, van der Wieken R. A randomized comparison of percutaneous transluminal coronary angioplasty by the radial, brachial and femoral approaches: the access study. J Am Coll Cardiol. 1997;29(6):1269-1275.
11. Kiemeneij F, Laarman GJ, Slagboom T, Stella P. Transradial Palmaz-Schatz coronary stenting on an outpatient basis: results of a prospective pilot study. J Invasive Cardiol. 1995;7 Suppl A:5A-11A.
12. Garrett PD, Eckart RE, Bauch TD, Thompson CM, Stajduhar KC. Fluoroscopic localization of the femoral head as a landmark for common femoral artery cannulation. Catheter Cardiovasc Interv. 2005;65(2):205-207.
13. Kim D, Orron DE, Skillman JJ, Kent KC, Porter DH, Schlam BW, Carrozza J, Reis GJ, Baim DS. Role of superficial femoral artery puncture in the development of pseudoaneurysm and arteriovenous fistula complicating percutaneous transfemoral cardiac catheterization. Cathet Cardiovasc Diagn. 1992;25(2):91-97.
14. Altin RS, Flicker S, Naidech HJ. Pseudoaneurysm and arteriovenous fistula after femoral artery catheterization: association with low femoral punctures. Ajr. 1989;152(3):629-631.
15. Ellis SG,Bhatt D,Kapadia S, et al. Correlates and outcomes of retroperitoneal hemorrhage complicating percutaneous coronary intervention. Catheter Cardiovasc Interv 2006; 67: 541–545
16. Dotter CT, Rosch J, Robinson M. Fluoroscopic guidance in femoral artery puncture. Radiology. 1978;127(1):266-267.
17. Grier D, Hartnell G. Percutaneous femoral artery puncture: practice and anatomy. Br J Radiol. 1990;63(752):602-604.
18. Fitts J, Ver Lee P, Hofmaster P, Malenka D. Fluoroscopy-guided femoral artery puncture reduces the risk of PCI-related vascular complications. J Interv Cardiol. 2008;21(3):273-278.
19. Abu-Fadel MS, Sparling JM, Zacharias SJ, Aston CE, Saucedo JF, Schechter E, Hennebry TA. Fluoroscopy vs. traditional guided femoral arterial access and the use of closure devices: a randomized controlled trial. Catheter Cardiovasc Interv. 2009;74(4):533-539.
20. Turi ZG. Fluoroscopy guided vascular access: asking the right question, but getting the wrong answer? Catheter Cardiovasc Interv. 2009;74(4):540-542.
21. Huggins CE, Gillespie MJ, Tan WA, Laundon RC, Costello FM, Darrah SB, Tate DA, Cohen MG, Stouffer GA. A prospective randomized clinical trial of the use of fluoroscopy in obtaining femoral arterial access. J Invasive Cardiol. 2009;21(3):105-109.
22. Jacobi JA, Schussler JM, Johnson KB. Routine femoral head fluoroscopy to reduce complications in coronary catheterization. Proc (Bayl Univ Med Cent). 2009;22(1):7-8.
23. Schnyder G, Sawhney N, Whisenant B, Tsimikas S, Turi ZG. Common femoral artery anatomy is influenced by demographics and comorbidity: implications for cardiac and peripheral invasive studies. Catheter Cardiovasc Interv. 2001;53(3):289-295.
24. Dudeck O, Teichgraeber U, Podrabsky P, Lopez Haenninen E, Soerensen R, Ricke J. A randomized trial assessing the value of ultrasound-guided puncture of the femoral artery for interventional investigations. Int J Cardiovasc Imaging. 2004;20(5):363-368.
25. Seto AH, Abu-Fadel MS, Sparling JM, Zacharias SJ, Daly TS, Harrison AT, Suh WM, Vera JA, Aston CE, Winters RJ, Patel PM, Hennebry TA, Kern MJ. Real-time ultrasound guidance facilitates femoral arterial access and reduces vascular complications: FAUST (Femoral Arterial Access With Ultrasound Trial). JACC Cardiovasc Interv. 2010;3(7):751-758.
26. Cilingiroglu M, Feldman T, Salinger MH, Levisay J, Turi ZG. Fluoroscopically-guided micropuncture femoral artery access for large caliber sheath insertion. J Invasive Cardiol. 2011,4:157-61.
27. Ben-Dor I, Maluenda G, Mahmoudi M, Torguson R, Xue Z, Bernardo N, Lindsay J, Satler LF, Pichard AD, Waksman R. A novel, minimally invasive access technique versus standard 18-gauge needle set for femoral access. Catheter Cardiovasc Interv. 2012 Feb 14. doi: 10.1002/ccd.23330. [Epub ahead of print].
28. Chandrasekar B, Doucet S, Bilodeau L, Crepeau J, deGuise P, Gregoire J, Gallo R, Cote G, Bonan R, Joyal M, Gosselin G, Tanguay JF, Dyrda I, Bois M, Pasternac A. Complications of cardiac catheterization in the current era: a single-center experience. Catheter Cardiovasc Interv. 2001;52(3):289-295.
29. Schwartz BG, Burstein S, Economides C, Kloner RA, Shavelle DM, Mayeda GS. Review of vascular closure devices. J Invasive Cardiol. 2010;22(12):599-607.
30. Sherev DA, Shaw RE, Brent BN. Angiographic predictors of femoral access site complications: implication for planned percutaneous coronary intervention. Catheter Cardiovasc Interv. 2005;65(2):196-202.
31. Pitta SR, Prasad A, Kumar G, Lennon R, Rihal CS, Holmes DR. Location of femoral artery access and correlation with vascular complications. Catheter Cardiovasc Interv. 2011.
32. Cosman TL, Arthur HM, Natarajan MK. Prevalence of bruising at the vascular access site one week after elective cardiac catheterisation or percutaneous coronary intervention. J Clin Nurs. 2011;20(9-10):1349-1356.
33. Nikolsky E, Mehran R, Halkin A, Aymong ED, Mintz GS, Lasic Z, Negoita M, Fahy M, Krieger S, Moussa I, Moses JW, Stone GW, Leon MB, Pocock SJ, Dangas G. Vascular complications associated with arteriotomy closure devices in patients undergoing percutaneous coronary procedures: a meta-analysis. J Am Coll Cardiol. 2004;44(6):1200-1209.
34. Kacila M, Vranic H, Hadzimehmedagic A, Sehovic S, Granov N. The frequency of complications of pseudo aneurysms after cardiac interventional diagnostic and therapeutic interventions. Med Arh. 2011;65(2):78-81.
35. Gabrielli R, Rosati MS, Vitale S, Millarelli M, Chiappa R, Siani A, Irace L, Caselli G. Fatal Complication after Thrombin Injection for Post-Catheterization Femoral Pseudoaneurysm. Thorac Cardiovasc Surg. 2011.
36. Farouque HM, Tremmel JA, Raissi Shabari F, Aggarwal M, Fearon WF, Ng MK, Rezaee M, Yeung AC, Lee DP. Risk factors for the development of retroperitoneal hematoma after percutaneous coronary intervention in the era of glycoprotein IIb/IIIa inhibitors and vascular closure devices. J Am Coll Cardiol. 2005;45(3):363-368.
37. Maluenda G, Delhaye C, Gonzalez M, Ben-Dor I, Gaglai M, Collins S, Wakabayashi K, Hanna N, Torguson R, Xue Z, Suddath W, Satler LF, Kent KM, Lindsay J, Pichard AD, Bernardo N, Waksman R. Conservative versus invasive management strategy for retroperitoneal hemorrhage after percutaneous coronary intervention. J Am Coll Cardiol. 2010;55(10A):A215:E2039 (abstract).
38. Chan YC, Morales JP, Reidy JF, Taylor PR. Management of spontaneous and iatrogenic retroperitoneal haemorrhage: conservative management, endovascular intervention or open surgery? Int J Clin Pract. 2008;62(10):1604-1613.
39. Yoo BS, Yoon J, Ko JY, Kim JY, Lee SH, Hwang SO, Choe KH. Anatomical consideration of the radial artery for transradial coronary procedures: arterial diameter, branching anomaly and vessel tortuosity. Int J Cardiol. 2005;101(3):421-427.
40. Greenwood MJ, Della-Siega AJ, Fretz EB, Kinloch D, Klinke P, Mildenberger R, Williams MB, Hilton D. Vascular communications of the hand in patients being considered for transradial coronary angiography: is the Allen’s test accurate? J Am Coll Cardiol. 2005;46(11):2013-2017.
41. Brzezinski M, Luisetti T, London MJ. Radial artery cannulation: a comprehensive review of recent anatomic and physiologic investigations. Anesth Analg. 2009;109(6):1763-1781.
42. Barbeau GR, Arsenault F, Dugas L, Simard S, Lariviere MM. Evaluation of the ulnopalmar arterial arches with pulse oximetry and plethysmography: comparison with the Allen’s test in 1010 patients. Am Heart J. 2004;147(3):489-493.
43. Valentine RJ, Modrall JG, Clagett GP. Hand ischemia after radial artery cannulation. J Am Coll Surg. 2005;201(1):18-22.
44. Abdelaal E, Brousseau-Provencher C, Montminy S, Plourde G, MacHaalany J, Bataille Y, Molin P, Déry J-P, Barbeau G, Roy L, Larose E, De Larochellière, R, Nguyen CM, Proulx, G, Costerousse O, Bertrand OF. Risk Score, Causes, and Clinical Impact of Failure of Transradial Approach for Percutaneous Coronary Interventions. J Am Coll Cardiol Intv. 2013;6(11):1129-1137.
45. Bertrand OF, Rao SV, Mann T. Reply to: Facilitating radial conversion. JACC Cardiovasc Interv. 2011;4(4):468-469.
46. Bertrand OF, Rao SV, Pancholy S, Jolly SS, Rodes-Cabau J, Larose E, Costerousse O, Hamon M, Mann T. Transradial approach for coronary angiography and interventions: results of the first international transradial practice survey. JACC Cardiovasc Interv. 2010;3(10):1022-1031.
47. Sciahbasi A, Romagnoli E, Burzotta F, Trani C, Sarandrea A, Summaria F, Pendenza G, Tommasino A, Patrizi R, Mazzari M, Mongiardo R, Lioy E. Transradial approach (left vs right) and procedural times during percutaneous coronary procedures: TALENT study. Am Heart J. 2011;161(1):172-179.
48. Sciahbasi A, Romagnoli E, Trani C, Burzotta F, Sarandrea A, Sunmaria F, Patrizi R, Rao S, Lioy E. Operator radiation exposure during percutaneous coronary procedures through the left or right radial approach. The TALENT Dosimetric Substudy. Circ Cardiovasc Interv. 2011;(in press).
49. Pancholy SB, Sanghvi KA, Patel TM. Radial artery access technique evaluation trial: Randomized comparison of seldinger versus modified seldinger technique for arterial access for transradial catheterization. Catheter Cardiovasc Interv. 2012 Mar 14. doi: 10.1002/ccd.23445. [Epub ahead of print].
50. Seto AH, Roberts JS, Abu-Fadel MS, Czak SJ, Latif F, Jain SP, Raza JA, Mangla A, Panagopoulos G, Patel PM, Kern MJ, Lasic Z.Real-time ultrasound guidance facilitates transradial access: RAUST (Radial Artery access with Ultrasound Trial). JACC Cardiovasc Interv. 2015;8:283-291. doi: 10.1016/j.jcin.2014.05.036. Epub 2015 Jan 14.
51. Mamas M, D’Souza S, Hendry C, Ali R, Iles-Smith H, Palmer K, El-Omar M, Fath-Ordoubadi F, Neyses L, Fraser DG. Use of the sheathless guide catheter during routine transradial percutaneous coronary intervention: a feasibility study. Catheter Cardiovasc Interv. 2010;75(4):596-602.
52. Caputo RP, Tremmel JA, Rao S, Gilchrist IC, Pyne C, Pancholy S, Frasier D, Gulati R, Skelding K, Bertrand O, Patel T. Transradial arterial access for coronary and peripheral procedures: Executive summary by the transradial committee of the SCAI. Catheter Cardiovasc Interv. 2011.
53. Kanei Y, Kwan T, Nakra NC, Liou M, Huang Y, Vales LL, Fox JT, Chen JP, Saito S. Transradial cardiac catheterization: A review of access site complications. Catheter Cardiovasc Interv. 2011.
54. Dawson EA, Rathore S, Cable NT, Wright DJ, Morris JL, Green DJ. Impact of introducer sheath coating on endothelial function in humans after transradial coronary procedures. Circ Cardiovasc Interv. 2010;3(2):148-156.
55. Jolly SS, Yusuf S, Cairns J, Niemela K, Xavier D, Widimsky P, Budaj A, Niemela M, Valentin V, Lewis BS, Avezum A, Steg PG, Rao SV, Gao P, Afzal R, Joyner CD, Chrolavicius S, Mehta SR. Radial versus femoral access for coronary angiography and intervention in patients with acute coronary syndromes (RIVAL): a randomised, parallel group, multicentre trial. Lancet. 2011;377(9775):1409-1420.
56. Guedes A, Dangoisse V, Gabriel L, Jamart J, Chenu P, Marchandise B, Schroeder E. Low rate of conversion to transfemoral approach when attempting both radial arteries for coronary angiography and percutaneous coronary intervention: a study of 1,826 consecutive procedures. J Invasive Cardiol. 2010;22(9):391-397.
57. Kiemeneij F, Vajifdar BU, Eccleshall SC, Laarman G, Slagboom T, van der Wieken R. Evaluation of a spasmolytic cocktail to prevent radial artery spasm during coronary procedures. Catheter Cardiovasc Interv. 2003;58(3):281-284.
58. Varenne O, Jegou A, Cohen R, Empana JP, Salengro E, Ohanessian A, Gaultier C, Allouch P, Walspurger S, Margot O, El Hallack A, Jouven X, Weber S, Spaulding C. Prevention of arterial spasm during percutaneous coronary interventions through radial artery: the SPASM study. Catheter Cardiovasc Interv. 2006;68(2):231-235.
59. Rathore S, Stables RH, Pauriah M, Hakeem A, Mills JD, Palmer ND, Perry RA, Morris JL. Impact of length and hydrophilic coating of the introducer sheath on radial artery spasm during transradial coronary intervention: a randomized study. JACC Cardiovasc Interv. 2010;3(5):475-483.
60. Dieter RS, Akef A, Wolff M. Eversion endarterectomy complicating radial artery access for left heart catheterization. Catheter Cardiovasc Interv. 2003;58(4):478-480.
61. Burzotta F, Trani C, De Vita M, Crea F. A new operative classification of both anatomic vascular variants and physiopathologic conditions affecting transradial cardiovascular procedures. Int J Cardiol. 2010;145(1):120-122.
62. Lo TS, Nolan J, Fountzopoulos E, Behan M, Butler R, Hetherington SL, Vijayalakshmi K, Rajagopal R, Fraser D, Zaman A, Hildick-Smith D. Radial artery anomaly and its influence on transradial coronary procedural outcome. Heart. 2009;95(5):410-415.
63. Tizon-Marcos H, Barbeau GR. Incidence of compartment syndrome of the arm in a large series of transradial approach for coronary procedures. J Interv Cardiol. 2008;21(5):380-384.
64. Agostoni P, Biondi-Zoccai GG, de Benedictis ML, Rigattieri S, Turri M, Anselmi M, Vassanelli C, Zardini P, Louvard Y, Hamon M. Radial versus femoral approach for percutaneous coronary diagnostic and interventional procedures; Systematic overview and meta-analysis of randomized trials. J Am Coll Cardiol. 2004;44(2):349-356.
65. Jolly SS, Amlani S, Hamon M, Yusuf S, Mehta SR. Radial versus femoral access for coronary angiography or intervention and the impact on major bleeding and ischemic events: a systematic review and meta-analysis of randomized trials. Am Heart J. 2009;157(1):132-140.
66. Bertrand OF, Larose E, Rodes-Cabau J, Gleeton O, Taillon I, Roy L, Poirier P, Costerousse O, Larochelliere RD. Incidence, predictors, and clinical impact of bleeding after transradial coronary stenting and maximal antiplatelet therapy. Am Heart J. 2009;157(1):164-169.
67. Bertrand OF. Acute forearm muscle swelling post transradial catheterization and compartment syndrome: prevention is better than treatment! Catheter Cardiovasc Interv. 2010;75(3):366-368.
68. Mina GS, Gobrial GF, Modi K, Dominic P.Combined Use of Bivalirudin and Radial Access in Acute Coronary Syndromes Is Not Superior to the Use of Either One Separately: Meta-Analysis of Randomized Controlled Trials. JACC Cardiovasc Interv. 2016 ;9:1523-31. doi: 10.1016/j.jcin.2016.05.023.
69. Spaulding C, Lefevre T, Funck F, Thebault B, Chauveau M, Ben Hamda K, Chalet Y, Monsegu H, Tsocanakis O, Py A, Guillard N, Weber S. Left radial approach for coronary angiography: results of a prospective study. Cathet Cardiovasc Diagn. 1996;39(4):365-370.
70. Bernat I, Bertrand OF, Rokyta R, Kacer M, Pesek J, Koza J, Smid M, Bruhova H, Sterbakova G, Stepankova L, Costerousse O. Efficacy and safety of transient ulnar artery compression to recanalize acute radial artery occlusion after transradial catheterization. Am J Cardiol. 2011;107(11):1698-1701.
71. Cubero JM, Lombardo J, Pedrosa C, Diaz-Bejarano D, Sanchez B, Fernandez V, Gomez C, Vazquez R, Molano FJ, Pastor LF. Radial compression guided by mean artery pressure versus standard compression with a pneumatic device (RACOMAP). Catheter Cardiovasc Interv. 2009;73(4):467-472.
72. Pancholy S, Coppola J, Patel T, Roke-Thomas M. Prevention of radial artery occlusion-patent hemostasis evaluation trial (PROPHET study): a randomized comparison of traditional versus patency documented hemostasis after transradial catheterization. Catheter Cardiovasc Interv. 2008;72(3):335-340.
73. Pancholy SB. Comparison of the effect of intra-arterial versus intravenous heparin on radial artery occlusion after transradial catheterization. Am J Cardiol. 2009;104(8):1083-1085.
74. Plante S, Cantor WJ, Goldman L, Miner S, Quesnelle A, Ganapathy A, Popel A, Bertrand OF. Comparison of bivalirudin versus heparin on radial artery occlusion after transradial catheterization. Catheter Cardiovasc Interv. 2010;76(5):654-658.
75. Zellner C, Ports TA, Yeghiazarians Y, Boyle AJ. Sterile radial artery granuloma after transradial procedures: a unique and avoidable complication. Catheter Cardiovasc Interv. 2010;76(5):673-676.
76. van Leeuwen MAH, van der Heijden DJ, Hollander MR, Mulder MJ, van de Ven PM, Ritt MJPF, Kiemeneij F, van Mieghem NM, van Royen N. ACRA Perfusion Study. Circ Cardiovasc Interv. 2019 ;12:e007641.
77. Zellner C, Ports TA, Yeghiazarians Y, Boyle AJ. Sterile radial artery granuloma after transradial procedures: a unique and avoidable complication. Catheter Cardiovasc Interv. 2010;76(5):673-676.
78. Terashima M, Meguro T, Takeda H, et al. Percutaneous ulnar artery approach for coronary angiography: a preliminary report in nine patients. Catheter Cardiovasc Interv 2001; 53:410-4.
79. Aptecar E, Pernes JM, Chabane-Chaouch M, et al. Transulnar versus transradial artery approach for coronary angioplasty: the PCVI-CUBA study. Catheter Cardiovasc Interv 2006; 67:711-20.
80. Hahalis G, Tsigkas G, Xanthopoulou I, Deftereos S, Ziakas A, Raisakis K, Pappas C, Sourgounis A, Grapsas N, Davlouros P, Galati A, Plakomyti TE, Mylona P, Styliadis I, Pyrgakis V, Alexopoulos D. Transulnar compared with transradial artery approach as a default strategy for coronary procedures: a randomized trial. The Transulnar or Transradial Instead of Coronary Transfemoral Angiographies Study (the AURA of ARTEMIS Study). Circ Cardiovasc Interv. 2013 Jun;6(3):252-61.
81. Fernandez R, Zaky F, Ekmejian A, Curtis E, Lee A. Safety and efficacy of ulnar artery approach for percutaneous cardiac catheterization: Systematic review and meta-analysis. Catheter Cardiovasc Interv. 2018 ;91:1273-1280. doi: 10.1002/ccd.27479. Epub 2018 Feb 1.
82. Fujii T, Masuda N, Tamiya S, Shima M, Toda E, Ito D, et al. Angiographic evaluation of right upper-limb arterial anomalies: implications for transradial coronary interventions. J Invasive Cardiol. 2010;22:536–40.
83. Sgueglia GA, Di Giorgio A, Gaspardone A, Babunashvili A. Anatomic Basis and Physiological Rationale of Distal Radial Artery Access for Percutaneous Coronary and Endovascular Procedures. JACC Cardiovasc Interv. 2018 22;11:2113-2119. doi: 10.1016/j.jcin.2018.04.045.
84. Kiemeneij F. Left distal transradial access in the anatomical snuffbox for coronary angiography (ldTRA) and interventions (ldTRI). EuroIntervention. 2017;13:851-857. doi: 10.4244/EIJ-D-17-00079.
85. Soydan E, Akın M. Coronary angiography using the left distal radial approach – An alternative site to conventional radial coronary angiography. Anatol J Cardiol. 2018;19:243-248. doi: 10.14744/AnatolJCardiol.2018.59932. Epub 2018 Mar 21.
86. Lee JW, Park SW, Son JW, Ahn SG, Lee SH.Real-world experience of the left distal transradial approach for coronary angiography and percutaneous coronary intervention: a prospective observational study (LeDRA). EuroIntervention. 2018;14:e995-e1003. doi: 10.4244/EIJ-D-18-00635.
87. Pua U, Sim JZT, Quek LHH, Kwan J, Lim GHT, Huang IKH.Feasibility Study of “Snuffbox” Radial Access for Visceral Interventions. J Vasc Interv Radiol. 2018 ;29:1276-1280. doi: 10.1016/j.jvir.2018.05.002.
88. Ellis SG, Roubin GS, Wilentz J, Douglas JS, Jr., King SB, 3rd. Effect of 18- to 24-hour heparin administration for prevention of restenosis after uncomplicated coronary angioplasty. Am Heart J. 1989;117(4):777-782.
89. Jauch W, Kurnik PB, Hanlon SJ, Siegel JE, Matthai WH, Jr. Expected hemoglobin decrease following percutaneous transluminal coronary angioplasty. Am J Cardiol. 1997;80(1):71-74.
90. Bertrand OF, Larose E, Rodes-Cabau J, Rinfret S, Dery JP, Bagur R, Gleeton O, Nguyen CM, Proulx G, De Larochelliere R, Poirier P, Costerousse O, Roy L. Incidence, range, and clinical effect of hemoglobin changes within 24 hours after transradial coronary stenting. Am J Cardiol. 2010;106(2):155-161.
91. Manoukian SV, Feit F, Mehran R, Voeltz MD, Ebrahimi R, Hamon M, Dangas GD, Lincoff AM, White HD, Moses JW, King SB, 3rd, Ohman EM, Stone GW. Impact of major bleeding on 30-day mortality and clinical outcomes in patients with acute coronary syndromes: an analysis from the ACUITY Trial. J Am Coll Cardiol. 2007;49(12):1362-1368.
92. Doyle BJ, Ting HH, Bell MR, Lennon RJ, Mathew V, Singh M, Holmes DR, Rihal CS. Major femoral bleeding complications after percutaneous coronary intervention: incidence, predictors, and impact on long-term survival among 17,901 patients treated at the Mayo Clinic from 1994 to 2005. JACC Cardiovasc Interv. 2008;1(2):202-209.
93. Grossman PM, Gurm HS, McNamara R, Lalonde T, Changezi H, Share D, Smith DE, Chetcuti SJ, Moscucci M. Percutaneous coronary intervention complications and guide catheter size: bigger is not better. JACC Cardiovasc Interv. 2009;2(7):636-644.
94. Hamon M, Rasmussen LH, Manoukian SV, Cequier A, Lincoff MA, Rupprecht HJ, Gersh BJ, Mann T, Bertrand ME, Mehran R, Stone GW. Choice of arterial access site and outcomes in patients with acute coronary syndromes managed with an early invasive strategy: the ACUITY trial. EuroIntervention. 2009;5(1):115-120.
95. Verheugt FW, Steinhubl SR, Hamon M, Darius H, Steg PG, Valgimigli M, Marso SP, Rao SV, Gershlick AH, Lincoff AM, Mehran R, Stone GW. Incidence, prognostic impact, and influence of antithrombotic therapy on access and nonaccess site bleeding in percutaneous coronary intervention. JACC Cardiovasc Interv. 2011;4(2):191-197.
96. Pristipino C, Trani C, Nazzaro MS, Berni A, Patti G, Patrizi R, Pironi B, Mazzarotto P, Gioffre G, Biondi-Zoccai GG, Richichi G. Major improvement of percutaneous cardiovascular procedure outcomes with radial artery catheterisation: results from the PREVAIL study. Heart. 2009;95(6):476-482.
97. Chase AJ, Fretz EB, Warburton WP, Klinke WP, Carere RG, Pi D, Berry B, Hilton JD. Association of the arterial access site at angioplasty with transfusion and mortality: the M.O.R.T.A.L study (Mortality benefit Of Reduced Transfusion after percutaneous coronary intervention via the Arm or Leg). Heart. 2008;94(8):1019-1025.
98. Levine GN, Bates ER, Blankenship JC, Bailey SR, Bittl JA, Cercek B, Chambers CE, Ellis SG, Guyton RA, Hollenberg SM, Khot UN, Lange RA, Mauri L, Mehran R, Moussa ID, Mukherjee D, Nallamothu BK, Ting HH. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention. J Am Coll Cardiol. 2011.
99. Romagnoli E, Biondi-Zoccai G, Sciahbasi A, Politi L, Rigattieri S, Pendenza G, Summaria F, Patrizi R, Borghi A, Di Russo C, Moretti C, Agostoni P, Loschiavo P, Lioy E, Sheiban I, Sangiorgi G. Radial versus femoral randomized investigation in ST-segment elevation acute coronary syndrome: the RIFLE-STEACS (Radial Versus Femoral Randomized Investigation in ST-Elevation Acute Coronary Syndrome) study. J Am Coll Cardiol. 2012 60(24):2481-9.
100. Bernat I, Horak D, Stasek J, Mates M, Pesek J, Ostadal P, Hrabos V, Dusek J, Koza J, Sembera Z, Brtko M, Aschermann O, Smid M, Polansky P, Al Mawiri A, Vojacek J, Bis J, Costerousse O, Bertrand OF, Rokyta R. ST-segment elevation myocardial infarction treated by radial or femoral approach in a multicenter randomized clinical trial: the STEMI-RADIAL trial. J Am Coll Cardiol. 2014;63(10):964-72.
101. Bernat I, Abdelaal E, Plourde G, Bataille Y, Cech J, Pesek J, Koza J, Jirous S, Machaalany J, Déry J-P, Costerousse O, Rokyta R, Bertrand OF. Early and late outcomes after primary percutaneous coronary intervention by radial or femoral approach in patients presenting in acute ST-elevation myocardial infarction and cardiogenic shock. Am Heart J. 2013; 165:338-43
102. Baklanov DV, Kaltenbach LA, Marso SP, Subherwal SS, Feldman DN, Garratt KN, Curtis IP, Messenger JC, Rao SV. The prevalence and outcomes of transradial percutaneous coronary intervention for ST-segment elevation myocardial infarction: analysis from the National Cardiovascular Data Registry (2007 to 2011). J Am Coll Cardiol. 2013;61:420-426
103. Rafie IM, Uddin MM, Ossei-Gerning N, Anderson RA, Kinnaird TD. Patients undergoing PCI from the femoral route by default radial operators are at high risk of vascular access-site complications. EuroIntervention. 2014 ;9(10):1189-94.
104. Hamon M, Pristipino C, Di Mario C, Nolan J, Ludwig J, Tubaro M, Sabate M, Mauri-Ferré J, Huber K, Niemelä K, Haude M, Wijns W, Dudek D, Fajadet J, Kiemeneij F. Consensus document on the radial approach in percutaneous cardiovascular interventions: position paper by the European Association of Percutaneous Cardiovascular Interventions and Working Groups on Acute Cardiac Care** and Thrombosis of the European Society of Cardiology European Association of Percutaneous Cardiovascular Interventions; Working Group on Acute Cardiac Care of the European Society of Cardiology; Working Group on Thrombosis on the European Society of Cardiology. EuroIntervention. 2013 ;8(11):1242-51.
105. Rao SV, Tremmel JA, Gilchrist IC, Shah PB, Gulati R, Shroff AR,Van Crisco, Woody W, Zoghbi G, Duffy PL, Sanghvi K, Krucoff MW, Pyne CT, Skelding KA, Patel T, Pancholy SB. Best Practices for Transradial Angiography and Intervention: A Consensus Statement From the Society for Cardiovascular Angiography and Intervention’s Transradial Working Group