Các dụng cụ trong can thiệp động mạch vành
1. Đại cương
Trải qua lịch sử hơn 40 năm phát triển, ngày nay can thiệp ĐMV đã trở thành một thủ thuật thường quy ở rất nhiều trung tâm tim mạch trên toàn thế giới. Những tiến bộ về công nghệ và kỹ thuật đã tạo ra các thiết bị nhỏ gọn hơn, phù hợp với nhiều tổn thương mạch vành khác nhau, thuận lợi và tiện dụng hơn cho bác sĩ tim mạch can thiệp, cũng như cải thiện hiệu quả tức thì và dài hạn của thủ thuật. Tuy nhiên, nguyên lý cơ bản của can thiệp ĐMV vẫn tương tự thủ thuật mà Gruentzig thực hiện năm 1977: mở đường vào mạch máu, đặt một ống thông tiếp cận lỗ vào ĐMV, đẩy dây dẫn và bóng hoặc stent tới tổn thương để tái thông mạch máu.
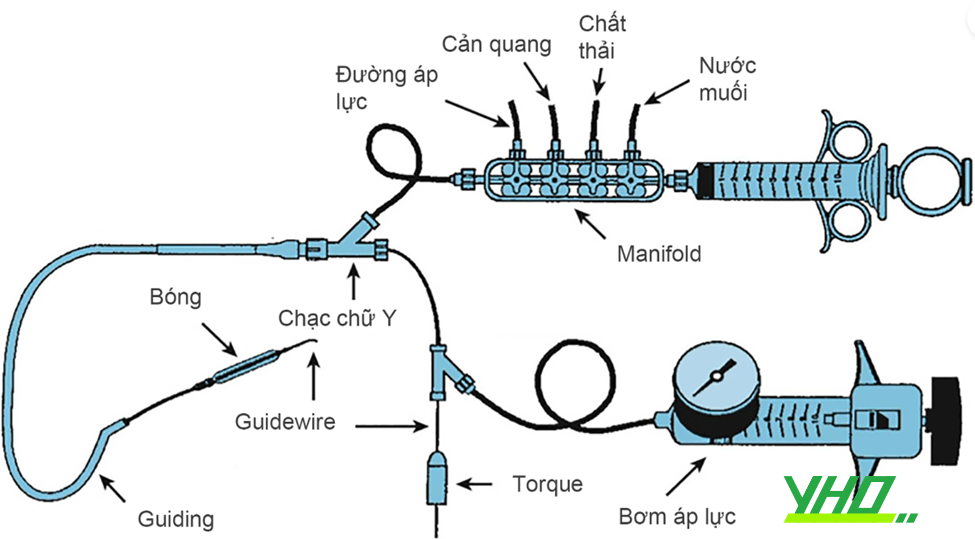
Thiết bị can thiệp ĐMV cơ bản gồm: hệ thống khảo sát áp lực và các khúc nối, khóa chữ Y, ống thông can thiệp (guiding), dây dẫn (guidewire), bóng, stent, bơm áp lực (Hình 16.1). Những thiết bị này hỗ trợ bác sĩ can thiệp thực hiện 3 thao tác chính: (1) cố định và hỗ trợ guiding ổn định; điều khiển dây dẫn can thiệp đi qua các đoạn mạch gấp khúc; (3) đẩy bóng và stent trượt trên dây dẫn đến tổn vị trí cần can thiệp. Một thủ thuật can thiệp mạch vành qua da thành công đòi hỏi bác sĩ làm thủ thuật phải kiểm soát 3 thành phần chuyển động chính (guiding can thiệp, dây dẫn can thiệp, bóng và stent) một cách đồng bộ và thận trọng.
Chương sách này trình bày về các thiết bị cơ bản: guiding, dây dẫn, bóng, stent. Các thiết bị hỗ trợ quá trình chẩn đoán như dụng cụ mở đường vào mạch máu, hệ thống đo áp lực, thuốc cản quang, thăm dò hình ảnh xâm nhập (IVUS, OCT), khảo sát áp lực đoạn xa ĐMV (FFR), và các thiết bị hỗ trợ thủ thuật can thiệp như bộ dụng cụ hút huyết khối, thiết bị khoan phá mảng xơ vữa (rotablator), dụng cụ hỗ trợ thất trái,… sẽ được trình bày chi tiết trong các chương riêng biệt.
 Hình 16.1. Sơ đồ các thiết bị cơ bản sử dụng trong can thiệp động mạch vành
Hình 16.1. Sơ đồ các thiết bị cơ bản sử dụng trong can thiệp động mạch vành2. Ống thông can thiệp
Ống thông can thiệp là một dụng cụ chuyên dụng thường có kích thước 5-8Fr được sử dụng để di chuyển bóng và các dụng cụ can thiệp khác tới tổn thương đích. Ống thông can thiệp có 3 chức năng chính trong can thiệp mạch:
- Di chuyển bóng/stent trong lòng ống thông can thiệp.
- Hỗ trợ đẩy bóng/stent đi vào trong lòng ĐMV, đến vị trí tổn thương.
- Theo dõi áp lực mạch vành và bơm thuốc cản quang hiện hình mạch máu.
2.1. Đặc điểm của ống thông can thiệp
So với các loại ống thông dùng trong chẩn đoán, guiding (ống thông can thiệp) không có đầu được làm nhọn. Chúng có thành mỏng hơn, nhờ đó đường kính trong rộng hơn, nhưng đồng thời lại cứng hơn. Để tạo được lòng ống thông rộng phải làm mỏng thành ống do đó có thể làm giảm độ bền, nguy cơ xoắn ống hoặc khó kiểm soát mô-men lực. Guiding cứng hơn để hỗ trợ bóng/stent tiến vào, vì thế các thao tác cũng khác so với ống thông chẩn đoán. Đây là điều các bác sĩ tim mạch can thiệp cần lưu ý, tránh gây tổn thương ĐMV và động mạch chủ. Do kích thước lớn hơn, guiding dễ gây tụt áp lực khi đưa vào sâu trong lòng ĐMV, so với ống thông chẩn đoán cùng kích cỡ.
Cấu trúc của một guiding gồm 3 lớp: lớp vỏ ngoài, lớp lưới bện, và lớp lót bên trong. Lớp vỏ ngoài được làm bằng hợp
chất polyurethane, polyamides và một số vật liệu nylon. Lớp vỏ này giúp guiding có đủ độ cứng, tránh bị xoắn vặn, có thể hỗ trợ đẩy dụng cụ tốt, đồng thời vẫn linh hoạt và có đặc tính nhớ hình. Lớp lưới bện được gắn vào lớp vỏ ngoài, có vai trò chống xoắn vặn, giúp đầu guiding có thể xoay được, cũng như có đặc tính cản quang. Trong cùng là lớp lót bằng Teflon (PTFE), đảm bảo lòng trong guiding trơn nhẵn, và dụng cụ có thể đi vào đi ra một cách dễ dàng thuận lợi.
Về cơ bản, guiding càng cứng thì độ hỗ trợ càng cao, nhưng càng kém mềm mại và ít linh hoạt. Các guiding ngày nay được thiết kế phù hợp với can thiệp ĐMV qua đường mạch quay, cân bằng được độ cứng và độ linh hoạt, có đường kính ngoài nhỏ để ít ảnh hưởng đường vào mạch máu, trong khi đường kính trong lại đủ lớn.
 Hình 16.2. Cấu trúc một guiding can thiệp
Hình 16.2. Cấu trúc một guiding can thiệp2.2. Kích cỡ ống thông can thiệp
a. Chiều dài ống thông
Chiều dài tiêu chuẩn của một ống thông can thiệp ĐMV là 100 cm. Những ống thông ngắn hơn có kích cỡ 80-90 cm được sử dụng trong một số trường hợp đặc biệt như can thiệp đoạn xa mạch vành, hay can thiệp tổn thương CTO với tiếp cận ngược dòng.
b. Đường kính ống thông
Đường kính guiding được đo bằng đơn vị French (Fr). 1 French tương ứng 1/3 mm, vì thế 6 Fr tương đương 2 mm.
Các guiding sử dụng trong can thiệp ĐMV thường có đường kính từ 5Fr đến 8Fr. Tương tự sheath, màu sắc của guiding thể hiện kích cỡ của nó: 5Fr có màu xám, 6Fr màu xanh lá, 7Fr màu cam, 8Fr màu xanh dương. Lưu ý rằng đây là đường kính ngoài của guiding, khác với đường kính của sheath được tính bằng đường kính lòng trong. Thầy thuốc can thiệp cũng cần nắm rõ đường kính trong của guiding, biểu diễn bằng đơn vị inch, vì đây là kích thước cho dụng cụ can thiệp đi qua. Cùng là guiding 6Fr, đường kính trong có thể thay đổi đôi chút tuỳ thuộc nhà sản xuất và thông số được cung cấp trên bao bì sản phẩm (Bảng 16.1).
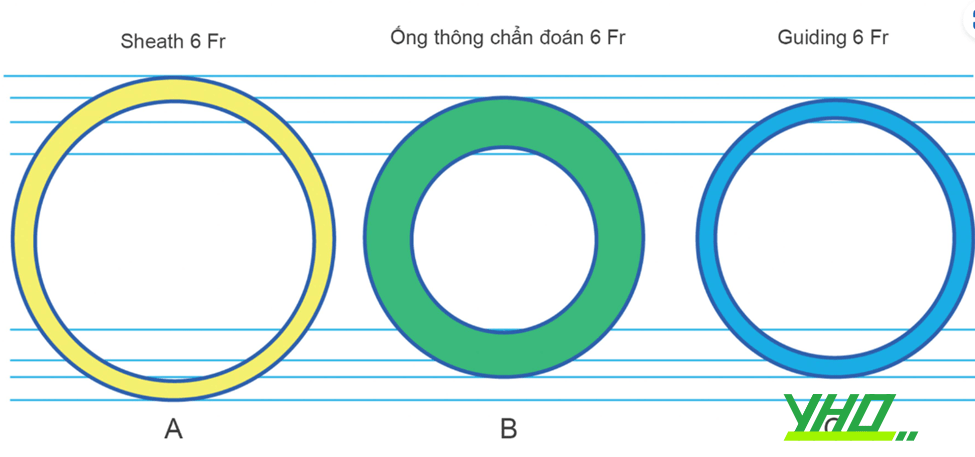
Hình 16.3. Minh họa kích cỡ của introducer sheath (A), ống thông chẩn đoán (B), và guiding can thiệp (C). Với sheath, đường kính được tính là đường kính trong. Với ống thông chẩn đoán hay can thiệp, đường kính được tính là đường kính ngoài. Ống thông can thiệp có thành mỏng hơn, vì thế lòng rộng hơn ống thông chẩn đoán.
 Bảng 16.1. Các thiết kế ống thông can thiệp khác nhau theo từng hãng sản xuất
Bảng 16.1. Các thiết kế ống thông can thiệp khác nhau theo từng hãng sản xuấtGuiding can thiệp đường kính nhỏ (ví dụ ≤ 6Fr) được sử dụng thường xuyên nhất. Loại guiding 6Fr gây ít biến chứng hơn loại 8Fr. Guiding nhỏ hơn (5Fr) đồng nghĩa đường vào mạch máu nhỏ hơn, ít nguy cơ gây tắc động mạch quay nếu tiến hành can thiệp ĐMV qua đường động mạch quay. Tuy nhiên có thể đường kính trong quá nhỏ và không vừa một số hệ thống stent. Các guiding kích cỡ lớn 7Fr hoặc 8Fr được sử dụng trong một số thủ thuật phức tạp như khoan phá mảng xơ vữa, hoặc đặt đồng thời hai stent điều trị tổn thương chia nhánh. Sử dụng loại guiding 6Fr (hoặc 7Fr ở một số bệnh nhân) đường vào từ động mạch quay hiện nay là kỹ thuật phổ biến cho hầu hết các ca PCI thông thường bởi giúp giảm rõ rệt biến chứng mạch máu.
Bảng 16.2 phía dưới liệt kê các thủ thuật tương thích với đường kính guiding. Có hai lưu ý quan trọng để có thể đẩy và thao tác dụng cụ một cách thuận lợi.
- Thứ nhất, nên chọn guiding có đường kính lớn hơn đường kính dụng cụ một chút. Ví dụ, với thủ thuật khoan phá mảng xơ vữa, mặc dù đầu mũi khoan 1,25 mm sẽ tương ứng 0,05 inch, và như vậy đi vừa guiding 5 Fr (đường kính trong 0,056 inch), nhưng để an toàn tốt nhất là sử dụng guiding 6
- Thứ hai, đường kính đoạn gần và đoạn xa của dụng cụ có thể không giống nhau. Ví dụ thiết bị IVUS OptiCross 40MHz có đường kính đầu dò là 2,7Fr (tương đương 0,9 mm hay 0,035 inch), nhưng phần vỏ ngoài lại có đường kính 3,15 Fr (tương đương 1,05 mm hay 0,041 inch).
 Bảng 16.2. Kích cỡ các loại guiding và sự tương thích với thiết bị can thiệp ĐMV
Bảng 16.2. Kích cỡ các loại guiding và sự tương thích với thiết bị can thiệp ĐMV2.3. Hình dạng ống thông can thiệp
Các ống thông can thiệp có nhiều hình dạng khác nhau, phù hợp với giải phẫu ĐMV khác nhau. Với ĐMV trái, có các loại ống thông JL, EBU, AL, Ikari… Với ĐMV phải, có thể dùng ống thông JR, AL, AR, Ikari, MP…
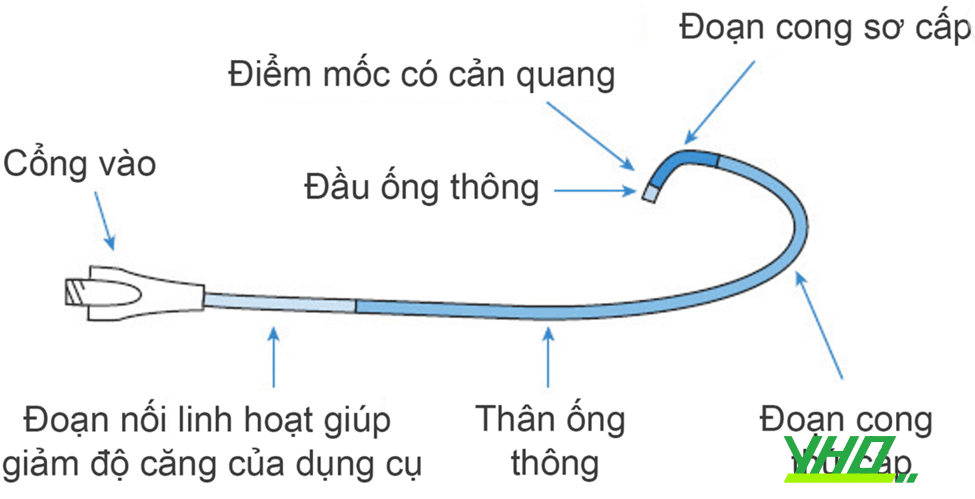
Hình 16.4. Các thành phần cơ bản của một ống thông can thiệp
Cấu trúc cơ bản của một guiding gồm các phần sau: đầu guiding thường mềm và cản quang, giúp giảm sang chấn khi đặt guiding vào lòng ĐMV. Sau đó là hai đoạn cong: sơ cấp (primary curve) và thứ cấp (secondary curve). Chính hình thái hai đoạn cong này sẽ quyết định hình dạng của guiding, Độ rộng giữa hai đoạn cong (đo bằng đơn vị cm) sẽ quyết định kích cỡ phần đầu guiding. Ví dụ ống thông JL 3,0 thì khoảng cách giữa hai đoạn cong là 3 cm. Sau các đoạn cong sẽ là phần thân (shaft) và cổng vào (hub) để đẩy dụng cụ.
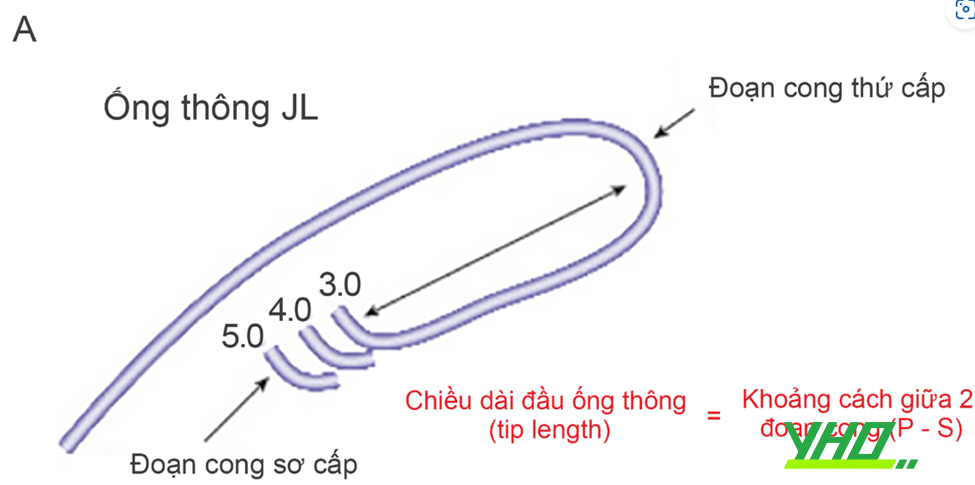
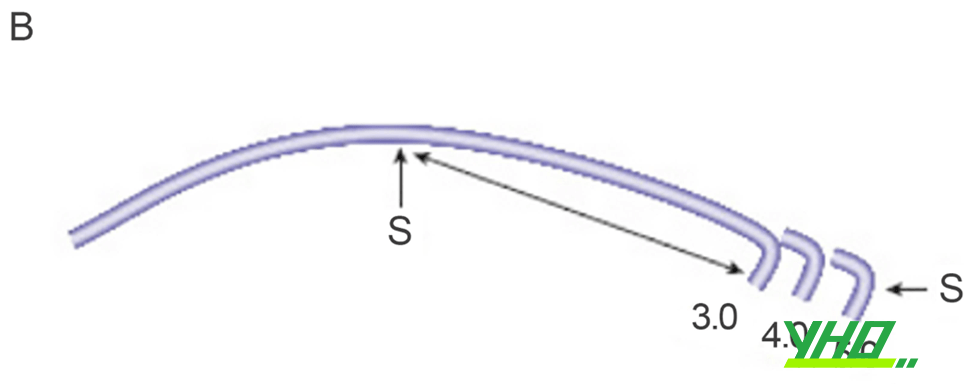
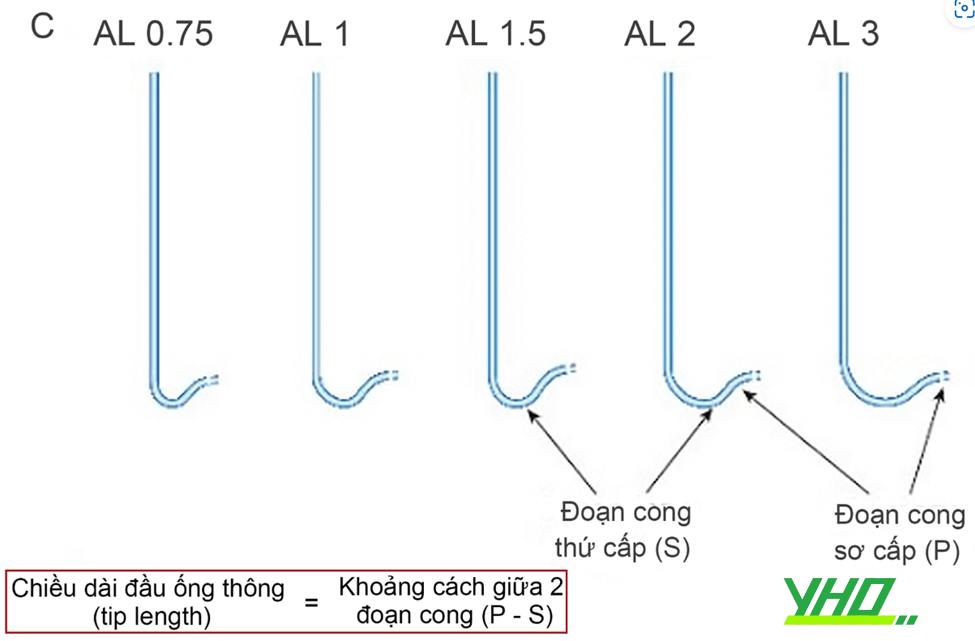 Hình 16.5. Hình dạng của một số guiding cơ bản. A: Ống thông JL (Judkins Left) với các kích cỡ 3,0-5,0. B: Ống thông JR (Judkins Right) với các kích cỡ 3,0-5,0. C: Ống thông AL (Amplatz Left) với các kích cỡ 0,75-3,0.
Hình 16.5. Hình dạng của một số guiding cơ bản. A: Ống thông JL (Judkins Left) với các kích cỡ 3,0-5,0. B: Ống thông JR (Judkins Right) với các kích cỡ 3,0-5,0. C: Ống thông AL (Amplatz Left) với các kích cỡ 0,75-3,0.Chú thích: P: đoạn cong sơ cấp (primary curve), S: đoạn cong thứ cấp (secondary curve)
Đặc điểm chi tiết của các loại ống thông được trình bày trong Bảng 16.3 và Bảng 16.4. Các thao tác với guiding được trình bày chi tiết trong Chương 17: Can thiệp động mạch vành cơ bản.
Bảng 16.3. Phân loại guiding (ống thông can thiệp) cho hệ động mạch vành trái theo mức độ hỗ trợ





Bảng 16.4: Phân loại gauiding cho hệ thống mạch vành phải theo mức độ hỗ trợ






 Hình 16.6. Minh họa tiếp cận lỗ vào động mạch vành và động mạch vú trong với một số loại guiding
Hình 16.6. Minh họa tiếp cận lỗ vào động mạch vành và động mạch vú trong với một số loại guiding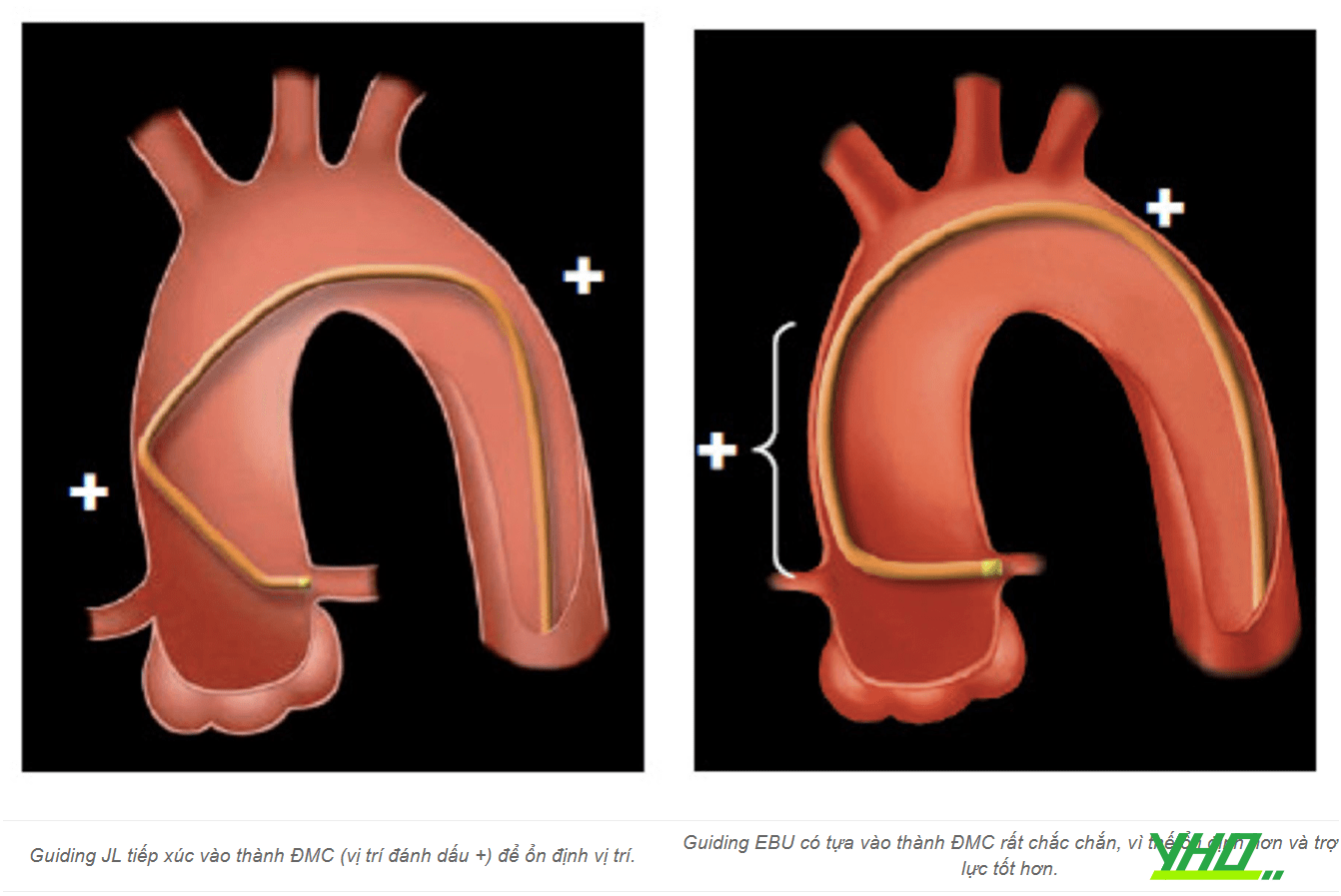 Hình 16.7. Minh họa hoạt động của guiding JL và EBU (Extra-Back Up)
Hình 16.7. Minh họa hoạt động của guiding JL và EBU (Extra-Back Up)ĐMC: Động mạch chủ.
2.4. Ống can thiệp nối dài
Về nguyên tắc, ống thông can thiệp càng tiếp cận gần tổn thương, khả năng hỗ trợ đẩy dụng cụ (bóng, stent) càng tốt. Điều này đặc biệt hữu ích trong các trường hợp tổn thương ĐMV phức tạp, mạch vành xoắn vặn, gập góc, hay vôi hoá nhiều. Tuy nhiên nếu đẩy guiding vào sâu trong lòng ĐMV, đầu cứng của guiding và kích cỡ lớn của nó có thể gây sang chấn mạch vành và cản trở tưới máu. Để giải quyết tình trạng này, các hãng dụng cụ đã sản xuất hệ thống ống can thiệp nối dài.
Ống can thiệp nối dài là một hệ thống monorail, được đẩy vào trong lòng guiding can thiệp qua dây dẫn 0,014”. Ống nối dài thường mỏng hơn guiding khoảng 1 French, giúp giảm sang chấn cho ĐMV. Tuy nhiên đường kính trong lại gần tương đương nhau, nhờ đó vẫn có thể đẩy dụng cụ can thiệp bên trong.
Phần đầu ống nối dài có độ dài 25 cm, là phần sẽ đi sâu vào trong lòng ĐMV. Tiếp nối phần đầu là đoạn thân bằng thép không gỉ, nhờ nó bác sĩ can thiệp có thể đẩy ống vào và kéo ống ra. Thân ống sẽ kéo dài ra tận phía ngoài van cầm máu. Các hệ thống ống can thiệp nối dài hiện có trên thị trường bao gồm: GuideLiner (hãng Teleflex), Guidezilla (hãng Boston Scientific), Telescope (hãng Medtronic), và Guidion (hãng IMDS). Chúng có kích cỡ 5-8Fr, đi vừa ống thông can thiệp có kích cỡ tương ứng.
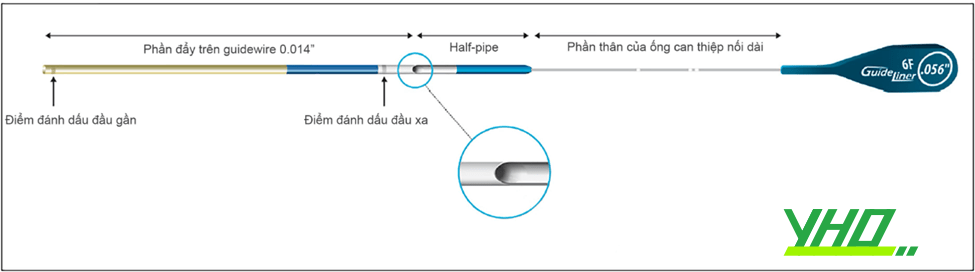 Hình 16.8. Cấu trúc của ống thông can thiệp nối dài
Hình 16.8. Cấu trúc của ống thông can thiệp nối dài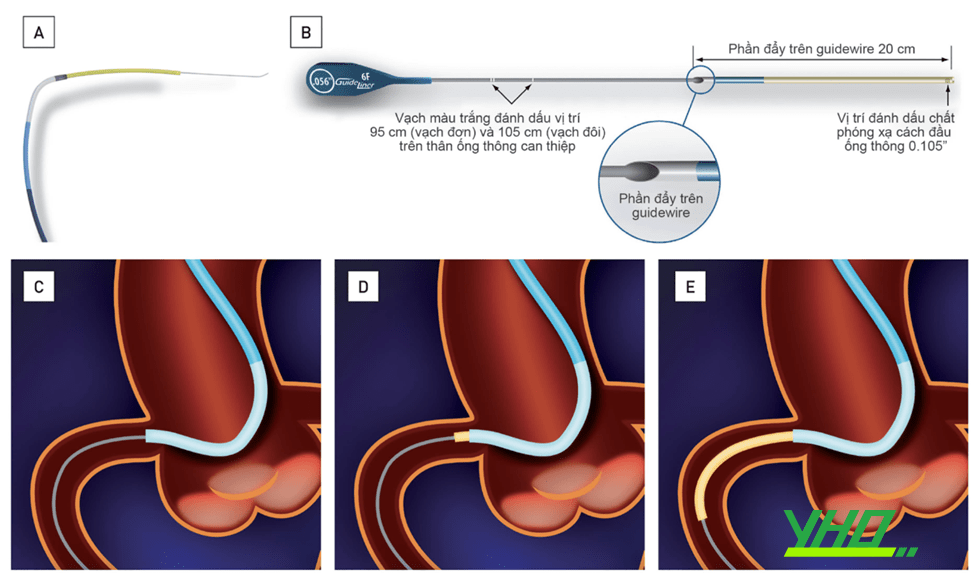 Hình 16.9. Thao tác với ống thông can thiệp nối dài (kỹ thuật “Mẹ bồng con”, “Mother and child”).
Hình 16.9. Thao tác với ống thông can thiệp nối dài (kỹ thuật “Mẹ bồng con”, “Mother and child”).A: Ống thông nối dài được đưa vào trong lòng guiding, giúp tiếp cận tổn thương dễ dàng hơn. B: Cấu trúc của ống thông nối dài. C: Đặt guiding can thiệp, lái dây dẫn vào trong lòng động mạch vành. D, E: Qua dây dẫn, đẩy ống thông nối dài trượt sâu vào trong lòng mạch, sát tổn thương cần can thiệp.
3. Dây dẫn can thiệp
3.1. Sơ lược lịch sử ra đời và phát triển
Tương tự guiding, lựa chọn dây dẫn can thiệp phù hợp cũng là điểm mấu chốt để có một ca can thiệp ĐMV thành công. Bóng nong ĐMV đầu tiên mà Gruntzig sử dụng năm 1977 có một dây dẫn ở đầu xa, dây dẫn này không thể điều hướng được. Cả bóng và dây dẫn được đưa vào trong lòng ĐMV như một hệ thống duy nhất, do vậy thao tác hết sức hạn chế.
Bước phát triển đột phá đã đến vào năm 1982, khi Simpson và cộng sự phát minh ra loại dây dẫn có đầu xa linh hoạt, có thể điều hướng theo ý muốn của thủ thuật viên. Dây dẫn này được gắn phía trong một bóng đồng trục (over-the-wire). Sự ra đời của dây dẫn can thiệp có thể điều hướng được coi là một trong những phát minh quan trọng nhất của chuyên ngành tim mạch can thiệp, mở ra khả năng tiếp cận và vượt qua gần như tất cả các tổn thương hẹp tắc ĐMV gặp trong thực tế lâm sàng. Ngày nay, công nghệ sản xuất dây dẫn đã có những bước phát triển đáng kể, với nhiều lựa chọn đa dạng phù hợp từng tổn thương cụ thể.
3.2. Cấu tạo một dây dẫn (guidewire) can thiệp
Dây dẫn can thiệp ĐMV có kích thước 0,009-0,014 inch. Cấu trúc cơ bản của một dây dẫn bao gồm lõi trung tâm, phần đầu tận, và lớp phủ ngoài. Phần đầu tận của lõi trung tâm được vuốt thuôn, cho phép uốn cong đầu dây dẫn.
Lõi dây dẫn thường được làm bằng thép không gỉ hoặc nitinol. Loại dây dẫn được cấu tạo bởi thép không gỉ có khả năng hỗ trợ, truyền lực xoay và khả năng đâm xuyên tốt, nhưng kém linh hoạt hơn. Dây dẫn loại nitinol bền hơn, siêu đàn hồi, mang lại sự linh hoạt và mô-men xoắn tốt trong giải phẫu mạch vành quanh co. Sự khác biệt cấu trúc trong lõi ảnh hưởng đến việc điều khiển dây dẫn.
Lớp phủ bên ngoài là polymer, làm cho dây dẫn ưa nước hơn hoặc kỵ nước hơn. Lớp phủ kỵ nước thường được làm bằng silicone và đẩy nước để giảm ma sát, tăng khả năng đi theo giải phẫu mạch vành và khả năng truyền phản hồi xúc giác tốt, tuy nhiên giảm khả năng đâm xuyên. Lớp phủ ưa nước hút nước và lớp phủ trở thành gel khi bị ướt. Điều này làm cho dây trơn trượt hơn và đâm xuyên tốt hơn. Cần thận trọng với những dây dẫn ưa nước do đầu trơn có thể trượt giữa các mảng xơ vữa, trong khi khả năng truyền phản hồi xúc giác lại bị giảm đi, vì thế có thể tạo ra vết lóc tách ĐMV hoặc thủng ĐMV trong quá trình thao tác.
Dây dẫn Runthrough NS Hypercoat của hãng Terumo có lớp phủ M-coat siêu ưa nước, tạo thuận lợi để lách qua tổn thương hẹp khít, gấp góc.
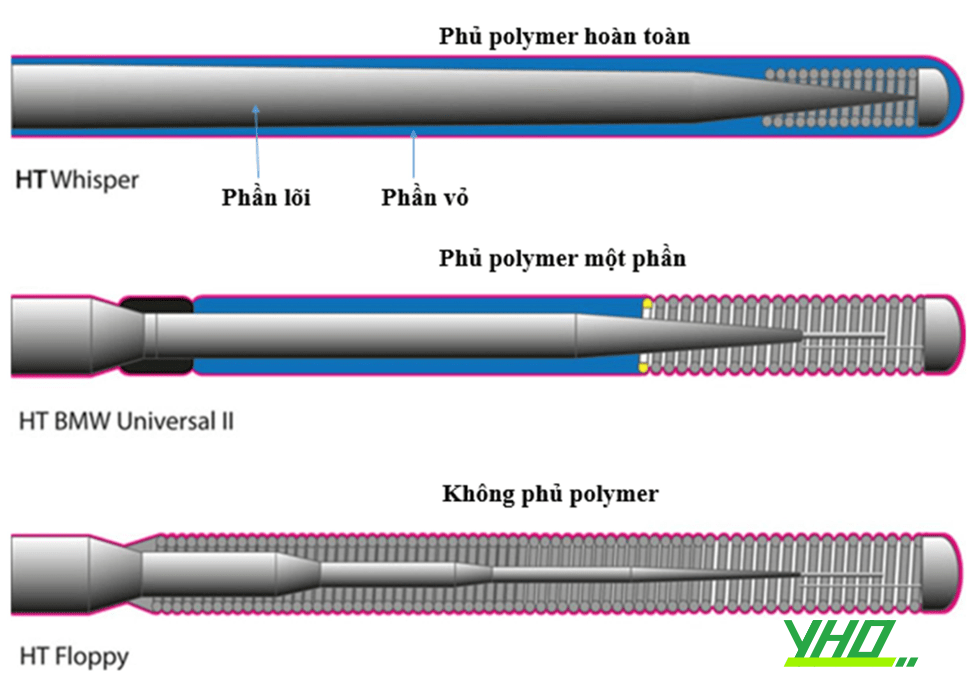 Hình 16.10. Cấu trúc một số loại dây dẫn can thiệp
Hình 16.10. Cấu trúc một số loại dây dẫn can thiệpPhần xa của dây dẫn có đặc tính cản quang. Chiều dài phần cản quang thông thường là 3 cm, cho phép ước lượng chiều dài tổn thương, tuy nhiên không làm nhiễu hình ảnh chụp mạch (như các lóc tách nhỏ ở đoạn gần ĐMV). Lưu ý rằng một số dây dẫn, như PT2 của hãng Boston Scientific, chiều dài đoạn cản quang chỉ là 2 cm. Nếu thủ thuật viên không lưu ý có thể sẽ ước tính sai chiều dài tổn thương. Các dây dẫn dùng trong can thiệp tổn thương tắc hoàn toàn mạn tính có thể có phần cản quang dài tới 15 cm, hỗ trợ thầy thuốc theo dõi đường đi của dây dẫn (ví dụ dây dẫn Gaia của hãng Asahi).
3.3. Chiều dài dây dẫn can thiệp
Dây dẫn có thể có chiều dài 180-190 cm, hoặc 300-330 cm. Dây dẫn có chiều dài thông thường là 180 cm là chiều dài phổ biến và được sử dụng với bóng monorail và stent.
Dây dẫn dài 300 cm được sử dụng để thực hiện tráo đổi các dụng cụ trên dây, sử dụng vi ống thông microcatheter), sử dụng bóng over-the-wire, can thiệp CTO ngược dòng hoặc khoan phá mảng xơ vữa.
Trong quá trình can thiệp, nếu đang sử dụng dây dẫn có chiều dài tiêu chuẩn (180 cm) mà cần dây dẫn dài hơn, có thể dùng dụng cụ nối dài dây dẫn.
3.4. Đặc tính của dây dẫn can thiệp
Việc lựa chọn dây dẫn phù hợp và lái thành công dây dẫn xa vị trí hẹp phụ thuộc vào đặc điểm giải phẫu của ĐMV, mức độ phức tạp của tổn thương, cũng như kinh nghiệm và kỹ năng của bác sĩ làm thủ thuật. Những yếu tố quan trọng khi lựa chọn một dây dẫn bao gồm độ cứng, đường kính đầu tận, lớp vỏ, khả năng kiểm soát momen xoắn, tính linh hoạt, độ dẻo dai, độ cản tia X và khả năng nhớ hình.
a. Độ cứng của dây dẫn
Dây dẫn đầu mềm có thể đi lách các nhánh động mạch xoắn dễ dàng hơn. Trong khi dây dẫn đầu cứng hữu ích hơn khi qua các chỗ vôi hoặc tắc hoàn toàn mạn tính. Các
dây dẫn có thân cứng sẽ hỗ trợ tốt hơn cho việc đẩy stent ở các đoạn mạch gập góc.
Một cách để lượng hoá độ cứng của dây dẫn là đo tải trọng cần thiết để làm cong đầu dây dẫn, xác định tại điểm cách đầu tận 1 cm. Ví dụ, dây dẫn Miracle 3 của hãng Asahi có tải trọng đầu xa là 3 gram, nghĩa là cần một vật nặng 3 gram để bẻ cong đầu dây dẫn Miracle 3. Hãng Asahi còn sản xuất những dây dẫn Miracle 6, 9, 12, với độ cứng tăng lên tương ứng. Độ cứng của dây dẫn được quyết định bởi đường kính lõi, vật liệu chế tạo lõi, cũng như hình thái đoạn xa của dây. Độ cứng tăng lên đồng nghĩa tăng nguy cơ dây dẫn gây thủng ĐMV nếu thao tác thiếu thận trọng.
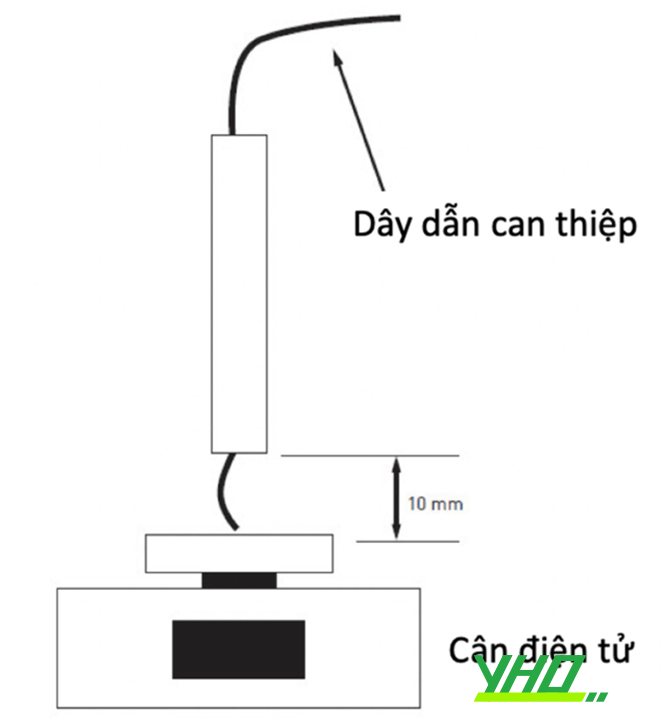 Hình 16.11. Đo tải trọng của dây dẫn trong phòng thí nghiệm
Hình 16.11. Đo tải trọng của dây dẫn trong phòng thí nghiệmb. Khả năng đi theo giải phẫu của mạch máu
Đặc tính này quyết định khả năng của dây đi qua được các mạch máu có giải phẫu phức tạp như xoắn vặn, gấp góc. Dây mềm có thể điều hướng các khúc cua gấp dễ dàng hơn nhiều so với dây cứng. Tính chất này được quyết định bởi thiết kế đầu dây và vật liệu của lõi.
c. Tính linh hoạt
Đây là khả năng của một sợi dây có thể uốn cong trên trục dọc của nó trong khi vẫn duy trì mô-men xoắn và khả năng đi theo mạch máu. Điều này rất quan trọng khi cần tiếp cận một tổn thương xoắn vặn hay gập góc. Lõi của dây được làm bằng nitinol rất dẻo hoặc thép không gỉ cứng, điều này thể hiện tính linh hoạt của dây dẫn.
d. Khả năng truyền lực xoay
Là khả năng truyền lực xoay từ đoạn đầu đến đoạn xa của dây dẫn. Lý tưởng nhất là truyền lực 1:1, nghĩa là thủ thuật viên chỉ cần xoay 1 vòng ở đuôi dây dẫn, thì đầu dây dẫn cũng xoay 1 vòng.
e. Khả năng đâm xuyên
Là khả năng dây dẫn có thể đi qua một tổn thương. Các dây dẫn cứng hơn thường có thể đi qua tổn thương cứng dễ dàng hơn, nhưng đồng nghĩa với nguy cơ gây thủng mạch vành.
Lực đâm xuyên của một dây dẫn được tính bằng tải trọng đầu dây chia cho thiết diện đầu dây. Do đó tải trọng đầu dây càng lớn và thiết diện càng nhỏ thì lực đâm xuyên càng mạnh. Một số dây dẫn có đầu thuôn nhọn, chỉ có đường kính 0,009 inch (trong khi phần thân đường kính 0,014 inch), do đó khả năng đâm xuyên cao hơn. Ví dụ về loại dây dẫn này là Fielder XT và Conquest Pro.
 Hình 16.12. Dây dẫn Miracle 3 và Miracle 6 có đường kính đầu tận 0,014”. Dây dẫn Conquest Pro 12 có đường kính đầu tận 0,009’’.
Hình 16.12. Dây dẫn Miracle 3 và Miracle 6 có đường kính đầu tận 0,014”. Dây dẫn Conquest Pro 12 có đường kính đầu tận 0,009’’.Bảng 16.5. Lực đâm xuyên của dây dẫn Miracle và Conquest
| MIRACLE 3 | MIRACLE 12 | CONQUEST PRO 12 | |
| Tải trọng Thiết diện đầu dây (=πr2) | 3g = 0,003kg 3,14 x (0,007)2 | 12g = 0,012kg 3,14 x (0,007)2 | 12g = 0,012kg 3,14 x (0,0045)2 |
| Lực đâm xuyên = tải trọng/thiết diện | 19 kg/in2 | 78 kg/in2 | 189 kg/in2 |
f. Khả năng hỗ trợ đẩy dụng cụ
Là khả năng của một dây dẫn có thể hỗ trợ việc di chuyển của một thiết bị hoặc hệ thống khác qua nó, thường phụ thuộc vào độ cứng ở thân dây dẫn. Một số dây dẫn chuyên dụng có thân rất cứng, được thiết kế nhằm mục đích hỗ trợ đẩy dụng cụ qua (ví dụ guidewire Grand Slam). Thông thường những dây dẫn này kém linh hoạt, nên rất khó lái qua tổn thương ĐMV. Vì thế, bác sĩ can thiệp có thể sử dụng một dây dẫn mềm đẩy qua tổn thương, sau đó tráo dây dẫn cứng, sử dụng vi ống thông.
3.5. Các loại dây dẫn thường dùng trong can thiệp ĐMV
Mỗi dây dẫn đều có những đặc điểm riêng biệt: cách dễ nhất để nhớ chi tiết của từng loại dây dẫn là chia chúng thành các nhóm có chung đặc điểm (Bảng 16.6, 16.7, 16.8).
Các loại dây dẫn được chia thành 3 nhóm:
- Nhóm 1: Dây dẫn thường quy, là lựa chọn đầu tay trong phần lớn các ca can thiệp.
- Nhóm 2: Dây dẫn dành cho tổn thương phức tạp, như mạch vành hẹp khít, mạch vành xoắn vặn hay gập góc nhiều, vôi hoá, tổn thương
- Nhóm 3: Dây dẫn đặc chủng, mục đích không phải để lái qua tổn thương mà chỉ giúp hỗ trợ đẩy các dụng cụ hay có những vai trò chuyên dụng.
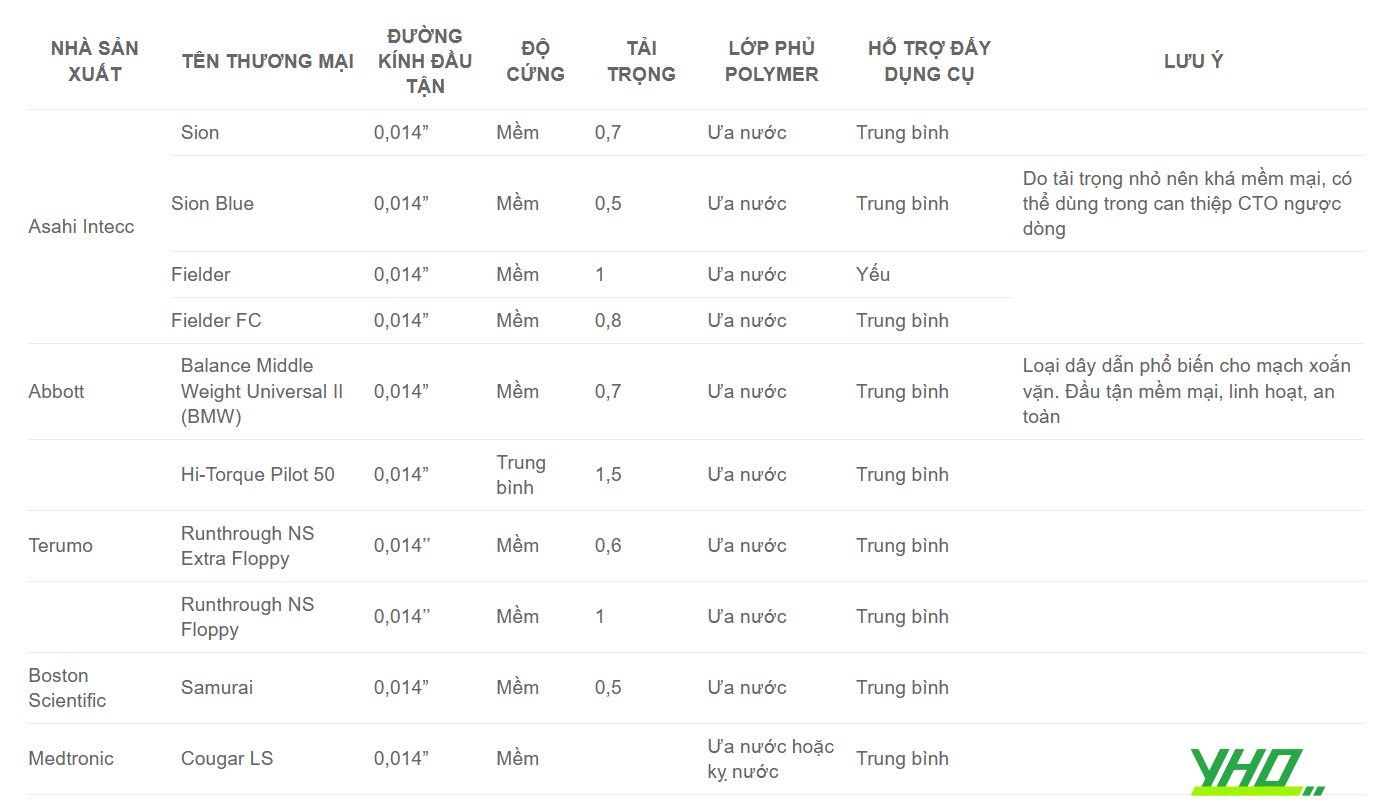
Bảng 16.6. Các dây dẫn thường quy
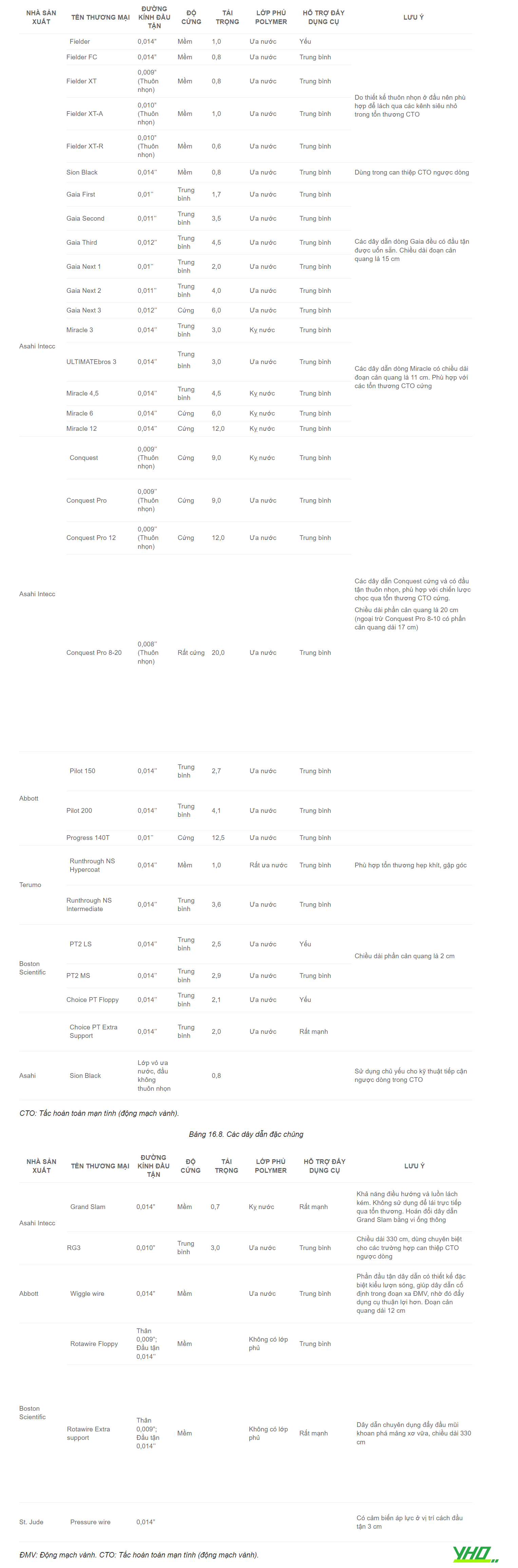
Bảng 16.7. Các dây dẫn dành cho tổn thương mạch vành phức tạp
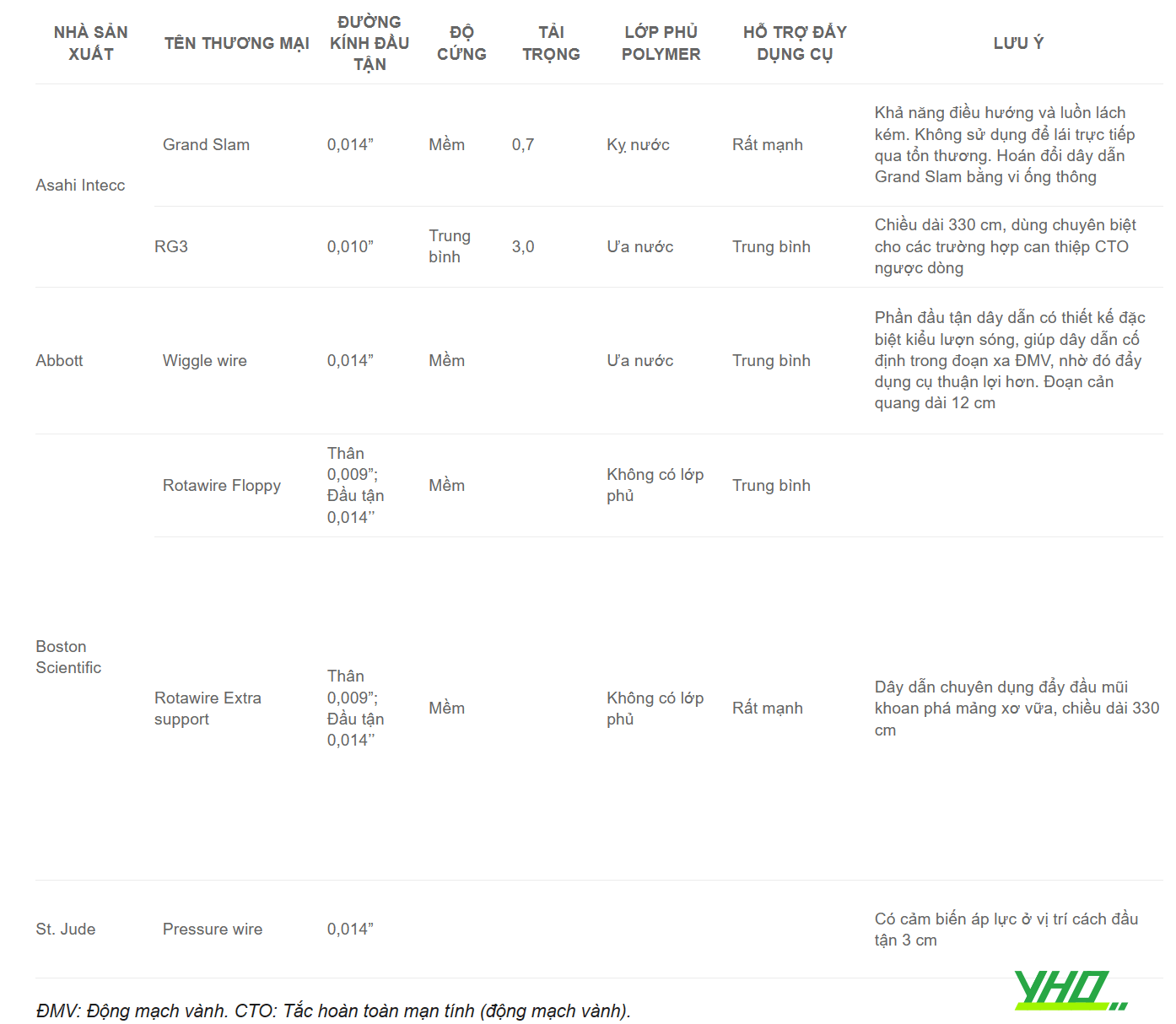
Bảng 16.8. Các dây dẫn đặc chủng
3.6. Vi ống thông hỗ trợ đẩy và lái dây dẫn
Trong thực tế, việc lái dây dẫn nhiều khi không đơn giản, do các trở lực trên đường đi (mạch xoắn, vôi hoá) hoặc các góc gập giữa nhánh chính với nhanh bên. Việc sử dụng vi ống thông (microcatheter) giúp dây dẫn tiếp cận và đi qua tổn thương dễ dàng hơn. Hiểu biết về thiết kế và đặc tính
từng loại vi ống thông cụ thể sẽ giúp tăng tỉ lệ thành công của thủ thuật, giảm thời gian chiếu tia, giảm lượng thuốc cản quang sử dụng.
a. Cấu trúc vi ống thông
Có hai loại vi ống thông: loại 1 lòng và loại 2 lòng.
Vi ống thông 1 lòng
Đây là loại vi ống thông cơ bản. Nó đơn giản là một ống thông nhỏ với đường kính ngoài 2,6-3,2 Fr, có lòng trong đủ rộng để đẩy dây dẫn bên trong. Các vi ống thông thường được thiết kế thuôn nhọn, nghĩa là đầu xa nhỏ hơn đầu gần. Vi ống thông được tráng lớp phủ ưa nước, giúp nó di chuyển dễ dàng trong lòng guiding và ĐMV. Vi ống thông có marker cản quang giúp thầy thuốc quan sát vị trí của dụng cụ.
Vai trò:
- Tăng độ đâm xuyên của dây dẫn.
- Giữ cho đầu dây dẫn không bị cong gập quá mức.
- Hỗ trợ dây dẫn đi qua hệ thống tuần hoàn bàng hệ khi can thiệp CTO ngược dòng.
- Có thể sử dụng để tráo dây dẫn.
- Chụp mạch máu đoạn xa bằng cách bơm thuốc cản quang vào lòng vi ống thông.
- Đi qua tổn thương hẹp khít hay vôi hoá (vi ống thông Tornus).
 Hình 16.13. Thiết kế vi ống thông FineCross (hãng Terumo)
Hình 16.13. Thiết kế vi ống thông FineCross (hãng Terumo)Các bóng đồng trục (OTW) có thể được sử dụng thay thế vi ống thông trong việc hỗ trợ đẩy dây dẫn. Tuy nhiên vi ống thông được ưa thích hơn do cấu hình nhỏ gọn, đồng thời có điểm mốc cản quang ở đầu tận giúp thầy thuốc định vị chính xác hơn (bóng OTW cỡ nhỏ thường có mốc cản quang nằm giữa thân bóng).
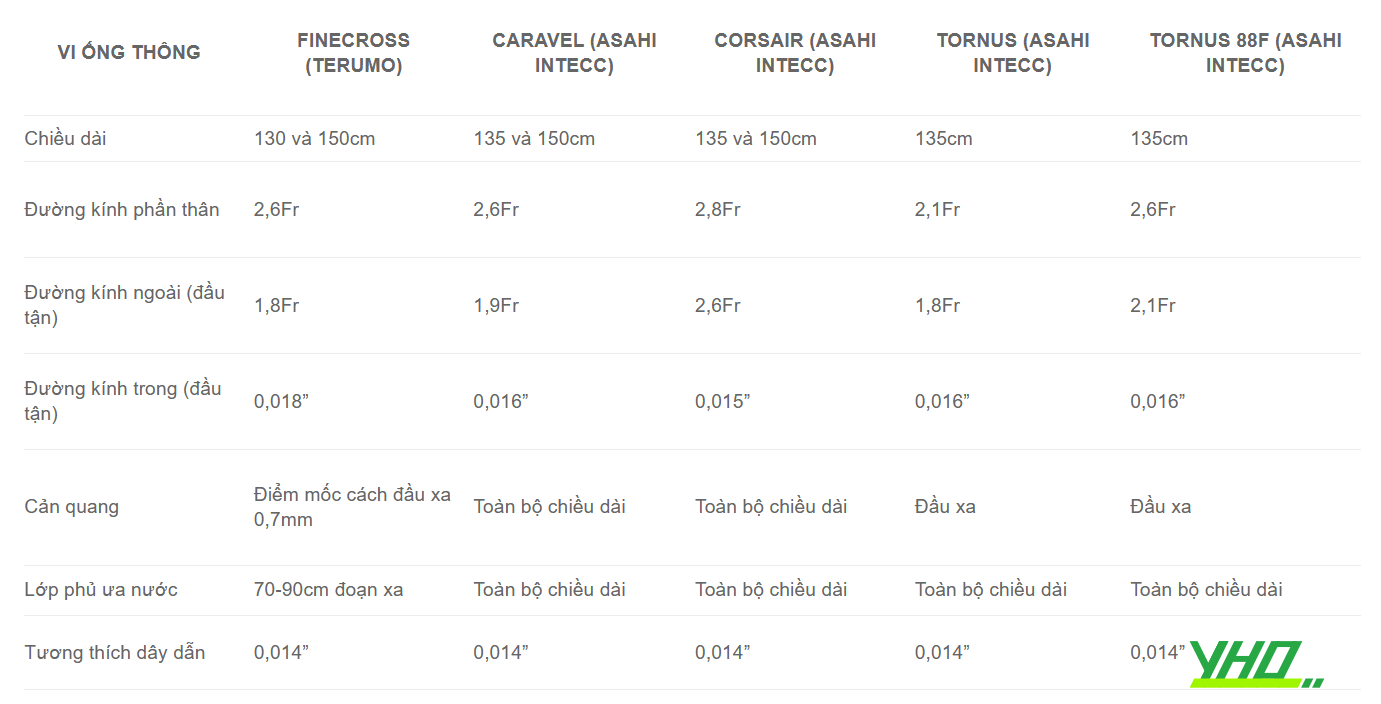
Bảng 16.9. Một số loại vi ống thông 1 lòng
Vi ống thông 2 lòng
Các vi ống thông này có 2 lòng để đẩy 2 dây dẫn bên trong. Một lòng ống là hệ thống đồng trục, một lòng là hệ thống monorail. Lòng monorail sẽ mở ra đầu tận của vi ống thông, còn lòng đồng trục sẽ chạy dọc hoàn toàn trong ống thông, trước khi mở ra ngoài ở vị trí cách đầu tận vài mm. Ứng dụng của vi ống thông 2 lòng này là giúp lái dây dẫn vào vị trí mong muốn (Hình 16.14).
Vi ống thông Crusade của hãng Kaneka có chiều dài 140cm. Phần thân để đưa dây dẫn vào có đường kính 3,1Fr, phần đầu tận đường kính 2,2Fr, tương thích 2 dây dẫn 0,014”. Đầu tận có 2 điểm mốc cản quang tương ứng 2 lỗ cho dây dẫn đi ra. Ngoài Crusade, trên thị trường còn có một số vi ống thông 2 lòng khác như Twin-Pass (hãng Teleflex), Sasuke (hãng Asahi Intecc), FineDuo (hãng Terumo).
 Hình 16.14. Thiết kế vi ống thông 2 lòng Crusade (hãng Kaneka)
Hình 16.14. Thiết kế vi ống thông 2 lòng Crusade (hãng Kaneka)b. Đặc tính kỹ thuật của các vi ống thông Cấu hình nhỏ gọn
Để đi qua những đoạn mạch xoắn vặn, mạch nhỏ, tuần hoàn bàng hệ, vi ống thông cần có cấu hình nhỏ. Các vi ống thông có đoạn thuôn dài ở đầu như Caravel hay Corsair (hãng Asahi) sẽ phù hợp để đi qua hệ thống tuần hoàn bàng hệ. Trong khi vi ống thông FineCross (hãng Terumo) phần thuôn ở đầu rất ngắn, do vậy hỗ trợ đâm xuyên tốt hơn.
Những vi ống thông có đầu tận nhỏ (như Caravel, 1,9Fr) sẽ dễ đẩy hơn vi ống thông đầu tận lớn (Corsair, 2,6Fr).
Tương thích dây dẫn
Đường kính trong của vi ống thông càng ôm sát dây dẫn, hiệu quả trợ lực càng cao. Nếu tồn tại khoảng trống giữa dây dẫn với thành vi ống thông, dây dẫn sẽ di động tự do trong lòng ống, và đôi khi không dễ để đẩy vi ống thông trượt theo dây dẫn đi qua tổn thương.
Độ cản quang
Dây dẫn cản quang toàn bộ chiều dài giúp thầy thuốc định vị tốt hơn (ví dụ trong trường hợp can thiệp CTO ngược dòng). Tuy nhiên có thể ảnh hưởng đến việc đánh giá tình trạng ĐMV ở đoạn gần.
Tính dễ đẩy qua tổn thương
Đặc tính này được quyết định bởi cấu trúc vi ống thông và lớp phủ ngoài (thường là PTFE hay polyurethane). Lớp phủ ngậm nước giúp vi ống thông đi qua tổn thương bằng thao tác đẩy hoặc vừa đẩy vừa xoay.
Vi ống thông Tornus có thiết kế đặc biệt, phù hợp với mục đích đi qua tổn thương. Thân ống thông được làm bằng vòng cuộn bằng thép không gỉ. Thầy thuốc sẽ đẩy dụng cụ bằng cách xoay ống thông (lưu ý không xoay quá 20 vòng mỗi lần vì có thể làm xoắn ống thông). Đoạn đầu của Tornus thuôn nhọn, thuận lợi để đi qua tổn thương hẹp khít.
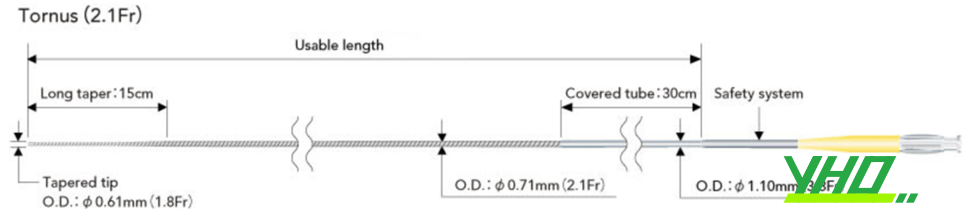 Hình 16.15. Thiết kế vi ống thông Tornus (hãng Asahi Intecc)
Hình 16.15. Thiết kế vi ống thông Tornus (hãng Asahi Intecc)c. Ứng dụng của vi ống thông trong can thiệp mạch vành
Động mạch vành xoắn vặn
Nếu đoạn gần ĐMV xoắn vặn, vi ống thông sẽ giúp trợ lực dây dẫn tốt hơn. Trong trường hợp này nên sử dụng vi ống thông mềm mại hơn là loại cứng, do loại cứng có thể sẽ tiếp cận tổn thương khó khăn.
Tổn thương cứng, hẹp khít
Vi ống thông sẽ trợ lực và tăng khả năng đâm xuyên của dây dẫn. Cần đẩy vi ống thông càng sát đầu tận của dây dẫn càng tốt.
Tổn thương CTO
Can thiệp CTO cả xuôi dòng và ngược dòng đều cần vi ống thông hỗ trợ. Dụng cụ này giúp dây dẫn đâm xuyên qua tổn thương tốt hơn, giúp bác sĩ can thiệp hoán đổi nhiều dây dẫn khác nhau, cũng như có thể bơm thuốc qua
ống thông để khẳng định dụng cụ đi đúng đường và nằm trong lòng mạch.
Động mạch vành vôi hoá
Với ĐMV vôi hoá, dây dẫn có thể dễ dàng bị cong gập hay hỏng dọc đường đi, trước khi có thể tiếp cận tổn thương. Bảo vệ dây dẫn bằng vi ống thông.
Khi tiến hành khoan phá mảng xơ vữa, sau khi lát dây dẫn qua tổn thương, đẩy vi ống thông qua rồi tráo dây dẫn RotaWire.
Động mạch vành gập góc
Các vi ống thông 2 lòng có vai trò quan trọng trong trường hợp này. Một dây dẫn sẽ tiếp cận nhánh chính qua lòng monorail. Dây dẫn còn lại tiếp cận nhánh bên theo lòng OTW. Điều chỉnh vị trí vi ống thông sao cho đầu ra của dây số hai phù hợp với chỗ xuất phát của nhánh bên (Hình 16.16).
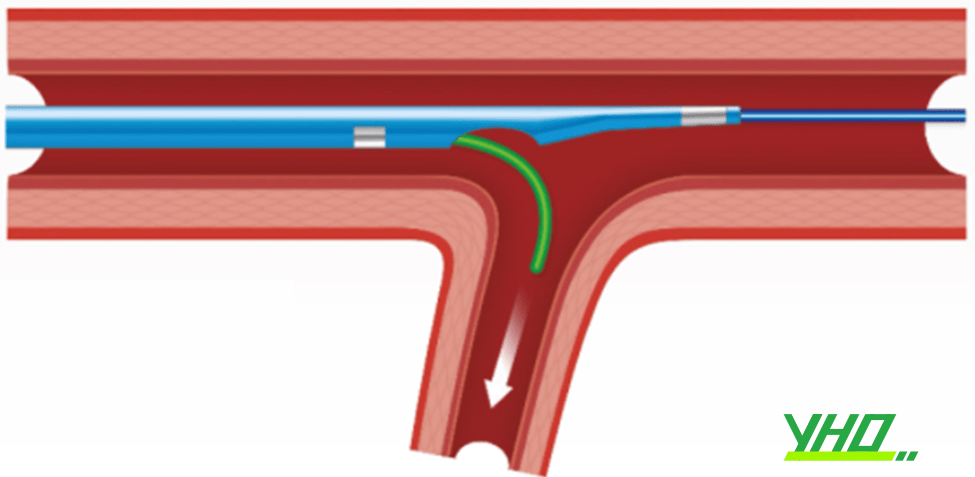 Hình 16.16. Lái dây dẫn vào nhánh bên gập góc sử dụng vi ống thông 2 lòng
Hình 16.16. Lái dây dẫn vào nhánh bên gập góc sử dụng vi ống thông 2 lòngXử trí thủng ĐMV
Trong trường hợp thủng mạch vành đoạn xa, có thể đẩy vi ống thông vào vị trí đó, rồi đẩy coil, hoặc bơm mỡ tự thân, hoặc spongel vào để bít tắc lỗ thủng.
4. Bóng nong động mạch vành
4.1. Hệ thống bóng đồng trục và hệ thống bóng một đường
Có hai loại bóng trong can thiệp ĐMV, dựa theo cách dây dẫn đi trong lòng bóng: (1) bóng over-the-wire (OTW) hay bóng đồng trục là bóng có hai cổng ra phần chuôi (đầu gần) với một cổng để dây dẫn chạy suốt chiều dài (over the wire) và một cổng kết nối bơm bóng. (2) Bóng một đường ra (monorail) hay còn gọi bóng thay nhanh (rapid exchange), là bóng chỉ có một cổng kết nối để bơm bóng ở phần chuôi bóng còn dây dẫn chỉ chạy trên một đoạn phần đầu bóng và tách ra lỗ bên giúp thay bóng, tráo dụng cụ khác nhanh hơn và không cần dây dẫn dài. (Hình 16.17 và Hình 16.18).
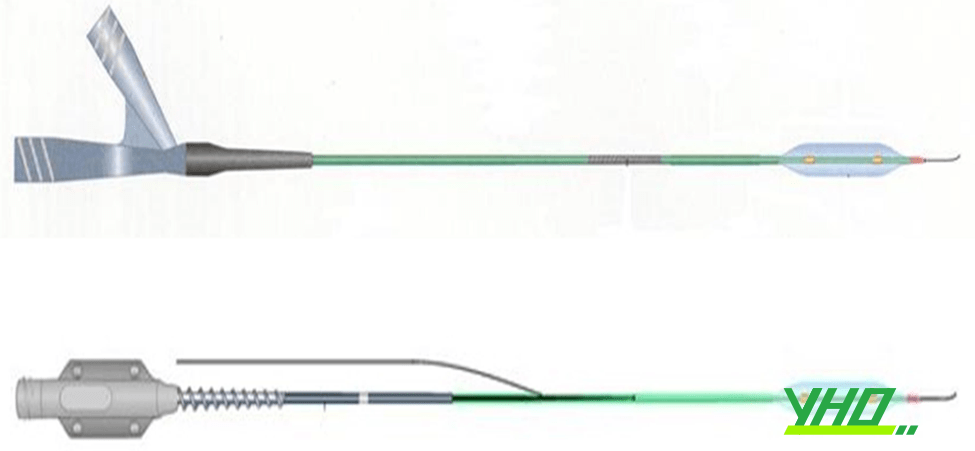 Hình 16.17. Bóng đồng trục hay bóng OTW và Bóng một đường hay monorail
Hình 16.17. Bóng đồng trục hay bóng OTW và Bóng một đường hay monorail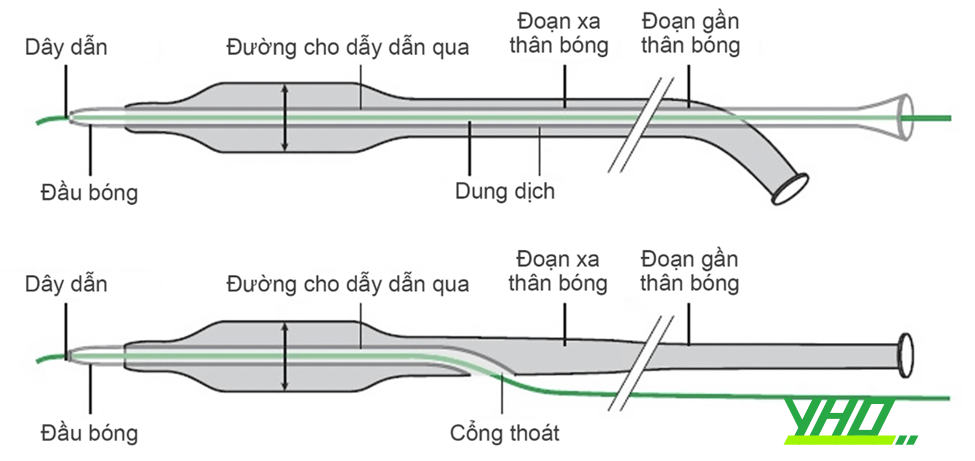 Hình 16.18. Cấu tạo của bóng đồng trục và bóng một đường
Hình 16.18. Cấu tạo của bóng đồng trục và bóng một đườnga. Bóng đồng trục (bóng Over-the-wire, OTW)
Một bóng đồng trục tiêu chuẩn có hai lòng thông suốt chiều dài bóng, một lòng cho dây dẫn và lòng còn lại để bơm bóng (Hình 16.17 và hình 16.18). Các bóng này có thân dài khoảng 145-155cm và được thiết kế tương thích với dây dẫn các đường kính 0,014”.
Bóng OTW có một số ưu điểm, tương tự một vi ống thông. Nó cho phép hoán đổi dây dẫn, trợ lực đẩy dây dẫn, và có có thể bơm thuốc cản quang và thuốc qua lòng bóng để đánh giá dòng chảy mạch vành đoạn xa. Do dây dẫn chạy trong suốt chiều dài lòng bóng nên bóng OTW dễ trượt trên dây dẫn để đi qua tổn thương hơn. Với thủ thuật tiêm cồn triệt đốt vách liên thất điều trị bệnh cơ tim phì đại, bơm căng bóng, rút dây dẫn ra, sau đó tiêm cồn tuyệt đối vào nhánh Septal mạch vành. Cồn sẽ khư trú ở nhánh Septal chứ không trào ngược về động mạch vách liên thất trước gây bít tắc nhánh lớn ĐMV. (Xem thêm Chương 45: Can thiệp làm mỏng vách liên thất bằng cồn điều trị bệnh cơ tim phì đại).
Nhược điểm lớn nhất của bóng OTW là phần lớn thao tác đòi hỏi hai người. Thủ thuật viên chính sẽ đẩy bóng vào trong lòng mạch, trong khi người phụ giữ đầu xa của dây dẫn. Dây dẫn sử dụng cho các thiết bị OTW cũng thường có độ dài tối thiểu 260 cm, do chiều dài thân bóng đã là 145-155 cm, còn chiều dài guiding là 100 cm. Khi rút bóng ra, cũng cần một người phụ giữ dây dẫn.
Ngoài ra, bóng đồng trục thường có cấu hình lớn chứ không nhỏ gọn như bóng monorail. Cần lưu ý các thông số của bóng để lựa chọn guiding có kích cỡ phù hợp.
b. Bóng monorail (bóng một đường)
Thời kỳ đầu, tất cả bóng nong ĐMV đều là bóng đồng trục. Sự ra đời của bóng monorail năm 1985 đã giúp thủ thuật can thiệp ĐMV trở nên thuận lợi và có phạm vi ứng dụng rộng lớn hơn. Điểm đặc trưng của hệ thống monorail là dây dẫn chỉ chạy trong một phần lòng bóng (nằm ở đoạn tận của bóng). Còn lại, dây dẫn chạy bên ngoài lòng bóng. Hệ thống monorail được ứng dụng không chỉ với bóng hay stent mà còn cả nhiều thiết bị khác dùng trong chẩn đoán và can thiệp mạch vành, như đầu dò siêu âm trong lòng mạch (IVUS).
Monorail hay bóng một đường đã được cải tiến cho phép thao tác chỉ cần một bác sĩ làm thủ thuật. Bóng một đường có một lòng dài hoàn toàn để bơm bóng, và chỉ có duy nhất một đoạn ngắn (30-40cm) của trục bóng ở đoạn xa có hai lòng (Hình 16.17 và hình 16.18), lòng thứ hai cho phép bóng đi theo dây dẫn. Vì chỉ có một phần ngắn của bóng có hai lòng nên bóng một đường có cấu hình nhỏ hơn bóng OTW.
Bóng một đường giải quyết hạn chế của bóng OTW. Thủ thuật viên có thể đẩy bóng bằng một tay, trong khi tay kia giữ dây dẫn. Do đó một thủ thuật viên có thể độc lập thao tác với bóng một đường, gồm cả việc hoán đổi bóng. Vì vậy, bóng monorail còn được gọi là bóng hoán đổi nhanh (rapid-exchange).
Bóng monorail đòi hỏi thận trọng hơn trong thao tác với dây dẫn, đầu bóng và guiding can thiệp. Do chỉ có một phần dây dẫn chạy trong lòng bóng, không phải lúc nào cũng có thể đẩy bóng dễ dàng đi qua tổn thương, nhất là các trường hợp hẹp khít hay vôi hoá. Nếu đẩy quá mạnh có thể làm gập gãy thân bóng, hoặc dây dẫn uốn cong trong động mạch chủ. Lúc này, tốt nhất là tráo đổi bóng khác có đường kính nhỏ hơn.
4.2. Đặc điểm của bóng nong mạch vành
a. Bóng thường và bóng áp lực cao
Chất liệu của bóng quyết định độ giãn nở (được định nghĩa là mức độ nở hay kích thước bóng khi được bơm với áp lực nhất định) và độ căng của nó. Độ giãn nở là đặc điểm khác biệt chính giữa các loại bóng. Dựa vào đó có thể chia ra hai loại: bóng giãn nở (bóng thường) và bóng không giãn nở (hay còn gọi là bóng áp lực cao). Với bóng không giãn nở, ngay cả khi bơm bóng áp lực rất cao, đường kính của bóng cũng không tăng đáng kể. Trong khi với bóng thường, bơm bóng quá áp lực định mức sẽ làm đường kính bóng tăng lên đáng kể, hậu quả là rách vỡ bóng, hoặc vỡ ĐMV.
Bóng áp lực cao được sử dụng trong các trường hợp cần bơm căng bóng mà không ảnh hưởng tới đường kính bóng. Ví dụ như nong bóng sau đặt stent (nhằm đảm bảo áp sát stent vào thành mạch), hoặc nong các tổn thương vôi hoá, tổn thương tái hẹp trong stent.
b. Áp lực bơm bóng
Có hai loại áp lực bơm bóng: áp lực định mức (Nominal Pressure, NP) và áp lực vỡ (Rated Burst Pressure, RBP). Áp lực định mức là áp lực mà tại đó bóng sẽ giãn nở ra theo đúng đường kính cho trước. Áp lực vỡ là áp lực mà dưới áp lực đó, 99,9% trường hợp bóng sẽ không vỡ. Có thể hiểu áp lực vỡ là áp lực cho phép thầy thuốc tự tin bơm căng bóng. Với mỗi loại bóng cụ thể, cần tham khảo bảng áp lực được nhà sản xuất in trên bao bì sản phẩm. Nói chung, hạn chế bơm bóng vượt quá áp lực vỡ.
Một số nguyên tắc cơ bản áp dụng chung cho việc bơm bóng như sau:
– Bơm bóng quá căng: Theo định luật Laplace, sức căng của thành bóng tăng theo bán kính. Ở áp lực nhất định, bóng lớn hơn chịu nhiều sức căng hơn bóng nhỏ, làm cho bóng vỡ. Các vị trí động mạch liền kề chỗ hẹp có thể bị tổn thương bởi sự bơm căng ở áp lực cao, dẫn đến lóc tách thành mạch máu. Không nên bơm căng bóng vượt quá áp lực định mức quá nhiều lần.
– Đường kính của bóng thường tăng theo áp lực: Ngay cả bóng không giãn nở cũng sẽ tăng kích thước (thường <10% định mức) với áp lực cao. Bóng giãn nở có thể tăng hơn 20%. Mối tương quan giữa đường kính
bóng và áp lực thường là tuyến tính. Hình 16.19 cho thấy bóng trong quá trình bơm căng và biểu đồ liên quan giữa áp lực với đường kính. Bóng không trở về kích thước ban đầu sau khi xuống áp lực. Ở bất kỳ áp lực nào, đường kính bóng trong lần bơm căng tiếp theo sẽ lớn hơn lần bơm đầu tiên. Khi có hai tổn thương cần nong bóng, nên bắt đầu nong với tổn thương hẹp khít hơn.
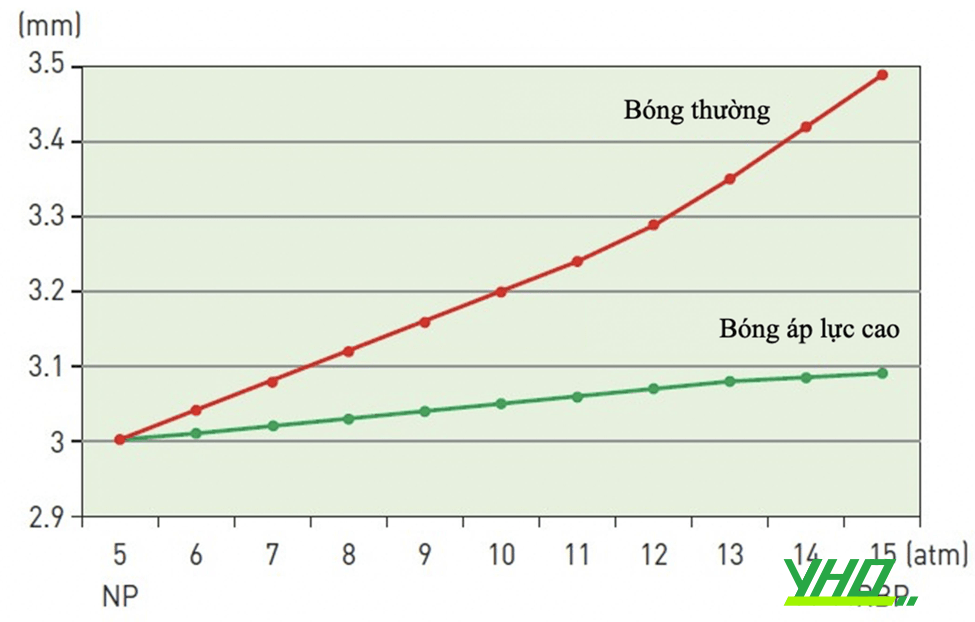 Hình 16.19. Mối tương quan giữa áp lực bơm bóng và đường kính bóng
Hình 16.19. Mối tương quan giữa áp lực bơm bóng và đường kính bóng4.3. Bóng phủ thuốc
a. Cấu tạo
Bóng phủ thuốc là bóng nong ĐMV loại giãn nở trung bình, được phủ một lớp thuốc chống tăng sinh nội mạc mạch máu. Ưu điểm của nó là giảm tỉ lệ tái hẹp so với nong bóng đơn thuần, trong khi lại tránh được việc dị vật (stent kim loại) trong lòng mạch. Khác với stent phủ thuốc giải phóng thuốc dần dần trong thời gian dài hạn, bóng phủ thuốc nhanh chóng giải phóng thuốc vào thành mạch trong vòng 30-60 giây. Vì thế, lớp thuốc phủ trên bóng thường có đặc tính ưa mỡ nhiều hơn lớp thuốc sử dụng trong stent phủ thuốc. Hiện nay, hầu hết các bóng phủ thuốc đều dùng paclitaxel, với hàm lượng thuốc trên bề mặt bóng khoảng 2 – 3,5 mg/mm2. Yếu tố quan trọng giúp giải phóng thuốc tốt là công thức hoá học và kỹ thuật sản xuất lớp phủ. Những đặc điểm công nghệ này sẽ dẫn tới đặc tính dược lực học khác nhau của từng loại bóng, qua đó ảnh hưởng tới đáp ứng của thành mạch sau khi được điều trị bằng bóng phủ thuốc.
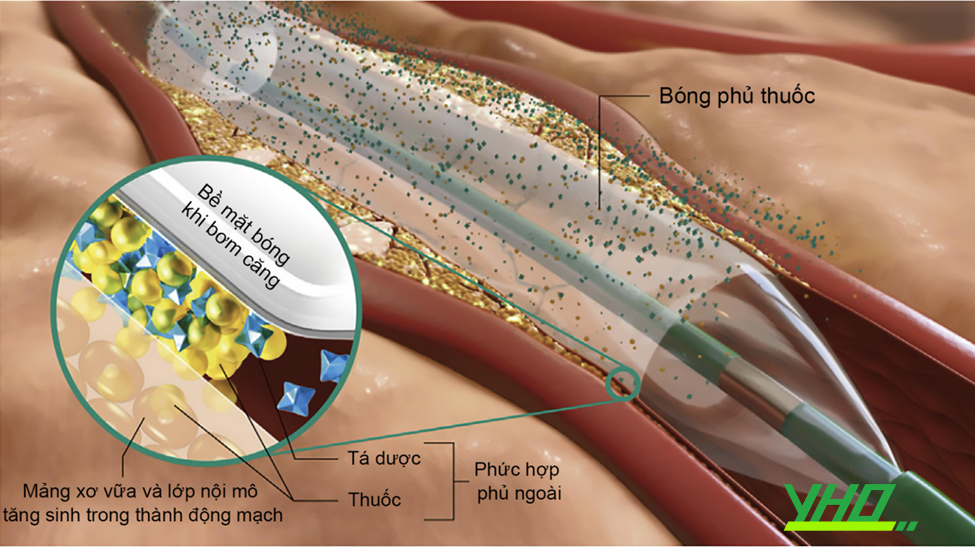 Hình 16.20. Cơ chế hoạt động của bóng phủ thuốc
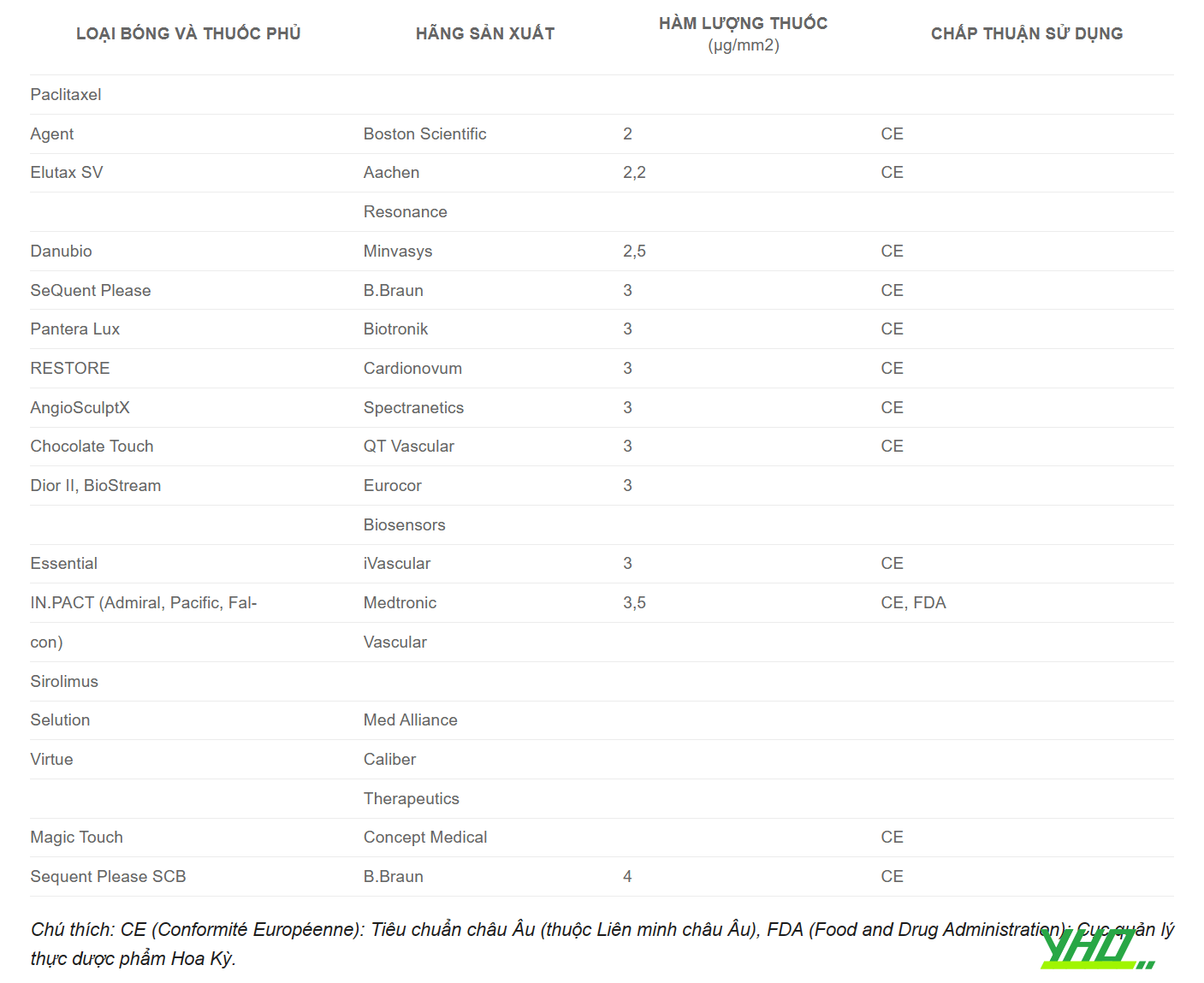
Hình 16.20. Cơ chế hoạt động của bóng phủ thuốcBảng 16.10. Các loại bóng phủ thuốc có trên thị trường
b. Kỹ thuật nong bằng bóng phủ thuốc
Nhớ rằng bóng phủ thuốc có cấu hình lớn hơn bóng thường, vì thế đôi khi đẩy qua tổn thương không dễ dàng. Do đó cần nong trước mạch máu để tạo thuận cho quá trình dùng bóng phủ thuốc.
Với các tổn thương đơn giản, chuẩn bị tổn thương bằng cách nong bóng thường kích cỡ 1:1 so với kích thước lòng mạch. Nếu không thể nong rộng tổn thương, có thể dùng bóng áp lực cao, hoặc bóng cắt. Với trường hợp tái hẹp trong stent, cần nong tích cực bằng bóng áp lực cao, để làm giãn đoạn mạch mà stent nở không tốt.
Chuẩn bị tổn thương tối ưu giữ vai trò quan trọng để giảm tỉ lệ tái can thiệp sau khi dùng bóng phủ thuốc. Mạch máu được chuẩn bị tối ưu sẽ hấp phụ thuốc tốt hơn. Sau khi nong bóng, cần chụp lại mạch máu để khẳng định một số tiêu chí trước khi dùng bóng phủ thuốc: (1) mạch vành giãn nở tốt, hẹp tồn lưu < 30%, (2) dòng chảy TIMI 3, không có lóc tách thành mạch vành gây cản trở dòng chảy.
c. Các thử nghiệm lâm sàng về bóng phủ thuốc
Thử nghiệm về bóng phủ thuốc được tiến hành ở hai nhóm tổn thương: tái hẹp trong stent và tổn thương mới của ĐMV (tổn thương de novo). Bảng dưới đây tóm tắt các nghiên cứu về hiệu quả của bóng phủ thuốc.
Bảng 16.11. Các thử nghiệm về vai trò của bóng phủ thuốc trong điều trị tái hẹp stent
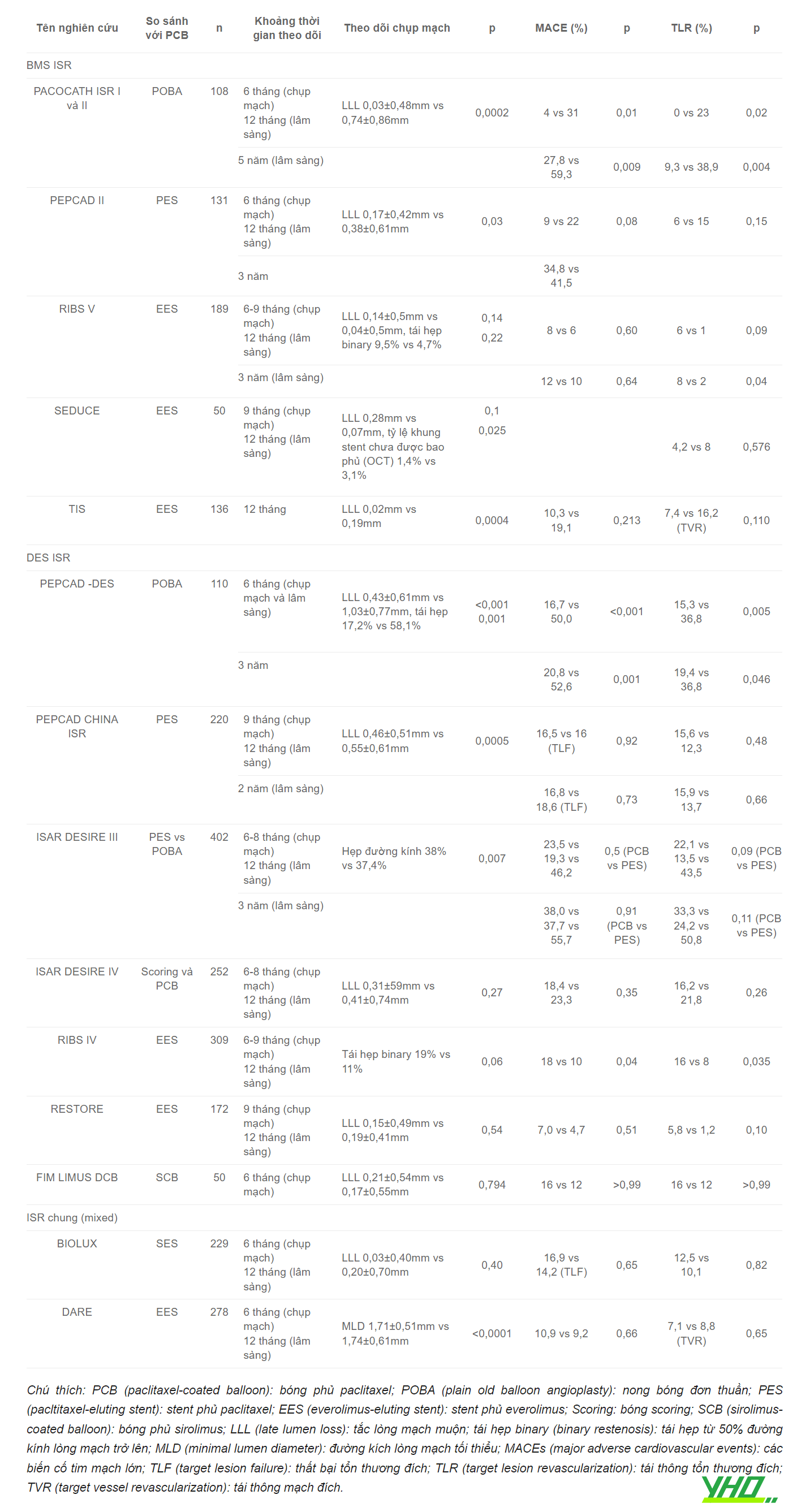
Bảng 16.12. Các thử nghiệm về vai trò của bóng phủ thuốc điều trị tổn thương mạch vành mới
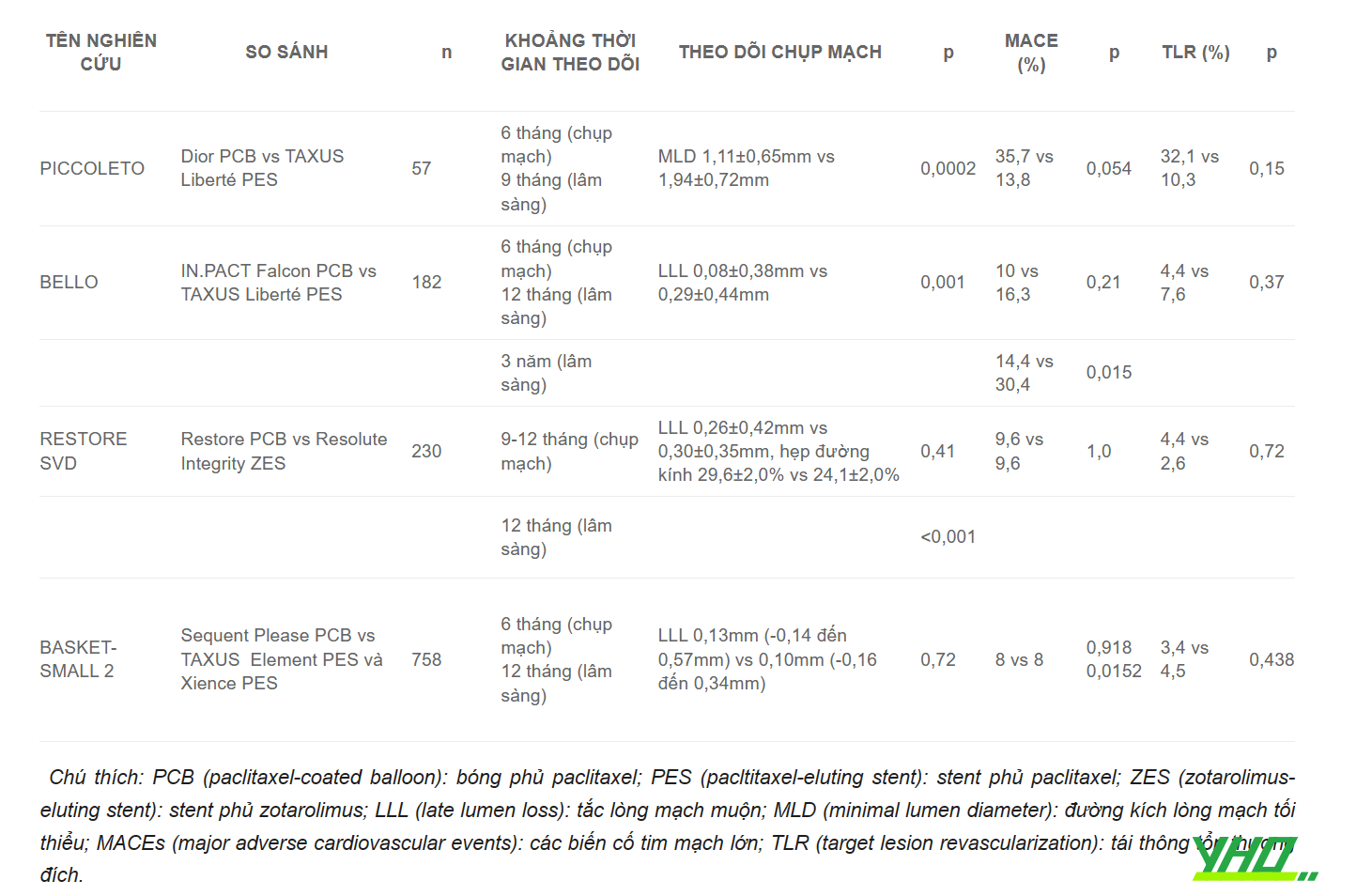
Tại thời điểm hiện tại, các thử nghiệm lâm sàng mới cho thấy lợi ích của bóng phủ thuốc trong điều trị tái hẹp trong stent cũ ĐMV (khuyến cáo IA, theo Hiệp hội Tim mạch châu Âu). Ngoài ra, có thể sử dụng bóng phủ thuốc cho các trường hợp mạch vành kích thước nhỏ, hay tổn thương chỗ chia đôi (nong bóng phủ thuốc nhánh bên để ít làm ảnh hưởng dòng chảy ĐMV ở nhánh chính).
d. Ảnh hưởng của paclitaxel đối với tỉ lệ tử vong
Một phân tích gộp gần đây cho thấy dụng cụ phủ paclitaxel có thể làm tăng tỉ lệ tử vong ở bệnh nhân bệnh động mạch ngoại biên. Tuy nhiên, kết quả từ các nghiên cứu về bóng phủ thuốc cho ĐMV không cho thấy mối quan ngại này, với cả nhóm tái hẹp trong stent hay nhóm tổn thương mới (de novo).
4.4. Bóng cắt (Cutting balloon)
a. Cấu tạo
Bóng cắt (Flextome Balloon, hãng Boston Scientific) có các lưỡi dao dày 0,1–0,4 mm, làm bằng lưỡi thép không gỉ, gắn trên thân bóng. Các dao cắt này được che trong các nếp gấp của bóng để cho phép vận chuyển an toàn tới tổn thương; khi bơm bóng dao cắt được đưa lên bề mặt để thực hiện các vết cắt siêu nhỏ vào mảng xơ vữa. Các vết cắt có kiểm soát không vượt quá toàn bộ bán kính của mảng xơ vữa. Bóng có chiều dài 6, 10 và 15 mm và đường kính từ 2,0 đến 4,0 mm.
Với bóng cắt, chỉ cần bơm với áp lực thấp hơn khi so với nong bóng thông thường, do đó về lý thuyết có lợi thế làm giảm tổn thương thành mạch áp và làm giảm tăng sinh lớp áo trong.
 Hình 16.21. Hình ảnh bóng cắt cong được bơm lên, ta có thể nhìn thấy các lưỡi dao nhỏ bám bên mặt ngoài của bóng.
Hình 16.21. Hình ảnh bóng cắt cong được bơm lên, ta có thể nhìn thấy các lưỡi dao nhỏ bám bên mặt ngoài của bóng.b. Chỉ định và chống chỉ định
Sử dụng bóng cắt một cách thường quy cho mọi tổn thương mạch vành không được ủng hộ trong các khuyến cáo gần đây. Bóng cắt đặc biệt bất lợi với các mạch máu gập góc nhiều, kích thước nhỏ hơn 2,5 mm, tồn thương dài quá 20 mm, và các trường hợp CTO.
Hiện nay, chỉ định dùng bóng cắt trong các trường hợp tái hẹp trong stent hoặc tổn thương chỗ chia đôi. Với tổn thương chỗ chia đôi, nong bóng thông thường có thể gây dịch chuyển mảng xơ vữa (plaque shift). Nong bằng bóng cắt với áp lực thấp giúp giảm tỉ lệ này. Ngoài ra, bóng cắt thường được cố định tốt hơn, do đó có thể dùng trong các trường hợp cần căn chỉnh vị trí can thiệp chính xác để không gây ảnh hưởng tới mạch lành, như trường hợp tổn thương lỗ vào ĐMV, hay tái hẹp trong stent.
5. Stent động mạch vành
5.1. Sơ lược lịch sử phát triển
Stent là khung giá đỡ được đặt trong lòng ĐMV, để khắc phục các hạn chế của nong bóng mạch vành đó là lòng mạch co hồi sau nong bóng, hoặc lóc tách ĐMV. Stent đã cải thiện hiệu quả tức thì và dài hạn của thủ thuật, và trở thành biện pháp tiêu chuẩn để tái thông ĐMV.
Ca đặt stent ĐMV đầu tiên do Ulrich Sigwart tiến hành năm 1986, là một trường hợp đặt stent cứu vãn ở một bệnh nhân nữ 50 tuổi có lóc lóc tách ĐMV gây tắc hoàn toàn ĐMV sau nong bóng. Stent sử dụng là stent kim loại trần, loại tự nở (Wallstent). Kể từ đó, stent kim loại trần được sử dụng ngày càng rộng rãi. Tuy nhiên, hạn chế của stent kim loại trần là tỉ lệ tái hẹp cao. Các nghiên cứu đã dẫn đến sự phát triển của công nghệ phủ thuốc trên bề mặt stent, thuốc này sẽ được phóng thích từ polymer vào lòng mạch. Vai trò của thuốc là ức chế sự tăng sinh tế bào cơ trơn thành mạch, do đó giảm hiệu quả tỉ lệ tái hẹp ĐMV. Hiện nay, stent phủ thuốc đã hoàn toàn thay thế stent kim loại trần trong thực hành tim mạch can thiệp.
Những tiến bộ về công nghệ cho phép sản xuất các loại stent với cấu hình nhỏ gọn hơn, vật liệu tốt hơn, dễ đẩy hơn, đã nâng cao tỉ lệ thành công của thủ thuật. Cùng với đó, liệu pháp kháng kết tập tiểu cầu kép (thay vì thuốc chống đông đường uống) đã giảm đáng kể cả tỉ lệ huyết khối gây tắc lại stent lẫn tỉ lệ biến cố xuất huyết.
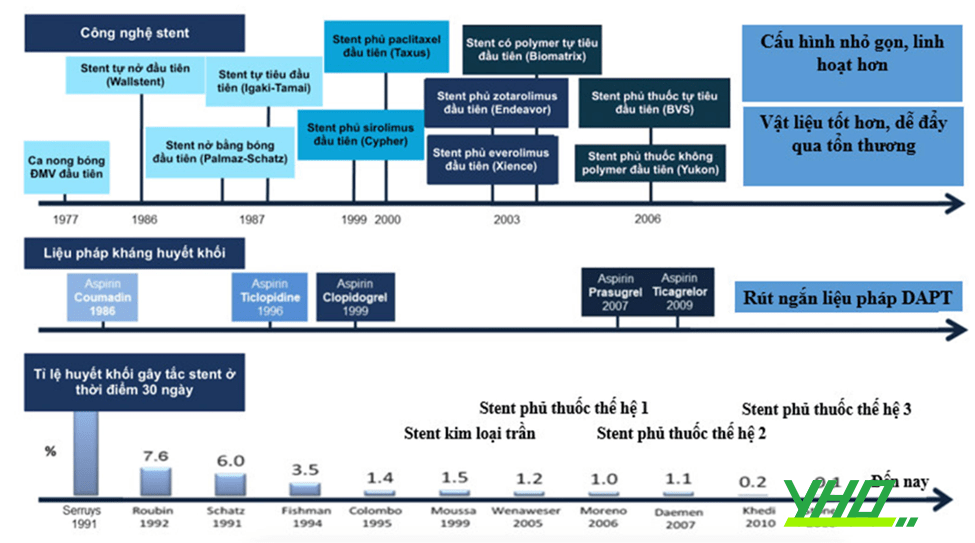 Hình 16.22. Lịch sử phát triển của các loại stent cùng liệu pháp kháng huyết khối sau đặt stent
Hình 16.22. Lịch sử phát triển của các loại stent cùng liệu pháp kháng huyết khối sau đặt stentNhững tiến bộ về công nghệ đều nhằm sản xuất các loại stent tốt hơn. Những đặc tính quan trọng của một stent lý tưởng bao gồm:
- Tính dễ đẩy: Stent cần có cấu hình nhỏ, linh hoạt, để có thể dễ dàng đẩy trong ĐMV và đi qua tổn thương.
- Có lực căng hướng tâm (radial force) tốt để không bị co hồi sau khi đặt vào lòng mạch máu bị hẹp, tắc.
- Có lực căng dọc (longitudinal force) tốt để không bị co ngắn sau khi nở.
- Thành stent được chế tạo bằng vật liệu phù hợp để tránh lớp mô chồi vào trong lòng
Đối với ĐMV tự nhiên, đường kính nở của stent nằm trong khoảng từ 2,25 đến 5 mm. Cầu nối tĩnh mạch hiển có thể có đường kính lớn hơn. Chiều dài của các stent hiện nay thay đổi từ 8 đến 38 mm. Đặc biệt, một số stent dài tới 60 mm với đường kính thuôn dần để phù hợp với giải phẫu mạch máu.
5.2. Cơ chế hoạt động của stent
Có hai cơ chế hoạt động của stent: nở bằng bóng và tự nở. Gần như tất cả các stent mạch vành đều nở bằng bóng. Chúng được đặt lồng vào bóng, đưa đến tổn thương và sau đó bơm bóng làm nở stent. Stent tự nở thường được dùng trong can thiệp bệnh mạch máu ngoại biên. Chúng được nén lại trong lớp vỏ ngoài, khi hệ thống được đưa đến tổn thương, lớp vỏ ngoài được kéo lại và stent tự bung ra.
5.3. Cấu tạo của stent
Các stent hiện tại khác nhau về vật liệu kim loại, thiết kế mắt stent, độ dày stent, và lớp phủ ngoài. Những đặc tính này sẽ quyết định tính dễ đẩy, độ cản quang, cũng như sự tương thích của stent với tổn thương ĐMV, vì thế ảnh hưởng đến tỉ lệ thành công và độ an toàn của thủ thuật.
a. Vật liệu chế tạo
Trước kia, vật liệu phổ biến nhất để chế tạo stent là thép không gỉ, với ưu điểm nổi trội là lực căng hướng tâm mạnh, nhờ đó tỉ lệ co hồi mạch máu thấp (< 5%). Tuy nhiên stent bằng thép không gỉ ít cản quang, kém linh hoạt, cũng như hàm lượng nickel cao trong hợp kim có thể làm tăng tỉ lệ tái hẹp do phản ứng dị ứng. Ngày nay, vật liệu cobalt-chrome đã thay thế thép không gỉ để chế tạo stent. Cobalt-chrome có lực căng hướng tâm khoẻ hơn, cản quang tốt hơn, cũng như hàm lượng nickel thấp hơn. Với thép không gỉ, dữ liệu nghiên cứu cho thấy thành stent càng mỏng thì tỉ lệ tái hẹp càng thấp. Nhưng điều này không được ghi nhận với stent bằng cobalt-chrome. Tuy vậy, dường như chiều dày stent có thiên hướng liên quan tới sự hình thành huyết khối và làm tăng nguy cơ tắc stent.
Gần đây, hợp kim platinum (bạch kim) bắt đầu được dùng để chế tạo stent. Bạch kim đặc hơn sắt hay cobalt, dễ uốn,
ít bị ăn mòn, khó đứt gãy. Stent bạch kim cản quang tốt và có thành mỏng, lực căng hướng tâm khoẻ hơn stent bằng thép, và tương thích hình dạng mạch máu tốt hơn. Tuy nhiên, mới chỉ có một số loại stent được sản xuất bằng hợp kim này (ví dụ stent Promus Premier hay Synergy của hãng Boston Scientific).
b. Cấu trúc mắt stent
Các loại stent khác nhau có thiết kế khác nhau (dạng ống hay dạng cuộn, mắt mở hay mắt đóng, số lượng mắt stent, hình dạng mắt stent). Hiện nay, đa số stent có thiết kế dạng ống có mắt lưới thay vì dạng vòng cuộn.
Với stent mắt đóng, toàn bộ các mắt lưới cạnh nhau được liên kết với nhau, vì thế lực căng hướng tâm khoẻ hơn, và hạn chế tình trạng mảng xơ vữa trồi vào lòng mạch. Kích cỡ các mắt lưới không thay đổi khi bơm căng bóng làm nở stent, do chúng đã được gắn chặt với nhau. Nhược điểm của stent mắt đóng là kém linh hoạt, khó đi vào một số tổn thương gập góc hay vôi hoá.
Với stent mắt mở, một số mắt lưới không gắn với nhau, do đó stent linh hoạt hơn, tương thích tốt hơn với giải phẫu mạch máu, cũng như hạn chế vật liệu kim loại che phủ lòng mạch. Hạn chế của stent mắt mở bao gồm: lực căng hướng tâm yếu hơn, kích cỡ mắt lưới có thể bị biến dạng nếu đặt stent ở đoạn mạch xoắn vặn. Hiện nay, đa số stent có thiết kế mắt mở, cân bằng các yếu tố như tính dễ đẩy, lực căng hướng tâm, cũng như khả năng tương thích mạch máu.
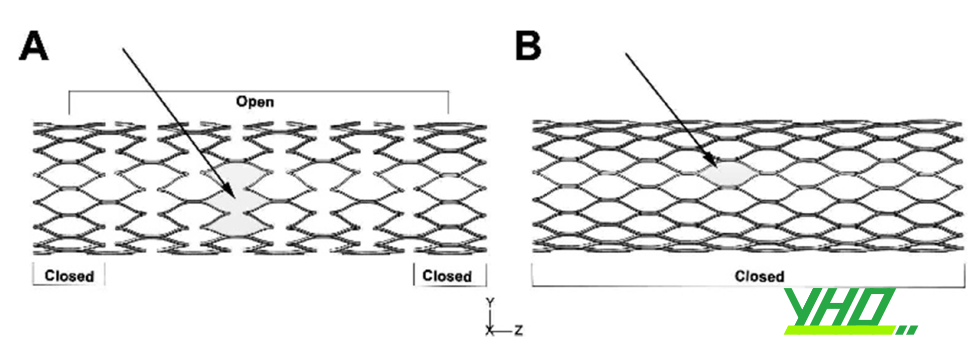 Hình 16.23. Stent mắt mở (A) và mắt đóng (B)
Hình 16.23. Stent mắt mở (A) và mắt đóng (B)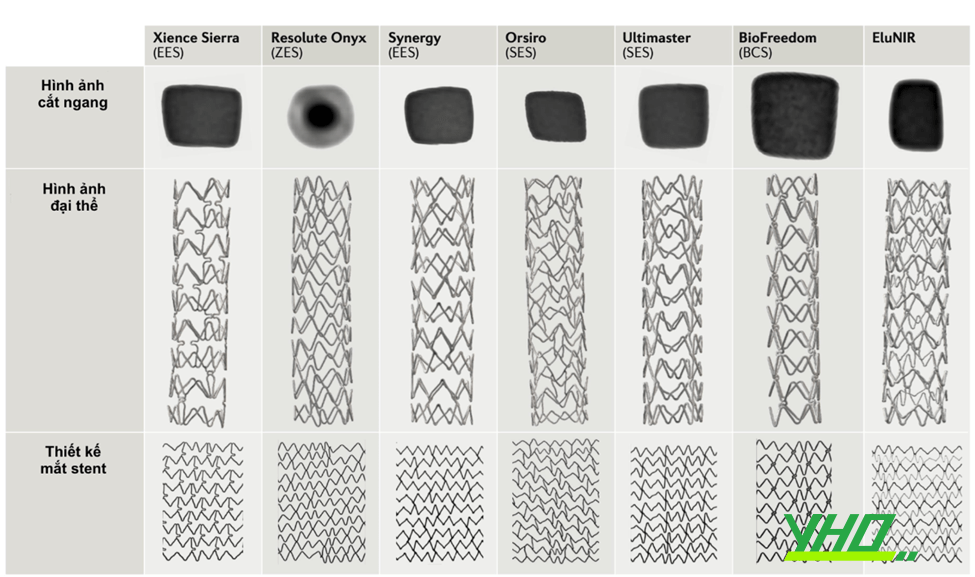 Hình 16.24. Cấu trúc và hình thái mắt stent của một số loại stent thông dụng hiện nay.
Hình 16.24. Cấu trúc và hình thái mắt stent của một số loại stent thông dụng hiện nay.5.4. Stent phủ thuốc
Stent kim loại trần hiện nay đã được thay thế bằng stent phủ thuốc. Stent phủ thuốc có khung kim loại tương tự khung stent kim loại trần. Tuy nhiên, nó có thêm hai thành phần phủ bên ngoài: lớp polymer và hoạt chất chống tăng sinh. Cùng với tiến bộ về công nghệ thuốc, thiết kế hình học của stent cũng đóng vai trò quan trọng để có thể lưu giữ hàm lượng thuốc đầy đủ, cũng như giải phóng thuốc vào mô tối ưu. Cấu trúc mắt lưới càng dày, nồng độ thuốc tiếp xúc với thành mạch càng cao.
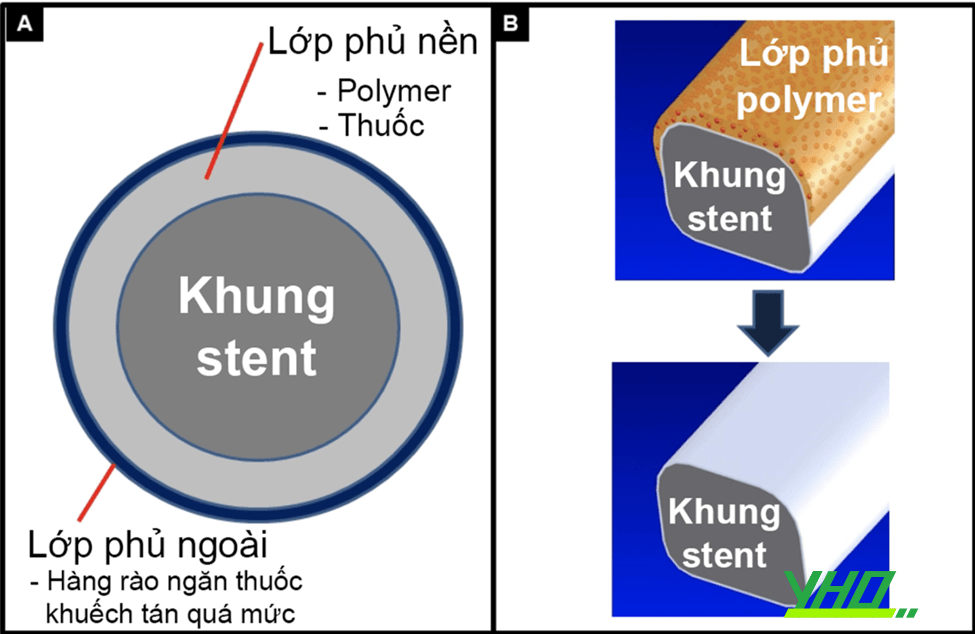 Hình 16.25. Cấu trúc stent phủ thuốc. A: Polymer và thuốc được bao quanh chu vi của stent, B: Lớp polymer tự tiêu chỉ phủ phần stent áp sát thành mạch máu.
Hình 16.25. Cấu trúc stent phủ thuốc. A: Polymer và thuốc được bao quanh chu vi của stent, B: Lớp polymer tự tiêu chỉ phủ phần stent áp sát thành mạch máu.a. Hoạt chất chống tăng sinh
Hoạt chất sử dụng trong các loại stent phủ thuốc có tác dụng hạn chế sự tăng sinh nội mạc. Một hoạt chất chống tăng sinh lý tưởng sẽ có các đặc tính dưới đây:
- Cửa sổ điều trị rộng.
- Ít gây phản ứng viêm.
- Ức chế chọn lọc tăng sinh lớp tế bào cơ trơn nội mô, không gây ảnh hưởng tới tế bào lớp áo giữa và lớp áo ngoài.
- Kích thích quá trình nội mạc hoá.
Hiệu quả của thuốc không chỉ phụ thuộc vào các hoạt tính sinh học trong phòng thí nghiệm, mà còn chịu ảnh hưởng bởi đặc điểm dược lực học và sinh hoá khi sử dụng trong cơ thể người bệnh. Các thuốc có đặc tính ưa nước như hep- arin có thể dễ dàng ngấm vào mô, tuy nhiên lại thải trừ nhanh. Ngược lại, những hoạt chất ưa mỡ như paclitaxel hay limus sẽ không tan trong nước và gắn với những vùng kỵ nước trên thành mạch máu, nhờ đó có thể phân bố và ngấm vào thành mạch đồng đều hơn.
Do đó, các chất ức chế miễn dịch (dòng limus) và chống tăng sinh (paclitaxel) được sử dụng (Hình 16.26). Gần đây, việc phối hợp sirolimus (phủ ở mặt tiếp xúc thành mạch) với kháng thể kháng CD34 (phủ ở mặt tiếp xúc lòng mạch máu) cho thấy triển vọng ức chế tăng sinh lớp nội mô tốt đồng thời vẫn kích thích quá trình nội mạc hoá mạch máu (stent Combo, hãng Orbus Neich).
 Hình 16.26. Cơ chế tác dụng của sirolimus và paclitaxel
Hình 16.26. Cơ chế tác dụng của sirolimus và paclitaxelLimus và các hoạt chất tương tự
 Hình 16.27. Thế hệ stent phủ thuốc (DES) thứ nhất phủ hoạt chất chống tăng sinh
Hình 16.27. Thế hệ stent phủ thuốc (DES) thứ nhất phủ hoạt chất chống tăng sinhSirolimus
Sirolimus là thuốc có đặc tính ưa mỡ cao, và là thế hệ đầu tiên của dòng limus. Stent sử dụng sirolimus tiêu biểu là stent Cypher (hãng Cordis).
Đây là hoạt chất được sử dụng phổ biến nhất trong các stent phủ thuốc hiện nay. Các hoạt chất chính bao gồm sirolimus, zotarolimus, everolimus, biolimus-A9, novolimus. Những thuốc này gắn với thụ thể FKBP-12 nội bào và ức chế enzyme phosphoinositide 3-kinase, vì thế ức chế pha G của quá trình phân bào. Tế bào cơ trơn thành mạch có tỉ lệ tăng sinh thấp, và thường nằm ở pha G, do đó là đối tượng tác dụng của thuốc.
Everolimus
Everolimus là dẫn chất của sirolimus, trong đó nhóm hydroxyl gắn ở vị trí nguyên tử carbon số 40 (C40) được kiềm hoá. Vì thế, everolimus ưa mỡ hơn sirolimus, và được hấp phụ vào thành mạch nhanh hơn. Mặc dù khả năng gắn với FKBP-12 cũng như tác dụng ức chế miễn dịch của everolimus kém hơn sirolimus, thử nghiệm cho thấy hiệu quả chung của hai thuốc này tương tự nhau. Ngoài ra, stent phủ everolimus cũng ít gây phản ứng viêm hơn stent phủ sirolimus hay paclitaxel. Stent tiêu biểu của nhóm này là Xience (hãng Abbott).
Zotarolimus
Được dùng trong stent Endeavor (hãng Medtronic). Về công thức hoá học, nhóm hydroxyl ở vị trí C40 được thay thế bằng vòng tetrazole, vì vậy rút ngắn thời gian bán huỷ của thuốc. Khác với stent Cypher phóng thích 80% lượng sirolimus trong vòng 30 ngày, stent Endeavor phóng thích lượng tương đương zotarolimus trong vòng 10 ngày.
Biolimus-A9
Đây là hoạt chất có tính ưa mỡ cao, với gốc alkoxy-alkyl thay thế nguyên tử hydro ở vị trí gắn với nguyên tử oxy số 42. Biolimus được hoà tan vào một loại polymer tự tiêu (polyactic acid, PLA), với hàng lượng 15,6mg/cm2. Polymer này chỉ tráng ở một mặt của khung stent (mặt không tiếp xúc lòng mạch máu). Thực nghiệm cho thấy, PLA được chuyển hoá hoàn toàn thành acid lactic trong vòng 6 tháng, và polymer sẽ tiêu hoàn toàn sau 9 tháng. Biolimus-A9 được sử dụng trong một số loại stent: Biomatrix (hãng Biosensors), Nobori (hãng Terumo), Axxess (stent chuyên dụng cho tổn thương chỗ chia đôi, hãng Biosensors).
Novolimus
Novolimus là hợp chất hình thành sau khi lấy đi nhóm methyl ở vị trí gắn với nguyên tử carbon số 16 (C16). Stent sử dụng novolimus là Elixir DESyne (hãng Elixir Medical). Loại polymer sử dụng cũng là PLA tự tiêu. Polymer này sẽ giải phóng novolimus một cách có kiểm soát. 80% lượng thuốc được phóng thích trong vòng 12 tuần, và toàn bộ thuốc được giải phóng trong vòng 6 tháng.
Paclitaxel
Paclitaxel ức chế quá trình phân bào ở pha G0/G1 và G2/M, vì thế ức chế tăng sinh lớp cơ trơn thành mạch. Ngoài ra, paclitaxel còn có một số đặc tính phù hợp với stent phủ thuốc như tính ưa mỡ cao, hiệu quả kéo dài dù với liều thấp. Tuy nhiên, điểm bất lợi của paclitaxel là gây ảnh hưởng cả các mô kế cận, vì thế làm mỏng lớp áo giữa của thành động mạch, dẫn tới chảy máu lớp nội mô và lớp áo giữa, cũng như gây hoại tử tế bào. Loại stent phủ paclitaxel thông dụng nhất là Taxus Express và Taxus Liberte của hãng Boston Scientific. Đây là các stent phủ thuốc thế hệ đầu tiên. Hiện nay, paclitaxel chủ yếu được sử dụng trong công nghệ bóng phủ thuốc.
b. Polymer
Tiến bộ trong công nghệ sản xuất polymer
Polymer là một thành phần quan trọng của stent phủ thuốc. Vai trò của polymer là lưu giữ thuốc và giải phóng thuốc vào thành mạch qua tiếp xúc trực tiếp. Thuốc được bảo quản phía trong lớp màng của polymer, hoặc hoà tan vào phức hợp polymer. Phát triển công nghệ thuốc không thể bỏ qua công nghệ sản xuất polymer vì hai thành phần này có liên quan chặt chẽ với nhau. Một số stent phủ thuốc ngày nay có thêm lớp phủ ngoài để làm thuốc phóng thích chậm (ví dụ PBMA), và lớp phủ trong để tăng cường sự bám dính của polymer vào khung stent (ví dụ Parylene C).
Nhược điểm lớn nhất của polymer là gây kích ứng phản ứng viêm và hình thành huyết khối, hệ quả là tăng sinh thành mạch và tắc stent. Một nguyên nhân gây phản ứng viêm là trọng lượng phân tử lớn của polymer, cũng như dung môi và các sản phẩm phụ của chất xúc tác trong quá trình sản xuất. Đây là một phần lý do khiến stent phủ thuốc thế hệ đầu (Cypher và Taxus) có tỉ lệ huyết khối cao, và cần dùng thuốc kháng kết tập tiểu cầu kéo dài.
Các stent phủ thuốc thế hệ hai, như Xience (hãng Abbott), Promus Element (hãng Boston Scientific), Resolute Integrity và Resolute Onyx (hãng Medtronic), sử dụng polymer có độ tương thích sinh học tốt hơn, một số loại polymer hoàn toàn không gây phản ứng viêm. Các stent Xience và Promus còn được tráng phủ lớp poly vinylidene fluoride-co-hexafluoropropylene (PVDF-HFP) có vai trò ức chế kết dính tiểu cầu. Stent Orsiro (hãng Biotronik) có cấu tạo khung stent mỏng 60 μm đến 80 μm, giúp stent linh hoạt, dễ đẩy qua các tổn thương, đồng thời tạo thuận lợi cho nội mạc bao phủ nhanh chóng.
Thêm vào đó, một số stent như Biomatrix hay Nobori chỉ tráng polymer ở phần tiếp xúc thành mạch của stent (Hình 16.28), nhờ vậy ít cản trở quá trình nội mạc hoá.
Một giải pháp khác để phóng thích thuốc là dùng tia laze tạo ra các lỗ nhỏ trên khung stent, như các hồ chứa. Polymer và thuốc được lưu giữ trong những hồ chứa đó, vì thế đây còn được gọi là “công nghệ hồ chứa” (Reservoir Technology, RES). Về lý thuyết, công nghệ này giảm sự tiếp xúc trực tiếp của polymer với bề mặt mô, trong khi vẫn cho phép thuốc được giải phóng. Đáng tiếc là mặc dù có một số kết quả hứa hẹn, công nghệ này đang tạm bị ngừng lại do tăng tỉ lệ rơi và di lệch stent.
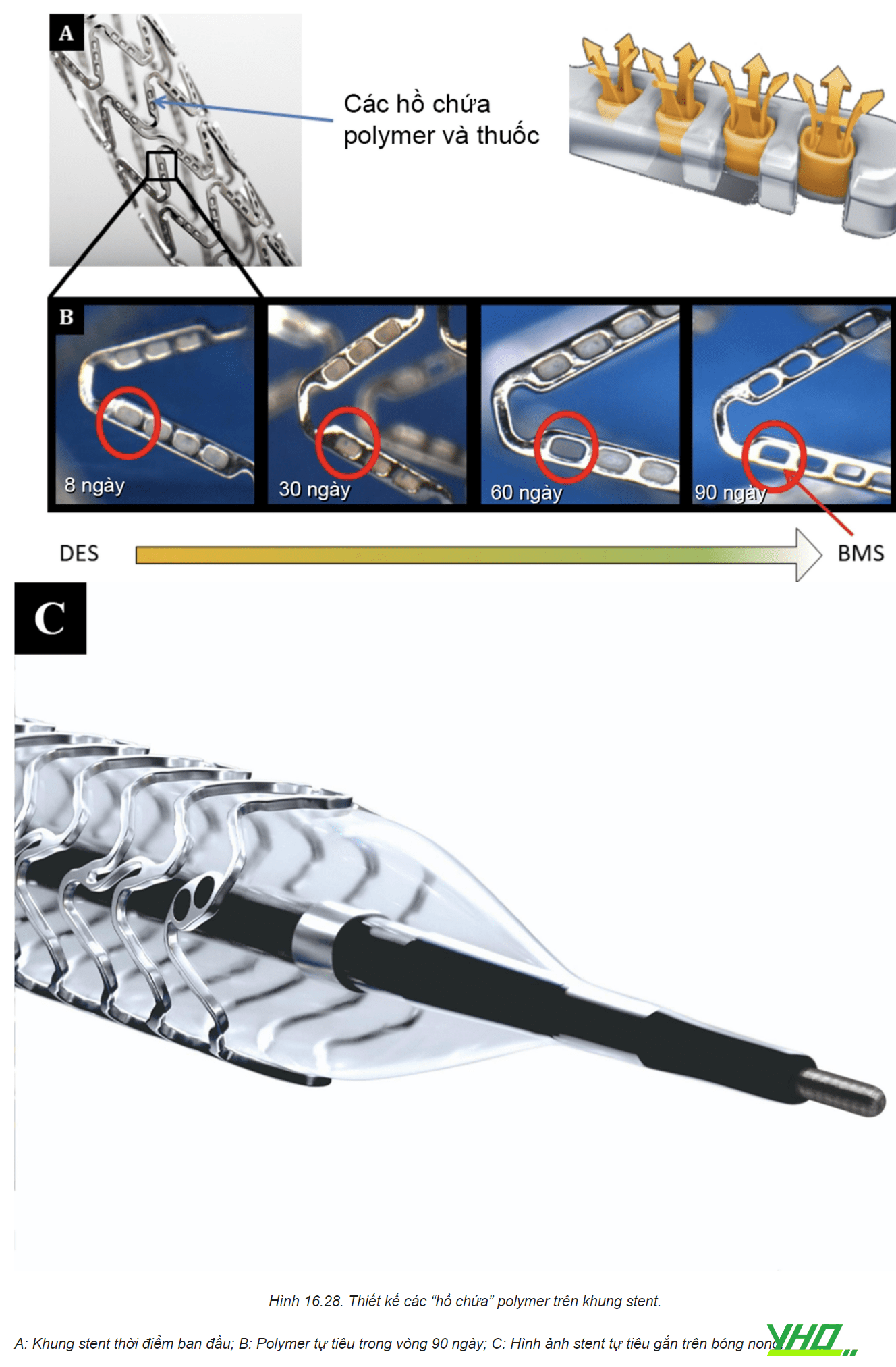 Hình 16.28. Thiết kế các “hồ chứa” polymer trên khung stent.
Hình 16.28. Thiết kế các “hồ chứa” polymer trên khung stent.Stent dùng polymer tự tiêu
Ban đầu, các loại polymer vĩnh cửu chiếm ưu thế. Nhưng những stent thế hệ mới gần đây đã chuyển sang dùng polymer sinh học tự tiêu. Ưu điểm của polymer tự tiêu là giảm phản ứng viêm, nhờ đó kích thích quá trình nội mạc hoá và giảm tỉ lệ huyết khối gây tắc stent. Các stent dùng polymer tự tiêu thường không đòi hỏi dùng kháng tiểu cầu kép kéo dài. Cùng với việc phân huỷ sinh học các polymer, thuốc cũng được giải phóng trọn vẹn vào thành mạch.
Các loại polymer tự tiêu hiện tại là polylactic acid (PLA), polyglycolide (PLGA). Cùng với thời gian, những polymer này sẽ được giáng hoá thành monomer, nước, và CO2.
Stent phủ thuốc không polymer
Hiện nay có một số loại stent phủ thuốc không dùng polymer, do đó giảm thiểu thời gian dùng thuốc chống ngưng kết tiểu cầu. Các stent này được chỉ định trong trường hợp can thiệp cho bệnh nhân nguy cơ chảy máu cao, hoặc sắp sửa tiến hành phẫu thuật ngoài tim. Một số nghiên cứu bước đầu cho thấy hiệu quả và tính an toàn của stent loại này không kém hơn stent dùng polymer vĩnh cửu.
c. Một số loại stent phủ thuốc thường sử dụng
Stent phủ thuốc thế hệ đầu:
- Stent phủ sirolimus: Cypher (hãng Cordis)
- Stent phủ paclitaxel: Taxus (hãng Boston Scientific)
Stent phủ thuốc thế hệ thứ hai
- Stent dùng polymer vĩnh cửu
- Stent phủ everolimus:
- Xience V, Xience Prime (hãng Abbott)
- Promus Element (hãng Boston Scientific)
- Stent phủ everolimus:
- Stent phủ zotarolimus: Endeavor, Resolute, Onyx (hãng Medtronic)
- Stent phủ novolimus: Elixir DESyne (hãng Elixir Medical)
- Stent dùng polymer tự tiêu
- Stent phủ biolimus-A9:
- Biomatrix (hãng Biosensors)
- Nobori (hãng Terumo)
- Stent phủ biolimus-A9:
- Stent phủ novolimus: Elixir DESyne BD (hãng Elixir Medical)
- Stent phủ everolimus: Synergy (hãng Boston Scientific)
- Stent phủ sirolimus:
- NEVO (hãng Cordis)
- Orsiro (hãng Biotronik)
- Ultimaster (hãng Terumo)
- Combo (hãng Orbus Neich)
- Stent không polymer
- Stent phủ sirolimus:
- Yukon (hãng Translumina): đây là stent phủ thuốc không polymer đầu tiên
- Cre8 (hãng CID)
- Stent phủ sirolimus:
- Stent phủ biolimus-A9: BioFreedom (hãng Biosensors)
- Stent phủ paclitaxel: Amazonia Pax (hãng Minvasys)
Đặc điểm của các stent phủ thuốc các thế hệ được trình bày trong hình dưới.
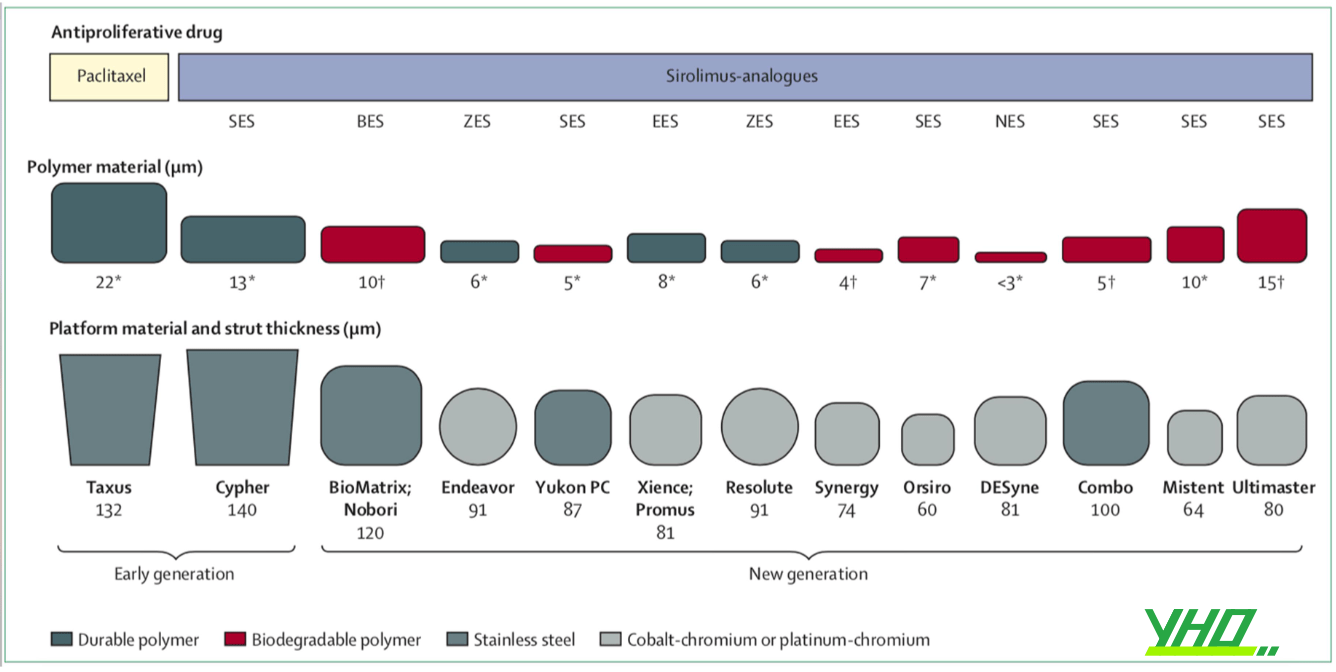 Hình 16.29. Đặc điểm cấu tạo của stent phủ thuốc (DES) các thế hệ
Hình 16.29. Đặc điểm cấu tạo của stent phủ thuốc (DES) các thế hệ5.5. Một số loại stent chuyên dụng
a. Covered stent (Stent có màng bọc)
Các stent có lớp màng PTFE ban đầu được sử dụng trong can thiệp cầu nối tĩnh mạch hiển, tuy nhiên các kết quả nghiên cứu cho thấy chúng không cải thiện tỉ lệ tái hẹp cũng như biến cố tim mạch, so sánh với stent kim loại trần. Hiện nay, stent có màng bọc được dùng để cấp cứu trong trường hợp thủng, vỡ ĐMV.
Stent có màng bọc thường có cấu hình lớn và rất cứng, vì thế đẩy không dễ dàng. Chúng cũng có tỉ lệ biến cố (tái hẹp, tắc stent) cao hơn các stent phủ thuốc thông thường, do làm chậm quá trình nội mạc hoá và kích thích hình thành huyết khối. Một nghiên cứu cho thấy tỉ lệ huyết khối stent bán cấp trong vòng 6 tháng của stent có màng bọc là 5,7%, tỉ lệ tái hẹp sau 6 tháng là 31,6%.
Gần đây, PTFE đã được thay thế bằng màng ngoài tim ngựa (stent Aneugraft). Stent này chỉ có một khung mỏng bằng thép không gỉ, với một lớp màng duy nhất bên ngoài, giúp cấu hình stent nhỏ gọn hơn và dễ đẩy trong lòng ĐMV hơn, cũng như kích thích quá trình nội mạc hoá nhanh hơn.
 Hình 16.30. Covered stent (stent có màng bọc)
Hình 16.30. Covered stent (stent có màng bọc)b. Stent đặt tại chỗ phân nhánh
Đây là các loại stent tự nở làm bằng vật liệu nitinol, cho phép stent bung ra phù hợp với góc giải phẫu của nhánh ĐMV tổn thương (Xin xem thêm Chương 19. Can thiệp tổn thương chỗ chia đôi động mạch vành).
 Hình 16.31. Các stent chuyên dụng dành cho tổn thương chỗ phân nhánh.
Hình 16.31. Các stent chuyên dụng dành cho tổn thương chỗ phân nhánh.A: Axxess, B: Sideguard, D: Stentys
5.6. Chụp cộng hưởng từ sau khi đặt stent
Không nên chụp cộng hưởng từ cho đến khi stent được nội mạc hóa (> 4 tuần). Nguy cơ từ trường mạnh làm di chuyển stent rất thấp nhưng stent có thể gây nhiễu ảnh, tuy nhiên đa số bệnh nhân vẫn có thể chụp cộng hưởng từ.
6. Bộ bơm áp lực thường đi kèm khoá chữ Y và dụng cụ hỗ trợ đẩy và lái dây dẫn.
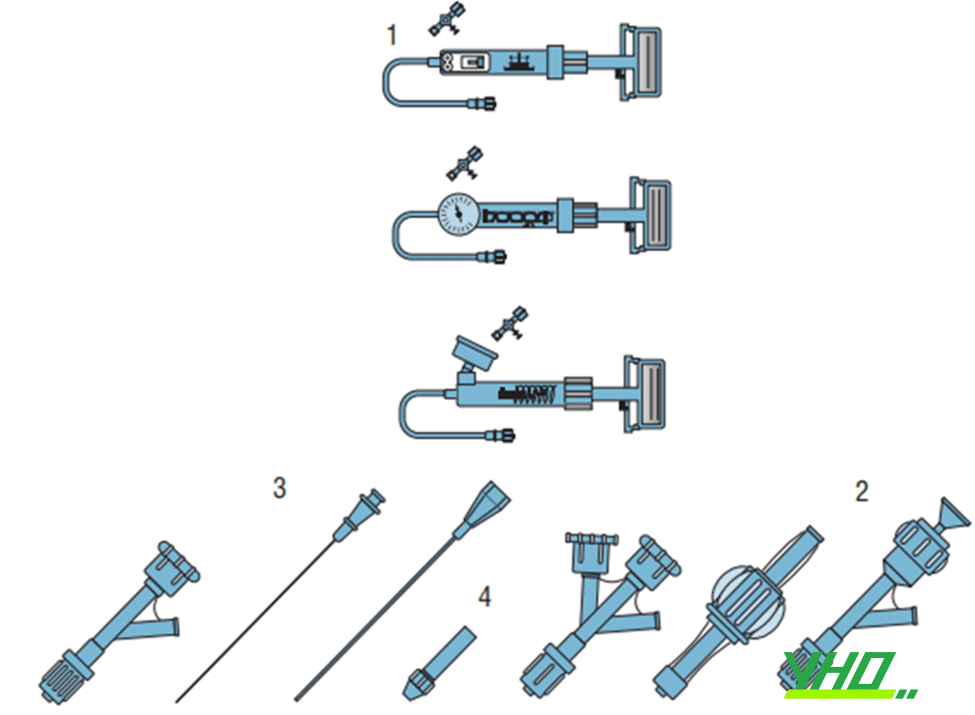 Hình 16.32. Các thiết bị hỗ trợ can thiệp ĐMV. (1) Bơm áp lực, (2) Kết nối chữ Y, (3) Introducer để đưa dây dẫn vào guiding, (4) Dụng cụ để lái dây dẫn (torque).
Hình 16.32. Các thiết bị hỗ trợ can thiệp ĐMV. (1) Bơm áp lực, (2) Kết nối chữ Y, (3) Introducer để đưa dây dẫn vào guiding, (4) Dụng cụ để lái dây dẫn (torque). Hình 16.33. Một bộ bơm áp lực, khóa chữ Y, và thiết bị lái dây dẫn
Hình 16.33. Một bộ bơm áp lực, khóa chữ Y, và thiết bị lái dây dẫn6.1. Đầu nối chữ Y
Khác với chụp ĐMV, khi can thiệp ĐMV ta cần hai đường tiếp cận guiding: một đường để theo dõi áp lực và bơm thuốc cản quang, một đường để đẩy dụng cụ (dây dẫn, bóng, stent) vào trong lòng guiding và ĐMV. Đầu nối chữ Y gắn vào guiding cho phép giải quyết vấn đề đó.
Tận cùng của đầu nối chữ Y có van, đảm bảo hạn chế chảy máu ngược từ guiding khi dụng cụ được đưa vào hoặc rút ra. Các van này được mở và đóng bằng cách xoay hoặc đẩy, tuỳ theo nhà sản xuất.
6.2. Bơm áp lực
Để bơm bóng hoặc stent, cần sử dụng bơm áp lực. Bơm căng bóng hoặc stent bằng thuốc cản quang (pha với nước theo tỉ lệ 1:1, do thuốc cản quang quá đặc thì bơm căng bóng sẽ chậm, trong khi cản quang quá loãng sẽ khó quan sát trên màng tăng sáng). Sau khi lấy thuốc cản quang vào bơm, bơm được kết nối với bóng hoặc stent. Trên bơm có đồng hồ đo áp lực (biểu diễn bằng đơn vị atm hoặc PSI).
Nói chung, các loại bơm áp lực hiện hành đều có thể sử dụng cho đa số các ca can thiệp ĐMV. Một số đặc tính của bơm áp lực bao gồm:
- Áp lực tối đa có thể sử dụng: Đa phần trường hợp ca thiệp ĐMV chỉ cần áp lực tối đa 22-24 atm. Tuy nhiên một số tổn thương đặc biệt cần áp lực cao hơn (26-28 atm).
- Tốc độ bơm bóng: Những loại bơm áp lực có thể làm căng bóng nhanh sẽ hữu dụng trong can thiệp thân chung ĐMV trái, khi thời gian bơm bóng (đồng nghĩa không có tưới máu ĐMV) cần được giảm thiểu.
6.3. Dụng cụ lái dây dẫn
Khi đẩy dây dẫn qua khoá chữ Y vào trong guiding, đầu dây có thể bị gập hoặc hỏng. Vì vậy, cần đẩy dây dẫn qua một ống nhỏ, gọi là introducer. Ống thiết kế bằng kim loại giống như một kim tiêm nhưng đầu bằng không nhọn và lòng vừa với dây dẫn can thiệp, đảm bảo dây dẫn đi qua được van cầm máu, không gây chảy máu và giúp lái dây dẫn dễ dàng không bị lực cản bởi van cầm máu. Khi đã đưa dây dẫn qua tổn thương, rút introducer ra và đẩy bóng và stent vào. Để điều hướng và lái dây dẫn, bác sĩ can thiệp sử dụng một thiết bị nhỏ, gọi là torque. Torque được kẹp vào dây dẫn. Khi thầy thuốc xoay torque, sẽ đồng thời xoay dây dẫn.
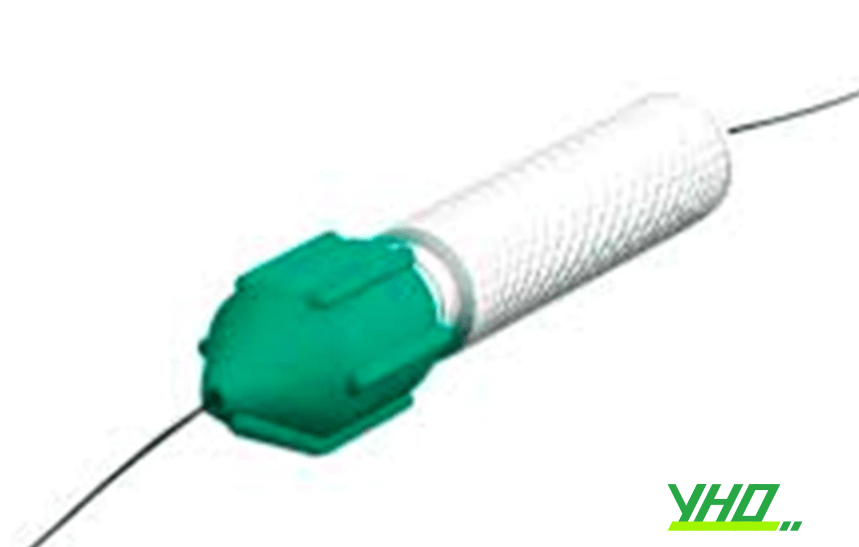 Hình 16.34. Torque sử dụng để lái dây dẫn
Hình 16.34. Torque sử dụng để lái dây dẫn7. TỔNG KẾT
Kể từ ca can thiệp ĐMV đầu tiên với những thiết bị tương đối “thô sơ”, những tiến bộ về công nghệ sản xuất dụng cụ giờ đây đem lại rất nhiều lựa chọn cho thầy thuốc. Các thiết bị mới không chỉ nhỏ gọn và an toàn hơn, mà còn được thiết kế phù hợp với nhu cầu thực tế, cho phép tiếp cận và điều trị tổn thương một cách tối ưu nhất. Nhờ vậy tỉ lệ thành công cũng như hiệu quả dài hạn của thủ thuật can thiệp ĐMV được cải thiện đáng kể. Chỉ định can thiệp mạch vành ngày càng mở rộng. Nhiều tổn thương trước kia không thể tiến hành tái thông nội mạch, như tổn thương CTO, tổn thương vôi hoá phức tạp, giờ đây không còn là thách thức không thể vượt qua.
Tuy nhiên, không gì có thể thay thế khối óc và đôi tay của người thầy thuốc. Bất cứ thiết bị nào, dù ưu việt tới đâu, vẫn đòi hỏi thao tác thận trọng, khéo léo, và tỉ mỉ. Bên cạnh đó, bác sĩ tim mạch can thiệp cần có hiểu biết sâu sắc và đầy đủ về những dụng cụ trong phòng can thiệp, như vị tướng ra trận cần nắm vững ưu, nhược điểm của những“vũ khí” mình có trong tay. Không ca can thiệp ĐMV nào giống nhau, sự đa dạng về đặc điểm giải phẫu hệ ĐMV cũng như đặc điểm tổn thương đòi hỏi sự linh hoạt của bác sĩ can thiệp trong việc lựa chọn dụng cụ phù hợp nhất, để thủ thuật có thể diễn ra thuận lợi và an toàn, mang lại lợi ích lớn nhất cho người bệnh.
TÀI LIỆU THAM KHẢO
- Cardiology, S.o., The ESC Textbook of Cardiovascular Imaging. 3 ed. 2021: Oxford University Press.
- Textbook of Catheter-Based Cardiovascular Interventions, https://doi.org/10.1007/978-3-319-55994-0_48
- FACC MJKMMF, MD MJL, FSCAI The Interventional Cardiac Catheterization Handbook. 4th edition. Elsevier; 2017.
- Mahmoudi M, Delhaye C, Wakabayashi K, et al. Outcomes after unrestricted use of everolimus-eluting stent compared to paclitaxel- and sirolimus-eluting stents. Am J Cardiol. 2011;107(12):1757-1762. doi:10.1016/j.amjcard.2011.02.330
- McKavanagh P, Zawadowski G, Ahmed N, Kutryk M. The evolution of coronary stents. Expert Rev Cardiovasc 2018;16(3):219-228.
- Hu H, Shen Drug-coated balloons in the treatment of acute myocardial infarction (Review). Exp Ther Med. 2021;21(5):464. doi:10.3892/ etm.2021.9895.
- Kalra A, Rehman H, Khera S, et New-Generation Coronary Stents: Current Data and Future Directions. Curr Atheroscler Rep. 2017;19(3):14
- Lee MS, Singh V, Nero TJ, Wilentz Cutting balloon angioplasty. J Invasive Cardiol. 2002;14(9):552-556.
- Ishihara T, Iida O, Takahara M, et al. Improved crossability with novel cutting balloon versus scoring balloon in the treatment of calcified lesion. Cardiovasc Interv 2021;36(2):198-207. doi:10.1007/s12928-020-00663-5.
- Misumi [Overview of clinical use of Rotablator]. Nihon Rinsho Jpn J Clin Med. 2011;69 Suppl 7:295-303.
- Lasala JM, Reisman M. Rotablator plus stent therapy (rotastent). Curr Opin Cardiol. 1998;13(4):240-247. doi:10.1097/ 00001573-199807000-00004.
- Han X, Duan S, Liu S, et al. [Development of Thrombus Aspiration Catheter]. Zhongguo Yi Liao Qi Xie Za Zhi. 2019;43(2):106-108.
- Chhabra L, Zain MA, Siddiqui Coronary Stents. In: StatPearls. StatPearls Publishing; 2022. Accessed June 26, 2022. http://www.ncbi.nlm.nih.gov/books/NBK507804/.
- Guelker JE, Blockhaus C, Kroeger K, Wehner R, Klues H, Bufe A. The GuideLiner catheter: A supportive tool in percutaneous coronary intervention of chronic total occlusion. J Saudi Heart Assoc. 2018;30(2):69-74. doi:10.1016/j.jsha.2017.09.001.