Can thiệp trong hội chứng vành cấp
1. TỔNG QUAN VỀ HỘI CHỨNG VÀNH CẤP
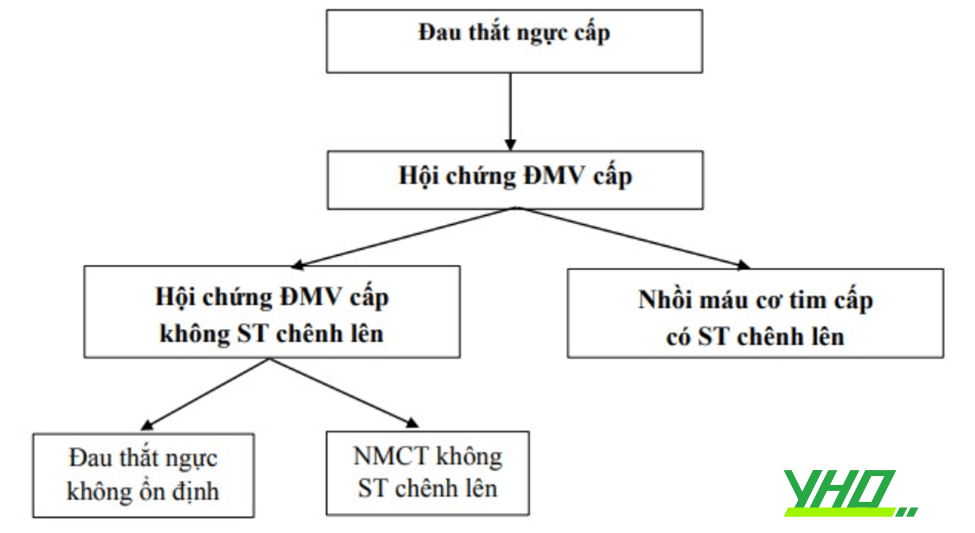
Hội chứng vành cấp (Acute coronary syndrome – ACS) hay gọi đầy đủ là Hội chứng động mạch vành cấp (Hội chứng ĐMV cấp) đề cập đến một loạt các biểu hiện lâm sàng đa dạng, từ nhồi máu cơ tim (NMCT) có ST chênh lên, tới hội chứng vành cấp không có ST chênh lên (Nhồi máu cơ tim không ST chênh lên và đau thắt ngực không ổn định). Hội chứng vành cấp hầu như liên quan tới nứt vỡ mảng xơ vữa, gây huyết khối hoàn toàn hoặc một phần lòng mạch vành.
 Hình 18.1. Hội chứng vành cấp và các thể bệnh trên lâm sàng
Hình 18.1. Hội chứng vành cấp và các thể bệnh trên lâm sàngBiểu hiện lâm sàng của hội chứng vành cấp thay đổi đa dạng từ ngừng tuần hoàn, rối loạn điện học, huyết động không ổn định như sốc tim do thiếu máu cục bộ tiến triển hoặc biến cố cơ học (hở van 2 lá cấp, thủng vách liên thất,…) cho tới những bệnh nhân đã hoàn toàn không còn đau ngực ở thời điểm nhập viện.
Triệu chứng hàng đầu là tình trạng đau ngực cấp tính được mô tả kiểu nặng tức, đè nén, bó chặt, bỏng rát. Các triệu chứng có ý nghĩa tương tự như khó thở, đau thượng vị. Dựa vào điện tâm đồ, có 2 nhóm bệnh nhân trong hội chứng vành cấp:
- Bệnh nhân nhập viện với đau ngực cấp và đoạn ST chênh lên dai dẳng > 20 phút → Nhồi máu cơ tim ST chênh lên (STEMI) do tắc nghẽn hoàn toàn động mạch vành. Điều trị nền tảng là tái thông mạch vành bằng can thiệp mạch vành qua da hoặc phẫu thuật bắc cầu chủ vành hoặc tiêu sợi huyết.
- Bệnh nhân nhập viện với đau ngực cấp nhưng không có đoạn ST chênh lên kéo dài (NSTE-ACS). Thay đổi ST-T có thể bao gồm: ST chênh lên thoáng qua, ST chênh xuống thoáng qua hoặc kéo dài, sóng T âm, dẹt hoặc điện tâm đồ hoàn toàn bình thường.
Với bệnh nhân đau ngực nhập viện, chúng ta cần đánh giá dựa trên các đặc điểm nguy cơ cao/thấp tùy theo bệnh cảnh lâm sàng (triệu chứng, dấu hiệu sinh tồn,…), điện tim đồ 12 chuyển đạo và nồng độ troponin T. Và hướng dẫn của ESC 2020 về hội chứng vành cấp khuyến cáo sử dụng phác đồ Troponin độ nhạy cao bằng phác đồ 0/1 giờ (ưu tiên) hoặc phác đồ 0/3 giờ (lựa chọn thứ 2) trong việc đưa ra quyết định là NMCT hay không NMCT, và trường hợp trung gian cần quan sát thêm có thể là đau ngực không ổn định hoặc bệnh lý tim mạch khác.
 Hình 18.2. Phác đồ đánh giá bệnh nhân hội chứng vành cấp
Hình 18.2. Phác đồ đánh giá bệnh nhân hội chứng vành cấpChú thích: NMCT: Nhồi máu cơ tim.
Hội chứng vành cấp không ST chênh lên (NSTE-ACS) có thể loại trừ nếu nồng độ troponin độ nhạy cao (high sensitive-hs) rất thấp hoặc nồng độ troponin thấp và ít thay đổi trong vòng 1 giờ. NSTEMI nghi ngờ cao nếu nồng độ troponin cao ít nhất hơn mức trung bình hoặc thay đổi rõ trong 1 giờ đầu. Ngưỡng cut-off thuỳ thuộc vào xét nghiệm.
2. GIẢI PHẪU VÀ HÌNH THÁI TỔN THƯƠNG ÁP DỤNG TRONG MẠCH VÀNH
Bảng 18.1. Ngưỡng cut-off (theo ng/L) trong phác đồ 0/1 giờ
| Phác đồ 0/1h | Rất thấp | Thấp | Δ1h | Cao | Δ1h |
| hs-cTnT (Elecsys, Roche) | < 5 | > 12 | < 3 | ≥ 52 | ≥ 5 |
| hs-cTnI (Architect, Abbott) | < 4 | < 5 | < 2 | ≥ 64 | ≥ 6 |
| hs-cTnI (Centaur, Siemens) | < 3 | < 6 | < 3 | ≥ 120 | ≥ 12 |
Nhồi máu cơ tim có ST chênh lên đặc trưng bởi huyết khối xơ vữa gây lấp tắc hoàn toàn lòng mạch làm giảm đột ngột dòng máu mạch vành nuôi cơ tim, gây hình ảnh ST chênh lên trên điện tâm đồ.
So với các tổn thương trên các bệnh nhân NSTE-ACS, tổn thương thủ phạm trong STEMI có diện tích lòng mạch tối thiểu (MLA) nhỏ hơn, gánh nặng mảng xơ vữa và huyết khối nhiều hơn và tỷ lệ mảng xơ vữa nứt vỡ/mảng xơ vữa có vỏ xơ mỏng cao hơn.
Vì vậy, can thiệp trong bệnh cảnh STEMI thường cần hút huyết khối, nguy cơ biến cố liên quan tới huyết khối và việc lựa chọn kích cỡ stent dễ bị không được tối ưu do ước lượng kích thước lòng mạch bị ảnh hưởng bởi huyết khối và phản ứng co thắt mạch trong STEMI.
3. CHỈ ĐỊNH VÀ CHỐNG CHỈ ĐỊNH CỦA CAN THIỆP STEMI
3.1. Chỉ định
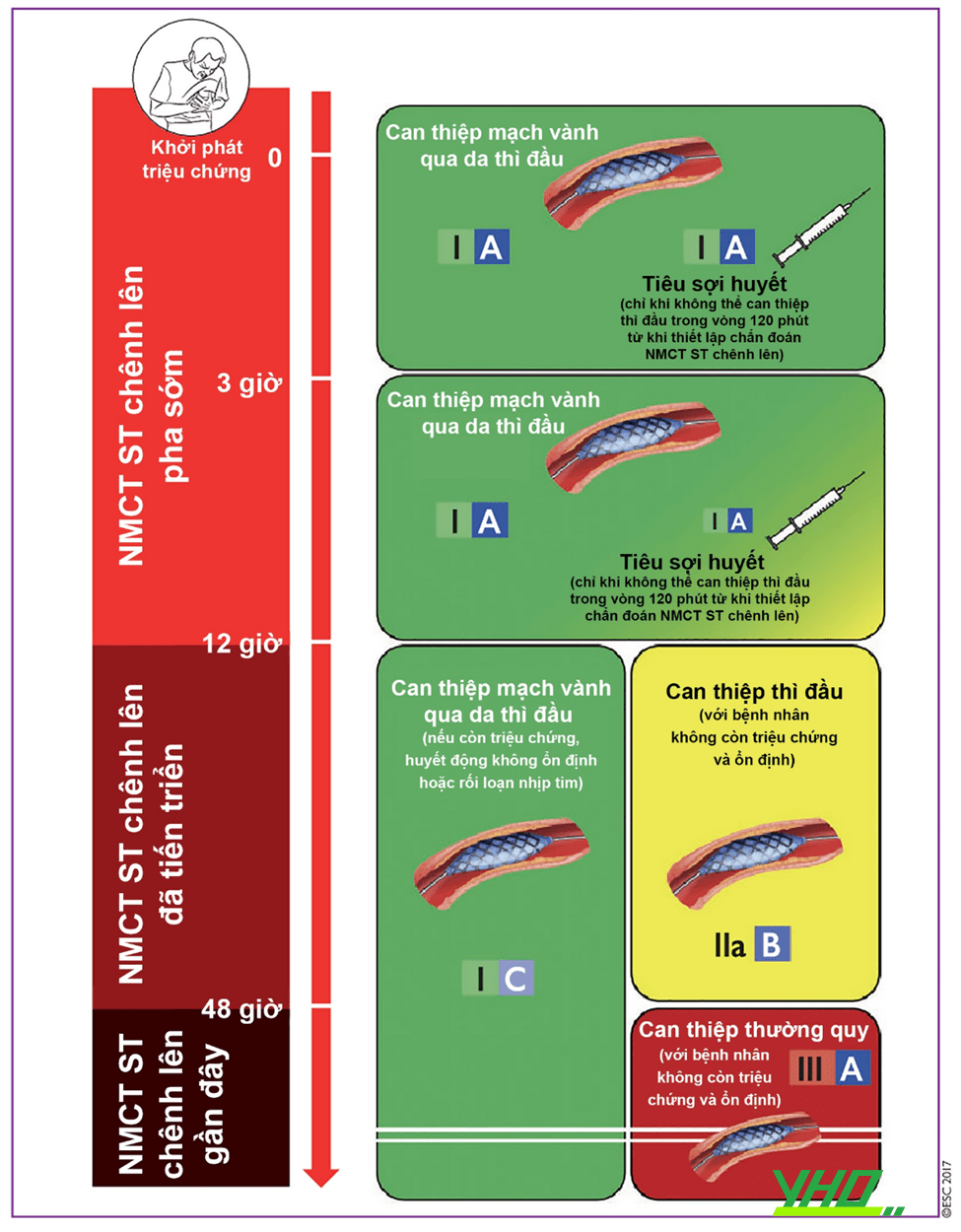 Hình 18.3. Lựa chọn biện pháp tái thông trong nhồi máu cơ tim ST chênh lên
Hình 18.3. Lựa chọn biện pháp tái thông trong nhồi máu cơ tim ST chênh lênChú thích: NMCT: Nhồi máu cơ tim.
Hiện nay, theo khuyến cáo năm 2017 của Hội Tim Mạch Châu Âu (ESC) về STEMI, can thiệp động mạch vành thì đầu qua da là phương pháp tái thông được ưu tiên lựa chọn ở các bệnh nhân nhồi máu cơ tim có ST chênh lên.
- Chỉ định trong vòng 12 giờ từ khi khởi phát triệu chứng (I-A).
- Bất cứ khi nào nếu như huyết động không ổn định, triệu chứng còn tiến triển hoặc rối loạn nhịp (I-C).
- Trong vòng 48 giờ sau khi có triệu chứng (IIa-B).
3.2. Chống chỉ định
- Các chống chỉ định tuyệt đối gồm:
- Không thể tuân thủ theo thủ thuật và không thể dùng kháng kết tập tiểu cầu.
- Nguy cơ chảy máu cao: giảm tiểu cầu, rối loạn đông máu nặng, chảy máu đang tiến triển.
- Tái hẹp nhiều lần sau can thiệp.
- Các chống chỉ định tương đối gồm:
- Không dung nạp với thuốc kháng kết tập tiểu cầu đường uống kéo dài.
- Tắc hoàn toàn cầu nối tĩnh mạch hiển.
- Bệnh thận mạn nặng.
- Kích thước mạch < 1,5
- Hẹp < 50%.
4. LỰA CHỌN THỜI ĐIỂM VÀ CHIẾN LƯỢC CAN THIỆP STEMI
4.1. Thời điểm can thiệp
a. Với nhóm nhồi máu cơ tim có ST chênh (STEMI)
Can thiệp động mạch vành qua da (PCI) thì đầu là phương pháp tái tưới máu được ưu tiên. Tuy nhiên, ưu điểm của PCI có thể giảm đi do thời gian trì hoãn từ lúc xuất hiện cơn đau thắt ngực cho tới lúc bắt đầu can thiệp (đưa dây dẫn qua tổn thương và nong bóng) do vấn đề về hệ thống.
Thời gian chậm trễ cho phép có thể dài hơn và thay đổi tùy theo một số yếu tố như: thời gian xuất hiện triệu chứng, tuổi, vị trí nhồi máu. Điều này nhấn mạnh cá thể hóa điều trị hơn là một chiến lược giống nhau trong lựa chọn biện pháp tái tưới máu hợp.
Theo khuyến cáo của Hội Tim mạch châu Âu (ESC), nếu bệnh nhân nhập viện trung tâm có khả năng PCI, thời gian từ lúc chẩn đoán STEMI tới lúc dây dẫn đi qua tổn thương là trong vòng 60 phút. Còn khi bệnh nhân nhập viện không có PCI, tùy theo thời gian có thể chuyển đến trung tâm có khả năng PCI để quyết định phương án điều trị. Nếu trong vòng 120 phút, thì chuyển bệnh nhân đi, còn khi hơn 120 phút, thì sẽ ưu tiên sử dụng tiêu sợi huyết.
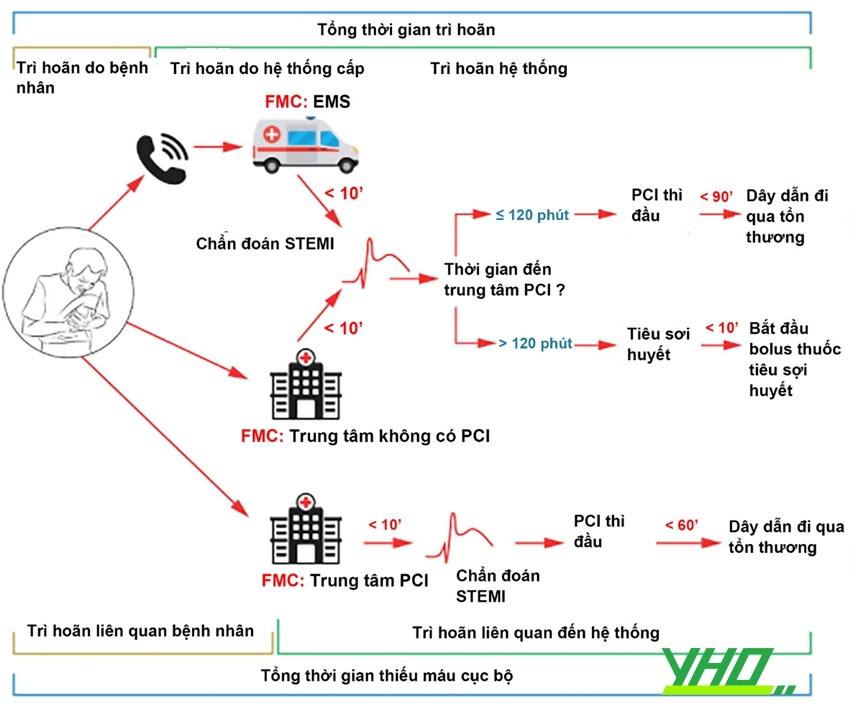 Hình 18.4. Thời điểm can thiệp trong nhồi máu cơ tim có ST chênh (STEMI) Chú thích: STEMI: Nhồi máu cơ tim có ST chênh lên; PCI: Can thiệp động mạch vành qua da; FMC (first medical contact): Liên hệ y tế đầu tiên; EMS: Dịch vụ cấp cứu.
Hình 18.4. Thời điểm can thiệp trong nhồi máu cơ tim có ST chênh (STEMI) Chú thích: STEMI: Nhồi máu cơ tim có ST chênh lên; PCI: Can thiệp động mạch vành qua da; FMC (first medical contact): Liên hệ y tế đầu tiên; EMS: Dịch vụ cấp cứu.b. Với nhóm hội chứng vành cấp không ST chênh (NSTE-ACS): lựa chọn thời điểm can thiệp dựa vào phân tầng nguy cơ
Lựa chọn thời điểm tái thông mạch vành dựa vào nguy cơ của từng bệnh nhân. Khuyến cáo ESC 2020 rút lại chỉ còn 3 nhóm: nguy cơ rất cao, nguy cơ cao và nhóm nguy cơ thấp, chứ không còn nhóm nguy cơ trung bình như khuyến cáo trước đó.
Bảng 18.2. Lựa chọn thời điểm can thiệp dựa trên phân tầng nguy cơ trong NSTE-ACS
| NHÓM NGUY CƠ RẤT CAO (PCI TRONG VÒNG 2H) | NHÓM NGUY CƠ CAO (PCI TRONG VÒNG 24H) | NHÓM NGUY CƠ THẤP (PCI CÓ CHỌN LỌC) |
| Huyết động không ổn định Sốc tim | Chẩn đoán xác định NSTEMI Biến đổi đoạn ST-T liên tục hoặc mới (có triệu chứng hoặc im lặng) Sau cấp cứu ngừng tuần hoàn mà không kèm ST chênh lên hoặc sốc tim GRACE > 140 | Không có bất cứ đặc điểm nào của nhóm nguy cơ cao và rất cao. |
| Đau ngực tái phát/kháng trị với điều trị nội khoa | Nhóm bệnh nhân này thường được can thiệp theo kế hoạch. | |
| Rối loạn nhịp đe doạ tính mạng | ||
| Biến chứng cơ học | ||
| Suy tim cấp liên quan rõ ràng tới NSTE-ACS | ||
| ST chênh xuống > 1 mm/ 6 chuyển đạo và chênh lên ở avR hoặc V1. |
Chú thích: PCI: Can thiệp động mạch vành qua da; NSTE-ACS: Hội chứng vành cấp không ST chênh lên; NSTEMI: Nhồi máu cơ tim không ST chênh lên. GRACE: Thang điểm dự báo nguy cơ tử vong của bệnh nhân (Xem thêm Phụ lục: Các thang điểm thường dùng trong tim mạch can thiệp).
4.2. Chiến lược can thiệp
a. Chiến lược can thiệp thì đầu
PCI thì đầu nên được tiến hành ngay sau khi chụp mạch vành với tổn thương thủ phạm. Lựa chọn kỹ thuật phù hợp cần dựa trên dòng chảy nhánh mạch thủ phạm, gánh nặng huyết khối, và kích thước mạch. Những dữ liệu về an toàn và hiệu quả của can thiệp các nhánh mạch vành không thủ phạm ở những bệnh nhân không có sốc tim trong bệnh cảnh STEMI còn hạn chế.
Dựa trên hướng dẫn của Hội Tim mạch châu Âu (ESC) về STEMI, tiến hành can thiệp các nhánh mạch vành không thủ phạm nên xem xét ở bệnh nhân có sốc tim. Tái thông thường quy các nhánh không thủ phạm ở bệnh nhân STEMI có tổn thương nhiều thân mạch vành nên xem xét trước khi xuất viện.
 Hình 18.5. Chiến lược can thiệp ở bệnh nhân nhồi máu cơ tim có ST chênh lên
Hình 18.5. Chiến lược can thiệp ở bệnh nhân nhồi máu cơ tim có ST chênh lênb. Chiến lược chụp mạch và can thiệp động mạch vành qua da sau tiêu sợi huyết
Chụp mạch/PCI thường quy
Trong các thử nghiệm lâm sàng từ những năm 1980 và 1990, PCI ngay những bệnh nhân STEMI sau tiêu sợi huyết đủ liều liên quan tới hiệu quả trên chụp mạch và kết cục lâm sàng kém hơn, có thể do sử dụng ít kháng kết tập tiểu cầu hơn và tình trạng tăng đông sau tiêu sợi huyết. Tác giả của nghiên cứu GRACIA-2 nhấn mạnh PCI thường quy sớm sau 3-12 giờ sau tiêu sợi huyết là an toàn và tưới máu cơ tim hiệu quả hơn nong bóng đơn thuần. Sau tiêu sợi huyết tất cả bệnh nhân nên chuyển ngay tới trung tâm có sẵn PCI và chụp mạch vành thường quy. Nếu có thể khuyến cáo tiến hành trong 2-24 giờ sau tiêu sợi huyết thành công. Mặc dù chưa có nghiên cứu, nhưng sự chậm trễ giữa tiêu sợi huyết và PCI sau tiêu sợi huyết thành công ảnh hưởng tới kết cục và tiên lượng.
Chụp mạch/PCI cứu vãn
PCI cứu vãn trong STEMI được định nghĩa là tiến hành can thiệp trên nhánh động mạch vành liên quan tới nhồi máu sau tiêu sợi huyết thất bại.
Định nghĩa tiêu sợi huyết thất bại vẫn là vấn đề trong thực hành thường quy. Thông thường sẽ đánh giá 60-90 phút sau bắt đầu tiêu sợi huyết và dựa trên triệu chứng lâm sàng (giảm đau ngực) và thay đổi điện tâm đồ (giảm chênh đoạn ST > 50%).
Theo hướng dẫn của Hội Tim mạch châu Âu (ESC), PCI cứu vãn ngay sau tiêu sợi huyết thất bại (giảm chênh đoạn ST < 50% sau 60-90 phút) hoặc bất cứ khi nào huyết động hoặc điện học không ổn định, triệu chứng thiếu máu cục bộ nặng lên. Chụp mạch cấp cứu và can thiệp ở các trường hợp tái phát thiếu máu cục bộ hoặc bằng chứng tắc lại sau tiêu sợi huyết thành công.
5. DỤNG CỤ VÀ KỸ THUẬT CAN THIỆP
5.1. Dụng cụ can thiệp
Các dụng cụ sử dụng trong can thiệp hội chứng vành cấp tùy theo từng bệnh nhân cụ thể, tuy nhiên cơ bản cần phải có bao gồm:
- Bộ dụng cụ mở đường vào mạch máu.
- Catheter chụp và dây dẫn 0,035
- Manifold, dây áp lực.
- Guiding catheter, dây dẫn can thiệp 0,014
- Bơm áp lực, bóng nong, stent mạch vành.
- Dụng cụ hút huyết khối.
- Thuốc: thuốc cản quang, heparin không phân đoạn, nitroglycerin, các thuốc cấp cứu,…
Đặc điểm của các dụng cụ: (Xin tham khảo thêm Chương 16 Các dụng cụ sử dụng trong can thiệp động mạch vành).
5.2. Kỹ thuật can thiệp trong hội chứng vành cấp
a. Lựa chọn vị trí đường vào
- Phương pháp và kỹ thuật can thiệp lựa chọn trong can thiệp mạch vành thì đầu cũng không khác nhiều so với can thiệp mạch vành thường
- Đường vào động mạch quay: không những giảm biến cố chảy máu do điều trị kháng kết tập tiểu cầu và chống huyết khối tích cực trong bệnh cảnh nhồi máu cơ tim NMCT ST chênh lên, mà còn giảm tử vong ở bệnh nhân NMCT ST chênh lên, giảm thời gian nằm viện, giảm chi phí y tế. Vì vậy, theo khuyến cáo về NMCT ST chênh lên và Tái thông mạch vành của ESC, đường vào mạch quay được ưu tiên hơn khi PCI thì đầu bệnh nhân NMCT ST chênh lên nếu được thực hiện bởi bác sĩ có kinh nghiệm. Tỷ lệ PCI thì đầu thành công qua đường mạch quay tương tự như qua đường mạch đùi, đặc biệt ở các trung tâm có kinh nghiệm, PCI qua đường mạch quay không làm tăng thời gian cửa-bóng và thời gian thủ thuật. Tuy nhiên, với các kỹ thuật phức tạp, mạch quay không phải lựa chọn lý tưởng vì hỗ trợ guiding yếu hơn và hạn chế khi dùng các guiding kích thước > 6Fr đặc biệt khi mạch quay nhỏ (phụ nữ thể trạng nhỏ, người có tiền sử can thiệp) .
- Sốc tim hay huyết động không ổn định không được xem là chống chỉ định tuyệt đối của đường vào mạch quay, miễn là mạch quay còn bắt được, sau khi đặt IABP hay dụng cụ hỗ trợ thất trái qua đường mạch đùi.
- Khi tiến hành PCI thì đầu nên xem xét cả 2 đường vào mạch quay và mạch đùi vì lựa chọn đường vào có thể ảnh hưởng bởi đặc điểm giải phẫu và mức độ nặng của bệnh lý mạch ngoại
b. Lựa chọn ống thông, dây dẫn và stent
- Chụp mạch vành có thể được thực hiện bằng các ống thông chụp chẩn đoán tiêu chuẩn hoặc dùng guiding để tiết kiệm thời gian thay đổi ống thông.
- Ống thông Judkins tiêu chuẩn hoặc guiding Extra Back-up được ưu tiên sử dụng. Ngoài ra, có thể lựa chọn các guiding khác (ví dụ Amplatz) tùy theo đặc điểm lỗ vào, giải phẫu động mạch và vị trí tổn thương xơ vữa khi cần lực hỗ trợ tốt hơn. Lựa chọn guiding phù hợp sẽ tăng tỷ lệ thành công và giảm thời gian của thủ thuật.
- Ban đầu, khi cố gắng đi qua tổn thương, chúng ta nên sử dụng dây dẫn mềm, không ngậm nước để tránh bóc tách mạch đoạn xa và dễ đi vào lòng thật. Nếu thất bại, đặc biệt với các tổn thương vôi hóa và hẹp nặng, chúng ta có thể đổi bằng dây dẫn ngậm nước hoặc phủ polymer hoặc dùng thêm microcatheter hỗ trợ.
- Stent phủ thuốc được khuyến cáo sử dụng trong bất kỳ can thiệp nào, bất kể: biểu hiện lâm sàng, loại tổn thương, phẫu thuật ngoài tim mạch có kế hoạch, khoảng thời gian dự kiến dùng DAPT (kháng tiểu cầu kép), điều trị thuốc chống đông kèm theo (khuyến cáo I-A). Tuy nhiên, stent phủ thuốc (DES) có nhiều loại khác nhau bởi kích thước các thanh chống, chất phủ cũng như thời gian tiêu đi của các lớp polyme. Hiện nay, chưa có hướng dẫn nào về việc lựa chọn loại DES tối ưu trong can thiệp bệnh nhân nhồi máu cơ tim cấp có ST chênh lên. Các stent phủ thuốc có lớp polyme hằng định làm chậm quá trình làm lành mạch máu, gây phản ứng viêm kéo dài tại chỗ và suy giảm chức năng nội mạc. Điều này liên quan tới biến cố huyết khối muộn trong stent. Nghiên cứu BIOSTEMI là nghiên cứu tiến cứu, ngẫu nhiên, đa trung tâm, mù người đánh giá (assesor-blind), đánh giá tính an toàn và hiệu quả của stent có thanh chống siêu mỏng phủ sirolimus với lớp polyme tự tiêu (BP-SES) so với stent phủ everolimus với lớp polyme hằng định (DP-EES). Nghiên cứu tiến hành trên tổng số 1300 bệnh nhân STEMI được can thiệp thì đầu trong vòng 24 giờ, phân nhóm ngẫu nhiên 1:1 đặt BP-SES và DP-EES. Theo dõi đến thời gian 2 năm hoàn tất ở 1221 bệnh nhân. Kết quả cho thấy, stent có thanh chống siêu mỏng phủ sirolimus với lớp polyme tự tiêu (BP-SESS-đại diện là ORSIRO) ưu thế hơn so với stent phủ everolimus với lớp polyme hằng định (đại điện là XIENCE) biến cố tổn thương đích. Tuy nhiên, giữa 2 nhóm chưa có sự khác biệt có ý nghĩa thống kê về tỷ lệ tử vong tim mạch, tử vong do mọi nguyên nhân, nhồi máu cơ tim nhánh mạch đích và biến cố gộp (tử vong, nhồi máu cơ tim và việc lặp lại tái thông). Kết quả của nghiên cứu này có thể mang lại những thông tin có ý nghĩa lâm sàng trong điều trị bệnh nhân STEMI trải qua quá trình can thiệp.
– Tuy nhiên, luôn nhớ tránh đặt stent khi có huyết khối tồn dư. Khi đó, cần hút huyết khối để tránh sau khi huyết khối đã tiêu đi, stent trở nên không áp sát thành. Ngoài ra, hút huyết khối sẽ giảm co thắt mạch liên quan tới các yếu tố tiểu cầu và giúp xác định kích thước thành mạch chính xác hơn. Trong quá trình xác định kích thước stent, nitroglycerin cũng được khuyến cáo để giảm co thắt mạch.
c. Chiến lược tái thông
Chọn lựa chiến lược tái thông (PCI nhánh thủ phạm/ PCI nhiều nhánh/CABG) dựa trên đặc điểm lâm sàng của bệnh nhân và các bệnh lý kèm theo, mức độ nặng của tổn thương mạch vành (đặc điểm tổn thương trên chụp mạch, thang điểm SYNTAX,…). Quyết định PCI ngay hay không nếu cần thiết phải hội chẩn “Nhóm chuyên gia tim mạch”.
– Trong can thiệp bệnh nhân STEMI:
- Sử dụng thường quy hút huyết khối không được khuyến cáo (III-A)
- Tái thông các tổn thương không thủ phạm nên cân nhắc ở những bệnh nhân STEMI với bệnh lý nhiều thân mạch vành trước khi xuất viện (IIa-A).
- Can thiệp các tổn thương không thủ phạm theo chương trình nên cân nhắc ở bệnh nhân có sốc tim (IIa-C).
- CABG nên cân nhắc ở bệnh nhân có thiếu máu cục bộ tiến triển và vùng cơ tim lớn bị đe dọa thiếu máu
nếu PCI không thể thực hiện được (IIa-C).
– Trong can thiệp bệnh nhân NSTE-ACS:
- Tái thông toàn bộ các nhánh mạch vành nên được xem xét ở bệnh nhân NSTE-ACS không có sốc tim và bệnh lý nhiều thân mạch vành (IIa-C).
- Tái thông lần lượt toàn bộ các nhánh mạch vành có thể cân nhắc ở bệnh nhân NSTE-ACS bị bệnh nhiều thân mạch vành (IIb-B)
- Chẩn đoán hình ảnh trong lòng mạch vành nên cân nhắc để chẩn đoán bóc tách tự nhiên động mạch vành (IIa-C).
- Can thiệp dưới hướng dẫn của đo phân suất dự trữ lưu lượng vành (FFR) với các tổn thương không thủ phạm ở bệnh nhân NSTE-ACS có thể cân nhắc (IIb-B)
- Có thể sử dụng hút huyết khối trong trường hợp NSTE-ACS; tuy nhiên, lợi ích của nó không được đánh giá trong các thử nghiệm ngẫu nhiên ở bệnh nhân NSTE-ACS. Vẫn chưa xác định được liệu các đoạn mạch vành khác có hẹp không đáng kể nhưng các đặc điểm dễ bị tổn thương có xứng đáng với can thiệp cơ học hay không; do vậy, sự can thiệp này không được ủng hộ.
d. Hút huyết khối, bảo vệ đoạn gần và đoạn xa trong can thiệp STEMI
Huyết khối gây tắc hoàn toàn lòng mạch vành là đặc điểm sinh bệnh học đặc trưng của STEMI. Mặc dù, hút huyết khối không được khuyến cáo tiến hành thường quy. Tuy nhiên, trong những trường hợp cụ thể, chúng ta vẫn cần thực hiện kỹ thuật này.
- Đánh giá mức độ huyết khối. Gánh nặng huyết khối được chia thành 6 mức độ:
- Độ 0: Không có huyết khối.
- Độ 1: Khả năng có huyết khối.
- Độ 2: Huyết khối với đường kính lớn nhất < 1/2 đường kính lòng mạch.
- Độ 3: Huyết khối với đường kính lớn nhất > 1/2 và < 2 lần đường kính lòng mạch.
- Độ 4: Huyết khối với đường kính lớn nhất > 2 lần đường kính lòng mạch.
- Độ 5: Huyết khối gây tắc hoàn toàn mạch máu.
Bệnh nhân được phân loại thành: Nhóm có gánh nặng huyết khối thấp (độ 1,2,3) và gánh nặng huyết khối cao (độ 4,5).
 Hình 18.6. Phân độ huyết khối trên phim chụp mạch vành qua da
Hình 18.6. Phân độ huyết khối trên phim chụp mạch vành qua da– Các dụng cụ phòng ngừa tắc mạch đoạn xa
- Tái tưới máu cơ tim không tối ưu gặp ở một số tương đối lớn bệnh nhân NMCT ST chênh lên sau can thiệp, mặc dù đã tái thông tốt dòng chảy mạch lớn thượng tâm mạc, làm ảnh hưởng tới kết cục ngắn và dài hạn.
- Một trong những lí do là thuyên tắc mạch đoạn Vì vậy, một số dụng cụ được ra đời để phòng ngừa biến chứng này.
Bảng 18.3. Một số dụng cụ bảo vệ đoạn xa
| DỤNG CỤ | ƯU ĐIỂM | NHƯỢC ĐIỂM |
| BÍT ĐOẠN XA | Đường kính thân nhỏ Bảo vệ đoạn xa hoàn toàn | Cản trở dòng chảy Không thể thực hiện chụp mạch Nhiều thao tác Không thể bảo vệ được nhánh bên |
| BÍT ĐOẠN GẦN | Có thể bảo vệ được toàn bộ trước khi thao tác tổn thương | Cản trở dòng chảy Không thể tiến hành chụp mạch Cần guiding lớn hơn |
| LƯỚI LỌC | Bảo tồn được dòng chảy Có thể tiến hành chụp mạch khi đang thao tác | Để lọt các mảnh nhỏ Đường kính thân lớn Có nguy cơ huyết khối lưới lọc |
Dụng cụ bảo vệ đoạn xa
Một số dụng cụ bảo vệ đoạn xa đã được chứng minh lợi ích trong can thiệp cầu nối tĩnh mạch hiển. Một số thử nghiệm đã được tiến hành trong can thiệp mạch vành thì đầu.
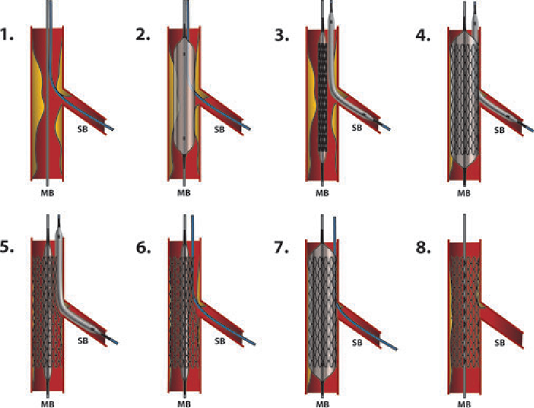
 Hình 18.7. Một số dụng cụ bảo vệ đoạn xa
Hình 18.7. Một số dụng cụ bảo vệ đoạn xa– Dụng cụ bít đoạn xa
Một số dụng cụ đã được sử dụng trong can thiệp cầu nối tĩnh mạch hiến như Percusurge (medtronic) và cho các kết quả đáng hứa hẹn. Tuy nhiên, trong cả 2 thử nghiệm, EMERALD (501 bệnh nhân) và ASPARAGUS (341 bệnh nhân), đều không thấy cải thiện tưới máu mạch vành, thậm
chí diện nhồi máu còn tăng lên ở nhóm có sử dụng dụng cụ bít đoạn xa. Tuy nhiên, các dụng cụ này không làm tăng nguy cơ thủng mạch vành hay các biến cố cơ học khác.
Vì không chứng minh được lợi ích, các dụng cụ này không được khuyến cáo dùng trong can thiệp ở bệnh nhân NMCT ST chênh lên.
– Lưới lọc
Cũng như dụng cụ bít đoạn xa mạch vành, sử dụng lưới lọc nội mạch vành đã được chứng minh cải thiện kết cục ở một số bệnh nhân can thiệp theo chương trình cầu nối tĩnh mạch hiển. Tuy nhiên, trong bệnh cảnh NMCT ST chênh lên, lưới lọc cũng không có lợi ích và không được khuyến cáo.
– Dụng cụ bảo vệ đoạn gần
Một số hệ thống bảo vệ đoạn gần đã được đưa ra như Proxis Embolic Protection. Nhưng thực tế, hệ thống này cũng có những hạn chế của hệ thống bảo vệ đoạn xa như: Cần landing-zone với đường kính phù hợp, bảo vệ không hoàn toàn trong trường hợp nhánh đoạn gần lớn và khó thực hiện trong các trường hợp giải phẫu phức tạp như mạch xoắn vặn, vôi hóa.
Hệ thống này được đặt ở đoạn gần của mạch mục tiêu và
sẽ chặn hoàn toàn dòng máu đi vào mạch trước khi đi qua tổn thương. Không giống như dụng cụ bảo vệ đoạn xa, hệ thống này có thể hút các mảnh gây thuyên tắc bất kể kích thước và thành phần. Chúng ta sẽ cần những thử nghiệm lớn hơn trong tương lai để đánh giá lợi ích trong tưới máu cơ tim và kết cục lâm sàng của các dụng cụ này.
Do vậy, không khuyến cáo các dụng cụ này trong thực hành hiện tại.
– Dụng cụ hút huyết khối
Sử dụng dụng cụ hút huyết khối có thể khắc phục một vài nhược điểm của các dụng cụ bảo vệ đoạn xa như cần landing zone và khi đi qua tổn thương có thể gây thuyên tắc đoạn xa.
Một vài dụng cụ hút huyết khối đã được đề xuất để bảo vệ đoạn xa như: Angiojet, X-SIZER, Rescue, Export Catheter, Eliminate….
AngioJet
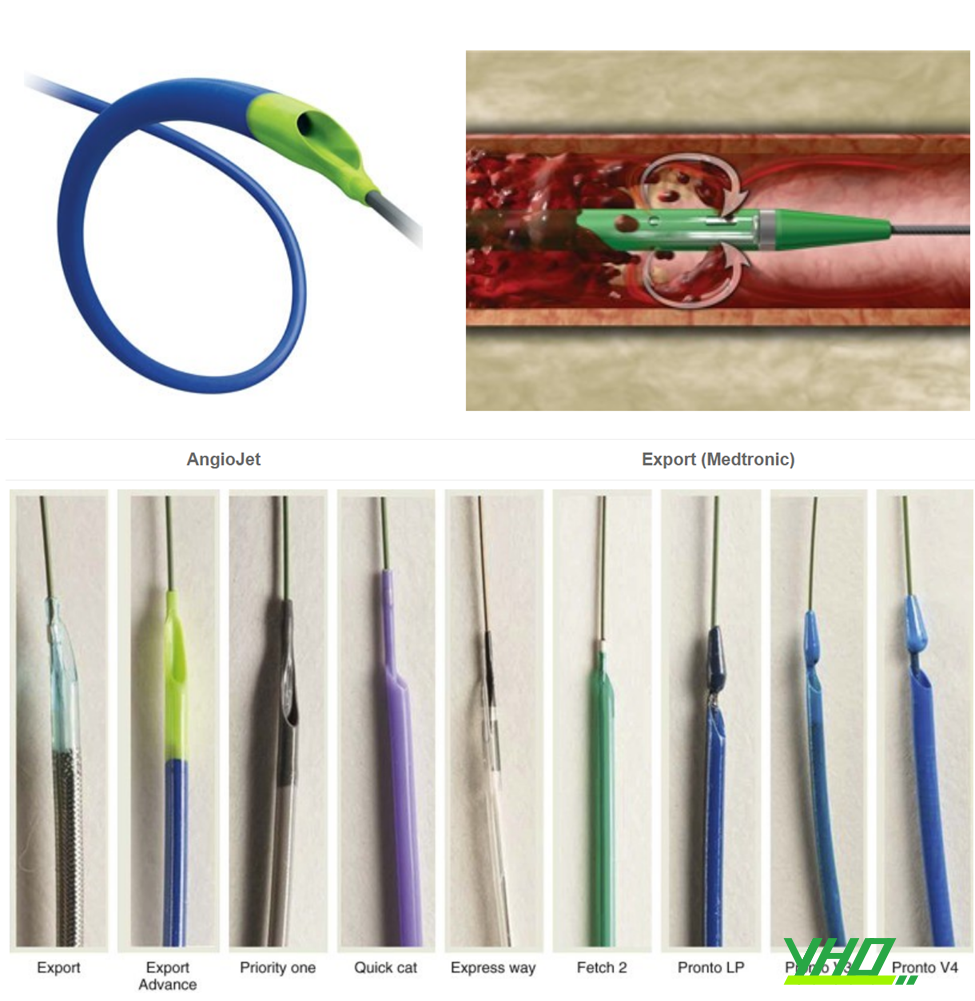 Hình 18.8. Một số dụng cụ hút huyết khối
Hình 18.8. Một số dụng cụ hút huyết khốiMột vài thử nghiệm đã được tiến hành với các dụng cụ khác nhau và kết quả còn tranh cãi. Hầu hết các kết quả âm tính được ghi nhận trong 2 nghiên cứu lớn dưới đây:
- Thử nghiệm JETSTENT: Đánh giá vai trò của Angiojet trên các bệnh nhân có gánh nặng huyết khối lớn. Kết quả cải thiện đáng kể đoạn ST (tiêu chí chính) và MACE 6 tháng mặc dù không khác biệt về diện nhồi máu trên xạ hình.
- Thử nghiệm TAPAS: Hơn 1000 bệnh nhân NMCT ST chênh lên phân nhóm thành: trước khi can thiệp được hút huyết khối (Export Catheter) và nhóm can thiệp thông thường. Kết quả cải thiện đáng kể tưới máu cơ tim và sống còn 1 năm.
- Tóm lại, chiến lược sử dụng dụng cụ hút huyết khối vẫn nên xem xét trong trường hợp có bằng chứng huyết khối, đặc biệt các trường hợp gánh nặng huyết khối lớn. Thực tế, việc hút huyết khối là chìa khóa để tối ưu việc chọn và đặt stent vì giảm co thắt mạch (giảm việc chọn stent bé hơn so với mạch và nguy cơ áp sát kém), cũng như giảm nguy cơ huyết khối kẹt giữa mắt stent và thành mạch, có thể là nguyên nhân của stent không áp sát sau này.
Tuy nhiên, không khuyến cáo thực hiện hút huyết khối một cách thường quy.
Kỹ thuật hút huyết khối
- Sử dụng ống thông hút huyết khối nên chỉ dành cho mạch máu thủ phạm bị tắc hoặc nhánh mạch đã có dòng chảy đoạn xa và gánh nặng huyết khối cao sau khi đưa dây dẫn
- Hút huyết khối thành công cho phép quan sát tốt hơn tổn thương xơ vữa và đoạn xa tổn thương
- Nên bắt đầu hút 2 cm phía trước chỗ tắc hoặc tổn thương có huyết khối
- Nên dùng kỹ thuật đẩy chậm qua nhiều lần, dừng lại ở chỗ huyết khối và hút liên tục từ đoạn xa tới chỗ huyết khối. Làm lại từ 2 – 3 lần
- Khi rút ống thông hút huyết khối, vẫn cần đảm bảo ống thông được hút liên tục, kể cả trong guiding và sau đó, máu trong guiding cũng cần được hút
- Hút huyết khối thành công khi thấy có huyết khối trong bơm hút
Nếu cần lực hút mạnh hơn (do mạch lớn hơn, huyết khối tổ chức hóa), có thể sử dụng ống thông hút lớn hơn (7 Fr) hoặc ống thông có phần hút áp lực âm lớn hơn.
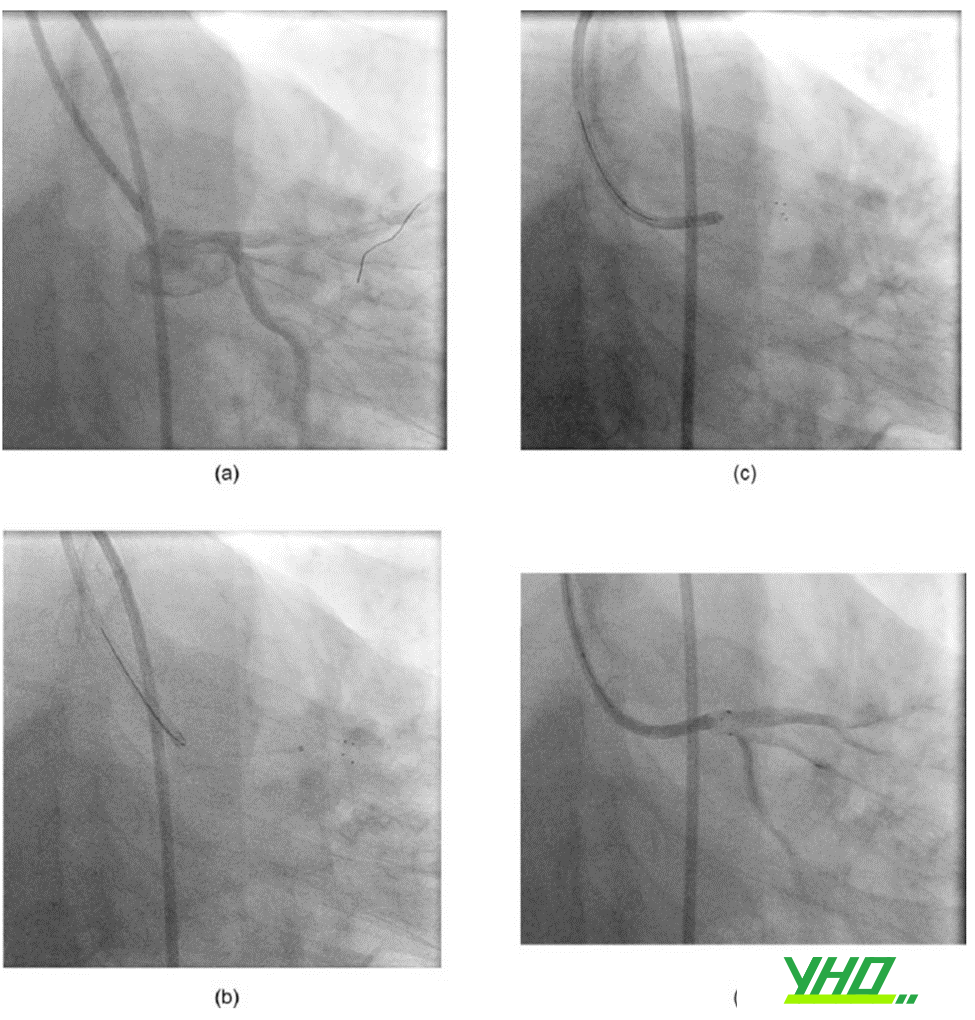
Hình 18.9. Kỹ thuật hút huyết khối thân chung động mạch vành trái
- Dây dẫn được đưa qua huyết khối tới đoạn xa động mạch liên thất trước
- Dụng cụ hút huyết khối được đưa vào
- Tiến hành hút huyết khối
- Tái thông một phần dòng chảy động mạch vành trái (LM-LAD)
5.3. Bóng đối xung động mạch chủ và dụng cụ hỗ trợ thất trái
Trong nghiên cứu CRISP AMI, sử dụng thường quy bóng đối xung động mạch chủ (IABP) trong PCI bệnh nhân nhồi máu cơ tim thành trước không có sốc, không giảm kích thước vùng nhồi máu đánh giá trên cộng hưởng từ tim. Ngoài ra, trong thử nghiệm IABP- SHOCK II, lợi ích của IABP kể cả trong trường hợp có sốc vẫn còn là câu hỏi. Trong nghiên cứu này, không có khác biệt về tử vong 30 ngày cũng như 12 tháng ở bệnh nhân sốc tim có dùng và không dùng IABP.
Vì vậy, không khuyến cáo sử dụng thường quy IABP ở bệnh nhân sốc tim (III-B). Tuy nhiên, IABP nên xem xét trong trường hợp huyết động không ổn định/sốc tim do biến chứng cơ học của nhồi máu cơ tim.
Một số dụng cụ hỗ trợ thất trái đặt qua da khác cũng đã được thử nghiệm trong bệnh cảnh NMCT ST chênh lên. Tuy nhiên, sử dụng bơm ly tâm qua da (Tandem Heart) và bơm vi trục (Impella) không cải thiện tử vong 30 ngày, mặc dù có hồi phục huyết động giai đoạn sớm ở bệnh nhân sốc.
VA-ECMO có thể cung cấp oxy hóa máu và tuần hoàn đầy đủ và ngay lập tức. Đồng thời, VA-ECMO đơn giản hơn, cần ít thời gian hơn để hoàn thành so với dụng cụ hỗ trợ thất trái. Sheu và cộng sự đã chứng minh cải thiện kết cục lâm sàng, giảm tử vong ở bệnh nhân NMCT ST chênh lên biến chứng sốc tim được PCI thì đầu có hỗ trợ VA – ECMO.
Vì vậy, hỗ trợ tuần hoàn cơ học ngắn hạn có thể xem xét ở bệnh nhân sốc kháng trị (IIb). Các dụng cụ như Tandemheart, Impella cũng như VA-ECMO sẽ ổn định ngay tình trạng bệnh nhân, cho phép can thiệp trong tình trạng ổn định hơn và có thời gian chờ cơ tim hồi phục hay bắc cầu cho tới khi cấy các dụng cụ hỗ trợ lâu dài hoặc ghép tim. Trong dữ liệu AMICS, lợi ích sống còn cao hơn ở những bệnh nhân hỗ trợ tuần hoàn cơ học sớm, do đó, cố gắng rút ngắn thời gian “shock to support” tương tự như thời gian “cửa-bóng” trong NMCT ST chênh lên.
6. ĐIỀU TRỊ THUỐC PHỐI HỢP
6.1. Thuốc kháng kết tập tiểu cầu, chống đông dùng trước, trong và sau can thiệp
a. Trong STEMI
Trong STEMI cần sử dụng một thuốc chống đông (ưu tiên UFH) và kháng kết tập tiểu cầu kép với liều nạp ngay, bao gồm aspirin với một thuốc ức chế thụ thể P2Y12 tiểu cầu (hoặc ticagrelor, hoặc prasugrel hoặc clopidogrel). Liều nạp và duy trì như bảng dưới đây.
| NHÓM THUỐC KHÁNG KẾT TẬP TIỂU CẦU Theo khuyến cáo của ESC trong điều trị bệnh nhân nhồi máu cơ tim (NMCT) ST chênh lên, ưu tiên dùng các thuốc kháng kết tập tiểu cầu P2Y12 mới như Ticagrelor hoặc Prasugrel. Khi không có mới dùng Clopidogrel. Nhóm ức chế Glycoprotein IIb/IIIa nên cân nhắc là biện pháp cứu vãn khi có bằng chứng của no-reflow hoặc biến chứng huyết khối (IIa). | |
| Aspirin | Liều nạp 150-300 mg uống hoặc 75-250 mg tĩnh mạch nếu không thể uống, sau đó duy trì 75-100 mg/ngày. |
| Clopidogrel | Liều nạp 300-600 mg, sau đó duy trì 75 mg/ngày. |
| Prasugrel | Liều nạp đường uống 60mg, sau đó duy trì 10mg/ngày. Bệnh nhân < 60 kg, duy trì 5 mg/ngày. Chống chỉ định: Tiền sử đột quỵ và ở những bệnh nhân từ 75 tuổi trở lên nhìn chung không khuyến cáo. |
| Ticagrelor | Liều nạp 180 mg uống, sau đó 90 mg x 2 lần/ngày. |
| Abciximab | Bolus 0,25 mg/kg tĩnh mạch và truyền liên tục 0,125 μg/kg/phút (tối đa: 10 μg/phút) trong 12 giờ. |
| Eptifibatide | Bolus 2 lần 180 μg/kg tĩnh mạch (dùng trong khoảng 10 phút) sau đó truyền 2 μg/kg/phút tới 18 giờ. |
| Tirofiban | 25 μg/kg trong 3 phút tĩnh mạch sau đó truyền duy trì 0,15 μg/kg/phút tới 18 giờ. |
| LIỆU PHÁP CHỐNG ĐÔNG Không cần dùng kéo dài thuốc chống đông sau khi can thiệp thành công. Trừ khi có một số chỉ định: Phình thất trái và/hoặc huyết khối, rung nhĩ, nằm bất động kéo dài, trì hoãn rút sheath, dùng IABP (bóng đối xung động mạch chủ). | |
| Heparin không phân đoạn | 70 -100 UI/kg bolus tĩnh mạch nếu không định dùng ức chế GP IIb/IIIa 50-70 UI/kg bolus nếu dùng kèm ức chế GP IIb/IIIa. Tuy nhiên, liều bolus tĩnh mạch không nên quá 5000 UI. Nếu có điều kiện thì thời gian ACT nên được kiểm tra trước khi tiến hành can thiệp và khi bolus thêm heparin. Mục tiêu ACT là từ 200-250 giây nếu có dùng ức chế GP IIb/IIIa và từ 250-300 giây nếu không dùng. |
| Enoxaparin | 0,5 mg/kg bolus sau đó điều trị tiêm dưới da. |
| Bivalirudin | 0,75 mg/kg bolus tĩnh mạch sau đó truyền tĩnh mạch 1,75mg/kg/giờ cho tới vài tiếng trước can thiệp. |
| Fondaparinux | Fondaparinux không còn được khuyến cáo sử dụng trong bệnh cảnh NMCT ST chênh lên (III-B). Tuy nhiên, trong trường hợp không còn sự lựa chọn nào khác, thì dùng liều đầy đủ của heparin không phân đoạn trong quá trình can thiệp nếu trước đó dùng Fondaparinux. |
b. Trong NSTE-ACS
Liều lượng các thuốc kháng kết tập tiểu cầu và chống đông sử dụng trong hội chứng vành cấp không ST chênh lên (NSTE-ACS) cũng tương tự như trong nhồi máu cơ tim ST chênh lên (STEMI).
Tuy nhiên, cập nhật 2020 của ESC về NSTE-ACS có nhấn mạnh về vấn đề điều trị trước (Pre-treatment) với các thuốc kháng P2Y12 khi mà giải phẫu mạch vành chưa được rõ. Dựa trên các dữ liệu hiện tại, không khuyến cáo điều trị trước với kháng P2Y12 như Clopidogrel, Ticagrelor, Prasugrel ở bệnh nhân NSTE-ACS khi chưa biết giải phẫu mạch vành và có kế hoạch chụp mạch sớm.
Còn khi có kế hoạch can thiệp xâm lấn trì hoãn, có thể cân nhắc điều trị trước với kháng P2Y12 tùy theo từng bệnh nhân cụ thể dựa theo đánh giá nguy cơ chảy máu của bệnh nhân.
6.2. Vai trò của tiêu sợi huyết trong điều trị hội chứng vành cấp
Hiện tại, điều trị tiêu sợi huyết chỉ được chi định trong STEMI. Đây là biện pháp tái lập dòng chảy ở những bệnh nhân STEMI ở xa trung tâm can thiệp, không thể tiếp cận trong vòng 120 phút. Tuy nhiên, đây không phải là điều trị tiêu chuẩn đơn độc. Vì dù có tiêu sợi huyết thành công, bệnh nhân STEMI cũng cần phải chụp và/hoặc can thiệp để đặt được tái tưới máu mạch vành.
Liệu pháp tiêu sợi huyết liên quan tới tăng đáng kể nguy cơ đột quỵ, chủ yếu xảy ra trong ngày đầu điều trị. Đột quỵ não sớm hầu hết là chảy máu não, đột quỵ muộn thường là nhồi máu não do huyết khối/thuyên tắc mạch, và có thể xảy ra sau can thiệp. Các yếu tố tiên lượng xuất huyết nội sọ như: tuổi cao, nhẹ cân, giới nam, tiền sử bệnh mạch não, tăng huyết áp tâm thu, tâm trương khi nhập viện.
Trong trường hợp thất bại với tiêu sợi huyết, lặp lại liều thứ 2 không chứng minh được hiệu quả và bệnh nhân nên được chuyển ngay đến trung tâm có thể chụp và can thiệp mạch vành.
Chiến lược dành cho những bệnh nhân đã tiêu sợi huyết thành công (giảm chênh đoạn ST > 50% sau 60-90 phút, có rối loạn nhịp đặc trưng cho tái tưới máu, hết đau ngực) vẫn còn tranh cãi, bao gồm: Chụp mạch vành xem xét can thiệp sớm trong thời gian từ 2-24 giờ sau tiêu sợi huyết nếu không có chống chỉ định; hoặc Theo dõi và chờ đợi, chỉ chụp qua da khi bệnh nhân có suy chức năng thất trái hoặc biểu hiện thiếu máu cục bộ nặng tự nhiên/sau gắng sức.
7. MỘT SỐ TRƯỜNG HỢP TRONG HỘI CHỨNG VÀNH CẤP KHÔNG ST CHÊNH LÊN
7.1. Người cao tuổi
Biểu hiện lâm sàng của NSTE-ACS ở người cao tuổi thường không điển hình và họ có nhiều khả năng có các triệu chứng nhẹ, trong đó khó thở là triệu chứng hàng đầu. Ngất, khó chịu và lú lẫn ít xảy ra hơn. Kết quả của điện tâm đồ ít có khả năng chứng minh độ lệch đoạn ST rõ rệt. Bệnh nhân cao tuổi biểu hiện NSTE-ACS thường xuyên hơn STEMI.
Tuổi tác là một trong những yếu tố dự báo nguy cơ quan trọng nhất trong NSTE-ACS. Bệnh nhân >75 tuổi có tỷ lệ tử vong ít nhất gấp đôi so với những người <75 tuổi. Tỷ lệ mắc các biến chứng liên quan đến hội chứng vành cấp (ACS) như suy tim, chảy máu, đột quỵ, suy thận và nhiễm trùng tăng rõ rệt theo tuổi. Do đó, nên thận trọng khi sử dụng enoxaparin ở người cao tuổi và liều lượng phải được điều chỉnh cho phù hợp với chức năng thận. Các quyết định về cách quản lý bệnh nhân cao tuổi cá nhân phải dựa trên nguy cơ thiếu máu cục bộ và chảy máu, tuổi thọ ước tính, các bệnh đồng mắc, chất lượng cuộc sống, mong muốn của bệnh nhân và các rủi ro và lợi ích ước tính của việc tái thông mạch máu.
7.2. Giới tính
Phụ nữ mắc NSTE-ACS lớn tuổi hơn nam giới và có tần suất mắc bệnh tiểu đường, tăng huyết áp, suy tim và các bệnh đồng mắc khác cao hơn. Các biểu hiện không điển hình, bao gồm triệu chứng khó thở hoặc các triệu chứng của suy tim, thường phổ biến hơn. Mặc dù không có tác dụng điều trị cụ thể cho giới tính được mô tả đối với hầu hết các thuốc điều trị, phụ nữ mắc NSTE-ACS ít có khả năng nhận được các liệu pháp dựa trên bằng chứng bao gồm các thủ thuật chẩn đoán xâm lấn và tái thông mạch vành.
7.3. Đái tháo đường
Đái tháo đường là một yếu tố tiên lượng độc lập về tỷ lệ tử vong. Bệnh động mạch vành thường tổn thương lan tỏa và tỷ lệ tái hẹp cũng như tắc mạch sau PCI (can thiệp mạch vành qua da) và CABG (bắc cầu nối chủ vành) cao hơn. Phương pháp tiếp cận xâm lấn sớm đã được chứng minh là có lợi trong phân nhóm nguy cơ cao này, với lợi ích lớn hơn ở bệnh nhân tiểu đường so với bệnh nhân không bị tiểu đường. Ở những bệnh nhân đái tháo đường tổn thương nhiều mạch, CABG dường như mang lại kết quả tốt hơn so với PCI. Phòng ngừa bệnh thận do thuốc cản quang đặc biệt quan trọng ở những bệnh nhân đái tháo đường được chụp mạch và/hoặc PCI. Chức năng thận nên được theo dõi chặt chẽ sau khi tiếp xúc với thuốc cản quang.
7.4. Bệnh thận mạn tính
Rối loạn chức năng thận có ở 30%-40% bệnh nhân NSTE-ACS. Bệnh thận mạn (CKD) là một yếu tố dự đoán độc lập về tỷ lệ tử vong ngắn hạn và dài hạn và chảy máu nhiều ở bệnh nhân NSTE-ACS. Mặc dù thực tế là bệnh nhân NSTE-ACS và CKD thường ít được trình bày trong các thử nghiệm lâm sàng. Tuy nhiên, cần thận trọng đối với điều trị chống huyết khối về biến chứng chảy máu .
Bệnh nhân bệnh thận mạn có nguy cơ mắc bệnh thận do thuốc cản quang. Nguy cơ này tăng lên ở những bệnh nhân lớn tuổi và mắc bệnh tiểu đường. Trong trường hợp chụp mạch cấp, nguy cơ bệnh thận do thuốc cản quang phải được cân bằng với nguy cơ thiếu máu cục bộ. Uống nước trước (12 giờ) và sau (24 giờ) chụp mạch và/hoặc nong mạch là chiến lược đã được chứng minh là có tác động lớn nhất trong việc giảm nguy cơ mắc bệnh thận này. Lượng thuốc cản quang nên được duy trì < 4 mL/kg.
7.5. Rối loạn chức năng tâm thu thất trái và suy tim
Suy tim là một trong những biến chứng thường gặp nhất và gây tử vong của NSTE-ACS. Ở những bệnh nhân có biểu hiện suy tim mà không có đau ngực, ACS có thể khó chẩn đoán do sự gia tăng troponin liên quan đến suy tim cấp tính. Ở những bệnh nhân này, có thể không thể phân biệt được suy tim cấp đơn thuần với NSTE-ACS có biến chứng suy tim. Chụp động mạch vành hữu ích để phân biệt hai tình trạng này. Bệnh nhân NSTE-ACS và suy tim ít nhận được các liệu pháp dựa trên bằng chứng, bao gồm thuốc chẹn beta và thuốc ức chế men chuyển hoặc thuốc chẹn thụ thể angiotensin (ARB), chụp mạch vành và tái thông mạch. Tất cả các khuyến nghị rút ra từ các nghiên cứu sau nhồi máu cơ tim, có thể được ngoại suy cho bệnh nhân NSTE-ACS bị suy tim.
7.6. Trọng lượng cơ thể
Trọng lượng cơ thể thấp có liên quan đến tăng nguy cơ tử vong hoặc NMCT, và đặc biệt là chảy máu, thường là do dùng thuốc tiêu huyết khối không phù hợp. Mặc dù béo phì có liên quan đến nguy cơ biến cố mạch vành cao hơn, nhưng bệnh nhân béo phì với NSTE-ACS cho kết quả tốt hơn tại bệnh viện và trong 1 năm, bao gồm cả nguy cơ chảy máu thấp hơn, được gọi là “nghịch lý béo phì”.
7.7. Bệnh động mạch vành không tắc nghẽn (MINOCA)
Một tỷ lệ khá lớn bệnh nhân (khoảng 15%) NSTE-ACS có động mạch vành bình thường hoặc tổn thương không tắc nghẽn (MINOCA). Sinh lý bệnh của NSTE-ACS không đồng nhất và các cơ chế có thể xảy ra bao gồm: co thắt động mạch vành (đau thắt ngực Prinzmetal), một mảng xơ vữa nứt vỡ gây huyết khối cấp tính với tái thông sau đó, thuyên tắc mạch vành, bóc tách mạch vành tự phát (SCAD) và “hội chứng X”.
Ở những bệnh nhân nghi ngờ NSTE-ACS, biểu hiện của động mạch vành bình thường hoặc gần bình thường khi chụp mạch là một thách thức chẩn đoán. Tuy nhiên, sự thay đổi đoạn ST và giải phóng dấu ấn sinh học ở bệnh nhân đau ngực điển hình và mạch vành cấp không có dấu hiệu tổn thương đáng kể có thể là do hoại tử thực sự chứ không phải do kết quả dương tính giả, điều này có xu hướng phổ biến hơn ở phụ nữ. Tiên lượng của những bệnh nhân này có vẻ tốt hơn so với những bệnh nhân có NSTE-ACS và xơ vữa động mạch vành đáng kể, và do đó họ xứng đáng với liệu pháp chống huyết khối tối ưu và phòng ngừa thứ phát bằng thuốc kháng kết tập tiểu cầu và statin.
7.8. Chảy máu và truyền máu
Chảy máu là biến chứng thường gặp nhất trong điều trị hội chứng vành cấp. Chảy máu nhiều có liên quan đến nguy cơ tử vong tăng gấp bốn lần, tăng gấp năm lần nguy cơ NMCT tái phát và tăng gấp ba lần đột quỵ sau 30 ngày. Nguy cơ chảy máu là cao nhất trong 30 ngày đầu tiên, nhưng sử dụng lâu dài liệu pháp kháng tiểu cầu mạnh dẫn đến nguy cơ chảy máu kéo dài. Các yếu tố dự báo độc lập của chảy máu lớn là các đặc điểm cơ bản, đặc biệt là tuổi, giới tính nữ, tiền sử chảy máu, nồng độ huyết sắc tố, tiểu đường và suy thận. Nguy cơ chảy máu tăng lên theo số lượng thuốc chống huyết khối được sử dụng, cũng như việc sử dụng đường mạch đùi thay cho mạch quay.
Truyền máu có những tác động bất lợi trong nhiều bệnh cảnh lâm sàng, bao gồm ACS, PCI, phẫu thuật tim và chăm sóc hồi sức. Truyền máu là có lợi nếu giá trị hematocrit <25%. Chỉ truyền máu khi Hb <7 g/dL và mức hemoglobin mục tiêu là 9-10 g/dL, đã được chứng minh là mang lại kết quả lâm sàng tốt hơn so với truyền máu tự do trong trường hợp cấp tính.
7.9. Giảm tiểu cầu
Giảm tiểu cầu được định nghĩa là giảm số lượng tiểu cầu xuống <100 G/L hoặc giảm >50% so với số lượng tiểu cầu ban đầu. Trong điều kiện ACS, có hai loại giảm tiểu cầu chính do thuốc, tức là giảm tiểu cầu do heparin (HIT) và do thuốc ức chế GP IIb/IIIa, với tiên lượng khác nhau cho mỗi loại.
Phải nghi ngờ giảm tiểu cầu do heparin khi số lượng tiểu cầu giảm > 50% hoặc giảm số lượng tiểu cầu xuống <100 G/L. HIT xảy ra ở 15% bệnh nhân được điều trị bằng UFH (Heparin không phân đoạn), ít gặp hơn khi điều trị LMWH (Heparin trọng lượng phân tử thấp), và không thấy khi dùng fondaparinux. Việc ngừng điều trị UFH hoặc LMWH ngay lập tức là bắt buộc ngay khi nghi ngờ có HIT. Liệu pháp chống huyết khối thay thế phải được áp dụng, ngay cả khi không có biến chứng huyết khối.
Giảm tiểu cầu do ức chế thụ thể GP IIb/IIIa đã được báo cáo là xảy ra với tỷ lệ từ 0,5-5,6% trong các thử nghiệm lâm sàng, tùy thuộc vào hợp chất được sử dụng. Chảy máu lớn rất hiếm, nhưng có thể nguy hiểm đến tính mạng. Nếu số lượng tiểu cầu giảm xuống dưới 10 G/L, thì nên ngừng sử dụng các thuốc ức chế thụ thể GP Ilb/Illa cũng như UFH hoặc enoxaparin. Truyền tiểu cầu được chỉ định trong trường hợp chảy máu.
8. TIÊN LƯỢNG
Nhiều thông số lâm sàng, cận lâm sàng dùng để tiên lượng bệnh nhân hội chứng vành cấp như tình trạng lâm sàng lúc nhập viện, troponin, điện tâm đồ,… Tuy nhiên trong thực hành lâm sàng, thang điểm nguy cơ đơn giản có thể thuận tiện và được ưu tiên hơn.
8.1. Thang điểm dự báo nguy cơ biến cố
Trong số một số thang điểm nguy cơ dự đoán nguy cơ ngắn hạn hoặc trung hạn của các biến cố thiếu máu cục bộ, thang điểm GRACE và điểm rủi ro TIMI được sử dụng rộng rãi nhất. Thang điểm GRACE cung cấp phân tầng rủi ro chính xác nhất cả khi nhập viện và khi xuất viện do khả năng phân biệt tốt của nó (Xem thêm Phụ lục: Một số thang điểm thường dùng trong tim mạch can thiệp).
Bảng 18.4. Phân tầng nguy cơ theo thang điểm nguy cơ GRACE
| PHÂN NHÓM NGUY CƠ | ĐIỂM NGUY CƠ GRACE | TỶ LỆ TỬ VONG TRONG BỆNH VIỆN |
| Thấp | ≤108 | < 1% |
| Trung bình | 108 – 140 | 1-3% |
| Cao | > 140 | > 3% |
8.2. Thang điểm nguy cơ chảy máu
Thang điểm CRUSADE được sử dụng trong đánh giá nguy cơ chảy máu ở những bệnh nhân chụp động mạch vành.
Một số thang điểm khác như thang điểm ARC- HBR (Academic research consortium- High Bleeding Risk) hiện được khuyến cáo sử dụng.
Các thang điểm tiên lượng nguy cơ biến cố và tử vong có thể tính toán bằng phần mềm giúp bác sĩ có thể nhanh chóng đánh giá được bệnh nhân.
Bảng 18.5. Thang điểm ARC – HBR trong đánh giá nguy cơ chảy máu. Nguy cơ chảy máu cao nếu có ít nhất 1 tiêu chí chính hoặc 2 tiêu chí phụ.
| TIÊU CHÍ CHÍNH | TIÊU CHÍ PHỤ |
| Sử dụng thuốc chống đông đường uống kéo dài | Tuổi ≥ 75 |
| CKD nặng hoặc giai đoạn cuối (GFR < 30 ml/p) | CKD trung bình (eGFR 30-59 ml/p) |
| Hemoglobin < 110 g/l | Hemoglobin từ 110-129 g/l với nam và 110-119 g/l với nữ |
| Chảy máu tự phát cần nhập viện và/ hoặc truyền máu trong vòng 6 tháng trước hoặc bất kể khi nào nếu tái phát | Chảy máu tự phát cần nhập viện và / hoặc truyền máu trong vòng 12 tháng trước mà không đủ tiêu chuẩn chính |
| Giảm tiểu cầu trung bình – nặng (<100 G/L) | Sử dụng kéo dài NSAID hoặc corticoid |
| Dấu hiệu chảy máu mạn tính | Đột quỵ thiếu máu não bất kể khi nào không đủ tiêu chuẩn chính |
| Xơ gan tăng áp lực tĩnh mạch cửa | |
| Khối ác tính đang hoạt động trong vòng 12 tháng trước (ngoại trừ ung thư da không melanoma) | |
| Chảy máu nội sọ tự phát trước đó bất kể thời gian nào Chảy máu nội sọ do chấn thương trong vòng 12 tháng trước Dị dạng động tĩnh mạch nội sọ Đột quỵ não vừa/nặng trong vòng 6 tháng trước | |
| Phẫu thuật gần đây hoặc chấn thương lớn gần đây trong vòng 30 ngày trước PCI Phẫu thuật khi đang dùng DAPT |
Chú thích: CKD: Bệnh thận mạn tính; GFR: Mức lọc cầu thận; NSAID: Thuốc chống viêm giảm đau Non-steroid. PCI: Can thiệp động mạch vành qua da; DAPT: Liệu pháp kháng kết tập tiểu cầu kép.
9. ĐÁNH GIÁ KẾT QUẢ SAU THỦ THUẬT
9.1. Đánh giá thông qua hình ảnh chụp mạch
Kết quả tưới máu có thể đánh giá ngay trên phim chụp mạch trên mạch vành thượng tâm mạc và mức độ cơ tim.
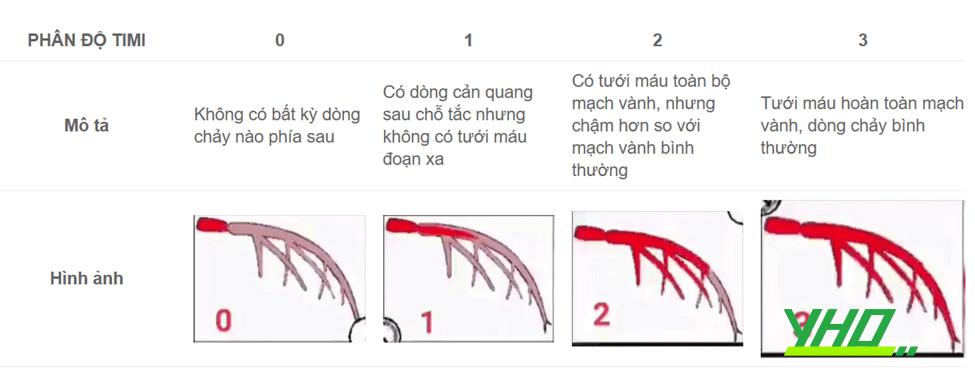
Trong thực hành, dòng chảy mạch vành thượng tâm mạc được đánh giá theo phân độ TIMI gồm 4 mức độ, mô tả sự xuất hiện và tốc độ đổ đầy cản quang ở các mạch máu.
Thành công về mặt chụp mạch khi sau thủ thuật làm rộng lòng mạch tại vị trí can thiệp với đường kính hẹp tối thiểu giảm đi còn <20% và dòng chảy trong ĐMV đạt mức độ TIMI-3.
Bảng 18.6. Phân độ dòng chảy TIMI sau can thiệp
Một công cụ khác được sử dụng nhiều hơn trong nghiên cứu là số khung hình TIMI (TIMI frame count – TFC). Đây là phương pháp đánh giá định lượng dòng chảy, nên ít chủ quan hơn thang TIMI. TFC dựa trên tính toán số khung hình cần để cản quang đi từ đầu tới mốc chuẩn đoạn ngoại vi nhánh thủ phạm.
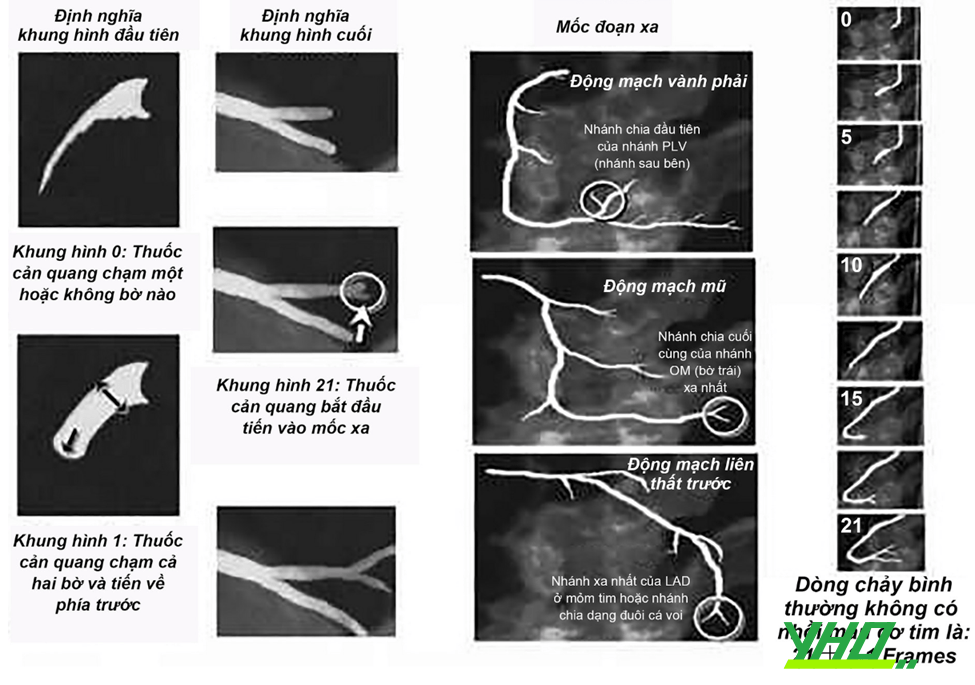 Hình 18.10. Phương pháp đánh giá TIMI frame count (TFC)
Hình 18.10. Phương pháp đánh giá TIMI frame count (TFC)Định nghĩa khung hình (frame) đầu tiên (First frame definition): Một cột thuốc cản quang gần chạm/chạm cả 2 thành của mạch vành và đi về phía trước.
Định nghĩa khung hình cuối (Last frame definition): Khi thuốc cản quang chạm tới (không cần thiết phải đổ đầy) mốc đoạn xa (distal landmark) của mạch khảo sát. Với RCA (Động mạch vành phải) là nhánh chia đầu tiên của nhánh PLV (nhánh sau bên) (1st branch of posterolateral). Với LCx (Động mạch mũ): nhánh chia cuối cùng của nhánh OM (bờ trái) xa nhất (Last branch of most distal OM). Với LAD (động mạch liên thất trước): Nhánh xa nhất của LAD ở mỏm tim hoặc nhánh chia dạng đuôi cá voi (“Whale’s tail” or “pitchfork” or most distal branch of LAD at apex).
Dòng chảy bình thường không có nhồi máu cơ tim là: 21 ± 3,1 Frames (95% CI 14-28 Frames) (Normal flow in the absence of MI: 21 ± 3,1 Frames) mặc dù khác nhau về chiều dài mạch máu, lực bơm, tần số tim, cung lượng tim, độ sâu catheter.
Chú thích:
Khung hình 0: Thuốc cản quang chạm một hoặc không bờ nào (Frame 0: Dye touches one or no borders).
Khung hình 1: Thuốc cản quang chạm cả hai bờ và tiến về phía trước (Frame 1: Dye touches both borders & move forward). Khung hình 21: Thuốc cản quang bắt đầu tiến vào mốc xa (Frame 21: Dye first enters landmark)
Hai thang phân loại khác được đưa ra để đánh giá tưới máu ở mức độ cơ tim. Thang phân loại tưới máu cơ tim TIMI (TMPG) được mô tả bằng nhóm TIMI dựa trên nghiên cứu trên bệnh nhân được tiêu sợi huyết. Trong thang TMPG, sự đổ đầy thuốc và thải thuốc được đánh giá từ ngoại vi tới tổn thương thủ phạm.
Bảng 18.7. Phân độ tưới máu cơ tim TIMI (TIMI myocardial perfusion- TMP)
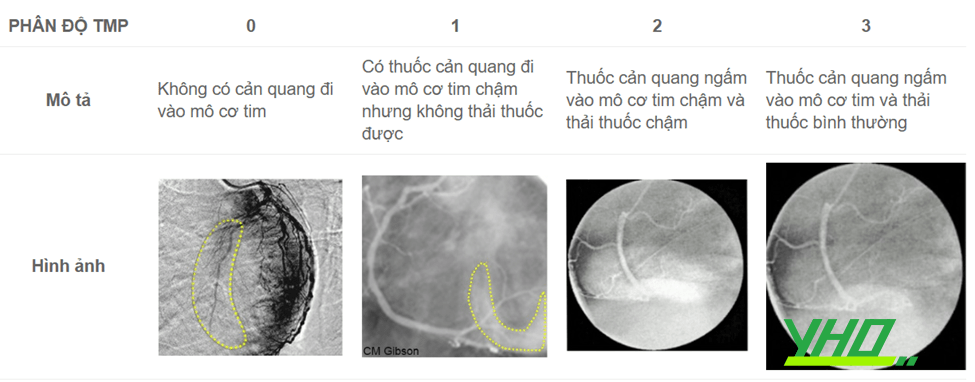
Tất cả các phân độ ở trên đều liên quan chặt chẽ tới kết cục lâm sàng của bệnh nhân, gồm cả tử vong.
9.2. Phương pháp đánh giá tưới máu cơ tim dựa trên đánh giá đoạn ST
Đánh giá đoạn ST sau điều trị tái tưới máu là một thông số thường được sử dụng, liên quan chặt chẽ với kết cục lâm sàng, kể cả tử vong dài hạn.
Thay đổi điện tâm đồ phản ánh tưới máu cơ tim hơn là mạch vành thượng tâm mạc và cung cấp thêm thông tin ngoài các thông số chụp mạch.
Phân tích sự giảm đoạn ST (ST segment resolution) là một trong những phương pháp phổ biến nhất để đánh giá tái tưới máu và được sử dụng rộng rãi trong thực hành lâm sàng.
Có ít nhất 3 cách phân tích đoạn ST. Cách phổ biến nhất là tính tổng độ chênh của đoạn ST tại thời điểm ban đầu và sau khi can thiệp. Hai cách khác là phân tích đoạn ST ở chuyển đạo đơn và độ chênh tối đa của đoạn ST sau can thiệp. Hai cách cuối đơn giản hơn nhưng cả 2 có giá trị tiên lượng chính xác, thậm chí tốt hơn mô hình tổng độ chênh đoạn ST.
10. CÁC BIẾN CHỨNG VÀ XỬ TRÍ
Các biến chứng gặp trong can thiệp bệnh nhân NMCT có ST chênh lên cũng tương tự như can thiệp trong các trường hợp khác như: biến chứng đường vào mạch máu, biến chứng liên quan tới thuốc cản quang, biến chứng liên quan tới quá trình làm thủ thuật,… (Xin xem thêm Chương 25: Các biến chứng của can thiệp động mạch vành và xử trí)
Tuy nhiên, trong bệnh cảnh NMCT có ST chênh lên với gánh nặng huyết khối, biến chứng thường gặp và phổ biến trong bệnh cảnh STEMI là mất dòng chảy “no-reflow” trong và sau can thiệp.
Mất dòng chảy trong lúc PCI có thể là kết quả của tắc nghẽn cấp hoặc hậu quả của mất dòng phía xa. Thuật ngữ “no-reflow” được sử dụng bởi một số tác giả chỉ khi đi kèm với thuyên tắc vi mạch, ngược lại các tác giả khác coi mức độ tưới máu cơ tim (myocardial blush grade) độ 0 và 1 là tương đương với “no-reflow” bất kể TIMI.
Chẩn đoán phân biệt của “no-reflow” bao gồm: co thắt mạch nặng, bóc tách, huyết khối tại chỗ, vỡ mảng xơ vữa, thuyên tắc đoạn xa.
Nếu “no-reflow” là do huyết khối hoặc vỡ mảng xơ vữa mới, hút huyết khối qua ống thông là thích hợp. Chống đông thêm với thuốc ức chế GP IIb/IIIa nên được sử dụng.
Đồng thời kiểm tra lại ACT. Nong bóng và đặt stent có thể cần thiết.
Nếu “no-reflow” là do bóc tách, đặt thêm stent là cần thiết. Nếu “no-reflow” là do co thắt mạch nghiêm trọng, tiêm vào mạch vành nitroglycerin với nồng độ 100μg/ml tới khi giảm co thắt. Mặc dù tiêm nitroglycerin vào trong mạch vành có thể giúp giảm co thắt mạch vành, nhưng nó không có tác dụng trong giảm hiện tượng “no-reflow” do
thuyên tắc vi mạch. Bảng dưới đây liệt kê các thuốc có tác dụng trong “no-reflow”. Thông thường, một vài gam của những thuốc này được tiêm với liều bolus nhỏ 100μg vào trong mạch vành có thể cần thiết.
“No-reflow” do thuyên tắc vi mạch gặp nhiều nhất trong can thiệp graft tĩnh mạch hiển và nhồi máu cơ tim cấp. Miếng lọc đoạn xa hoặc bảo vệ đoạn gần với dụng cụ Proxis có thể giúp giảm gánh nặng thuyên tắc mạch và ngăn ngừa “no-reflow”.
Bảng 18.8. Thuốc trong trường hợp “no-reflow” do thuyên tắc vi mạch
| THUỐC | LIỀU |
| Adenosine | Bolus 1–2 mL nồng độ 100 μg/mL, đánh giá lại dòng chảy và huyết động. |
| Nitroprusside | Bolus 1–2 mL nồng độ 100 μg/mL tiêm mạch vành, đánh giá lại. |
| Verapamil | Bolus 1–2 mL nồng độ 100 μg/mL tiêm mạch vành, đánh giá lại. |
Tiền thích nghi là một trong những thao tác bảo vệ tim mạch mạnh mẽ và có vai trò trong giảm kích cỡ vùng nhồi máu. Nhiều nghiên cứu đã cho thấy, triệu chứng đau ngực trước khi bệnh nhân có biến cố nhồi máu cơ cơ tim cấp có tác dụng bảo vệ bệnh nhân, và đây ít nhất là một hình thức tiền thích nghi chứ không đơn thuần chỉ là việc hình thành thêm tuần hoàn bàng hệ. Đau thắt ngực trước khi NMCT liên quan tới kích thước vùng nhồi máu nhỏ hơn, ít suy tim sung huyết, tử vong, rối loạn nhịp hơn và chức năng tim cải thiện hơn.
Trong can thiệp NMCT cấp, chúng ta có thể tạo tiền thích nghi bằng cách lên bóng và xuống bóng trong thời gian ngắn. Một số nghiên cứu cho thấy thao tác này giảm đau ngực, giảm ST chênh lên, giảm nồng độ CK và lactat. Kỹ thuật can thiệp đã tiến bộ tới mức mà việc nong bóng kết hợp với đặt stent chỉ gây tắc nghẽn mạch vành từ 20-30 giây, gần như không gây thiếu máu cơ tim đáng kể. Stent là một bước khác biệt lớn về vấn đề này, do đó, hiếm khi cần bảo vệ cơ tim đoạn xa trong quá trình làm thủ thuật. Ngoài ra, các catheter tưới máu đoạn xa được thiết kế cho phép dòng máu tới đoạn xa kể cả khi bóng đang bơm. Do đó, ở thời điểm hiện tại, mặc dù tiền thích nghi bằng gây thiếu máu cục bộ có thể hữu ích trong can thiệp mạch vành nguy cơ cao nhưng nó hiếm khi cần sử dụng. Tuy nhiên, tiền thích nghi bằng cách nong bóng vẫn đóng vai trò như một mô hình hữu ích để đánh giá sự tiền thích nghi bằng các thuốc.
Một số thuốc gây tiền thích nghi có thể có tác dụng với các hình thức “no-reflow” hoặc “slow-flow” sau can thiệp. Do đó, nicorandil kết hợp với adenosine cải thiện dòng chảy TIMI, TFC, thang điểm tưới máu cơ tim và kết cục lâm sàng ngắn hạn khi so sánh với adenosine đơn thuần.
Hậu thích nghi là một loạt sự gián đoạn ngắn trong tưới máu cơ tim theo một phác đồ đã được chuẩn bị ở thời điểm rất sớm sau khi tái tưới máu. Zhao và cộng sự cho thấy rằng việc gián đoạn tái tưới máu trong khoảng 1 giờ sau khi tắc nghẽn mạch vành (30 giây tái tưới máu, sau đó làm tắc nghẽn lại 30 giây, lặp lại 3 lần) sau đó tái tưới máu hoàn toàn trong vòng 3 giờ, làm giảm kích thước vùng nhồi máu tương tự như tiền thích nghi. Tác dụng bảo vệ tim mạch này là do cải thiện chức năng nội mô, giảm tạo superoxide mô, giảm chết tế bào cơ tim theo chương trình, giảm tổn thương vi mach.
Hậu thích nghi có thể được áp dụng cho các kỹ thuật can thiệp trong quá trình tái tưới máu cho nhồi máu cơ tim cấp, nhưng cũng có thể áp dụng biện pháp can thiệp thực hiện ở bệnh nhân đau thắt ngực ổn định hoặc không ổn định. Tuy nhiên, một lần nữa, cũng giống như tiền thích nghi với thiếu máu cục bộ là một liệu pháp chưa từng được các bác sĩ can thiệp áp dụng, việc sử dụng các loại stent và stent phủ thuốc sẽ khiến cho việc sử dụng các phác đồ tiền thích nghi thường quy cho các can thiệp ngoài giai đoạn nhồi máu cơ tim cấp tính sẽ khó xảy ra.
(Xem thêm Chương 61: Điều trị tế bào gốc trong suy tim sau nhồi máu cơ tim cấp)
Tế bào gốc là một trong những hướng đi mới đầy hứa hẹn trong điều trị nhồi máu cơ tim. Những dòng tế bào gốc đầu tiên được sử dụng trong tim mạch bao gồm: nguyên bào cơ vân, tế bào gốc tủy xương, tế bào gốc mô mỡ. Thế hệ thứ 2 bao gồm tế bào cơ tim gốc, tế bào gốc dị ghép và gần đây nhất là thế hệ thứ 3 gồm các loại tế bào gốc kết hợp.
Các tế bào gốc này hoạt động dựa trên cơ chế là sửa chữa các tế bào cơ tim bị tổn thương và được đưa vào bằng đường truyền tĩnh mạch ngoại vi, truyền qua đường động mạch vành, tiêm xuyên qua nội tâm mạc, tiêm xuyên qua thượng tâm mạc.
Hiện nay, hầu hết các nghiên cứu đều sử dụng tế bào gốc trung mô lấy từ tủy xương, tiêm vào nhánh động mạch vành thủ phạm đã được can thiệp nong và đặt stent. Các thông số đánh giá thành công của thủ thuật là sự cải thiện phân số tống máu thất trái, sự giảm kích thước vùng nhồi máu. Phân tích gộp của tác giả De Lewi trên 1641 bệnh nhân cho thấy việc tiêm tế bào gốc tủy xương đường động mạch vành giúp cải thiện chức năng thất trái sau nhồi máu cơ tim cấp và bệnh nhân càng trẻ tuổi, chức năng thất trái giảm càng nặng thì kết quả hồi phục càng tốt.
Mặc dù chưa có khuyến cáo sử dụng thường quy trong nhồi máu cơ tim, tuy nhiên liệu pháp tế bào gốc cũng là một hướng mới trong điều trị các tình trạng bệnh lý nặng, trong đó có nhồi máu cơ tim.
11. KẾT LUẬN
Can thiệp mạch vành qua da thì đầu là phương pháp tái tưới máu lựa chọn ưu tiên ở bệnh nhân nhồi máu cơ tim ST chênh lên.
Can thiệp trong bệnh cảnh nhồi máu cơ tim ST chênh lên có nguy cơ cao hơn các biến chứng: thuyên tắc mạch đoạn xa, không có dòng chảy (no-reflow) làm ảnh hưởng tới kết cục lâm sàng.
Liệu pháp thuốc điều trị hiện tại và thiết kế stent mới giúp giảm nguy cơ các biến chứng trên và cải thiện kết cục ngắn và dài hạn.
Liệu pháp tế bào gốc là một hướng đi mới đầy hứa hẹn trong điều trị nhồi máu cơ tim.
TÀI LIỆU THAM KHẢO
- Widimsky P, Wijns W, Fajadet J, et al. Reperfusion therapy for ST elevation acute myocardial infarction in Europe: description of the current situation in 30 countries. Eur Heart J. 2010;31(8):943-957. doi:10.1093/eurheartj/ehp492.
- Clinical characteristics and outcome of patients with early (<2h), intermediate (2–4h) and late (>4h) presentation treated by primary coronary angioplasty or thrombolytic therapy for acute myocardial infarction | European Heart Journal | Oxford Accessed November 30, 2021. https://academic.oup.com/eurheartj/article/23/7/550/457083.
- Nallamothu B, Fox K a. A, Kennelly BM, et al. Relationship of treatment delays and mortality in patients undergoing fibrinolysis and primary percutaneous coronary intervention. The Global Registry of Acute Coronary Events. Heart Br Card Soc. 2007;93(12):1552-1555. doi:10.1136/hrt.2006.112847.
- Aquaro GD, Pingitore A, Strata E, et al. Relation of Pain-to-Balloon Time and Myocardial Infarct Size in Patients Transferred for Primary Percutaneous Coronary Intervention. Am J Cardiol. 2007;100:28-34. doi:10.1016/j.amjcard.2007.02.050.
- Pharmacological Facilitation of Primary Percutaneous Coronary Intervention for Acute Myocardial Infarction: Is the Slope of the Curve the Shape of the Future? | Acute Coronary Syndromes | JAMA | JAMA Network. Accessed November 30, 2021. https://jamanetwork.com/ journals/jama/article-abstract/200421.
- Kent DM, Lau J, Selker Balancing the benefits of primary angioplasty against the benefits of thrombolytic therapy for acute myocardial infarction: the importance of timing. Eff Clin Pract ECP. 2001;4(5):214-220.
- Nallamothu BK, Antman EM, Bates ER. Primary percutaneous coronary intervention versus fibrinolytic therapy in acute myocardial infarction: does the choice of fibrinolytic agent impact on the importance of time-to-treatment? Am J Cardiol. 2004;94(6):772-774. doi:10.1016/j.amjcard.2004.05.064.
- Pinto DS, Kirtane AJ, Nallamothu BK, et al. Hospital delays in reperfusion for ST-elevation myocardial infarction: implications when selecting a reperfusion strategy. Circulation. 2006;114(19):2019-2025. doi:10.1161/CIRCULATIONAHA.106.638353.
- A randomized trial of immediate versus delayed elective angioplasty after intravenous tissue plasminogen activator in acute myocardial infarction – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/2956516/.
- A prospective, placebo-controlled, randomized trial of intravenous streptokinase and angioplasty versus lone angioplasty therapy of acute myocardial infarction – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/1451242/.
- Owen J, Friedman KD, Grossman BA, Wilkins C, Berke AD, Powers ER. Thrombolytic therapy with tissue plasminogen activator or streptokinase induces transient thrombin activity. Blood. 1988;72(2):616-620.
- Marked platelet activation in vivo after intravenous streptokinase in patients with acute myocardial infarction – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/3275505/.
- Beneficial effects of immediate stenting after thrombolysis in acute myocardial infarction – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/12932593/.
- Fernandez-Avilés F, Alonso JJ, Castro-Beiras A, et al. Routine invasive strategy within 24 hours of thrombolysis versus ischaemia-guided conservative approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet Lond Engl. 2004;364(9439):1045-1053. doi:10.1016/S0140-6736(04)17059-1.
- Immediate angioplasty versus standard therapy with rescue angioplasty after thrombolysis in the Combined Abciximab REteplase Stent Study in Acute Myocardial Infarction (CARESS-in-AMI): an open, prospective, randomised, multicentre trial – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/18280326/.
- Routine Early Angioplasty after Fibrinolysis for Acute Myocardial Infarction | Accessed November 30, 2021. https://www.nejm. org/doi/full/10.1056/NEJMoa0808276.
- Fernández-Avilés F, Alonso JJ, Peña G, et al. Primary angioplasty vs. early routine post-fibrinolysis angioplasty for acute myocardial infarction with ST-segment elevation: the GRACIA-2 non-inferiority, randomized, controlled trial. Eur Heart J. 2007;28(8):949-960. doi:10.1093/eurheartj/ehl461.
- Bøhmer E, Hoffmann P, Abdelnoor M, Arnesen H, Halvorsen S. Efficacy and safety of immediate angioplasty versus ischemia-guided management after thrombolysis in acute myocardial infarction in areas with very long transfer distances results of the NORDISTEMI (NORwegian study on DIstrict treatment of ST-elevation myocardial infarction). J Am Coll Cardiol. 2010;55(2):102-110. doi:10.1016/j.jacc.2009.08.007.
- Assessment of the Safety and Efficacy of a New Treatment Strategy with Percutaneous Coronary Intervention (ASSENT-4 PCI) investigators. Primary versus tenecteplase-facilitated percutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet Lond Engl. 2006;367(9510):569-578. doi:10.1016/S0140-6736(06)68147-6.
- Armstrong PW, WEST Steering Committee. A comparison of pharmacologic therapy with/without timely coronary intervention vs. primary percutaneous intervention early after ST-elevation myocardial infarction: the WEST (Which Early ST-elevation myocardial infarction Therapy) study. Eur Heart J. 2006;27(13):1530-1538. doi:10.1093/eurheartj/ehl088.
- Borgia F, Goodman SG, Halvorsen S, et al. Early routine percutaneous coronary intervention after fibrinolysis vs. standard therapy in ST-segment elevation myocardial infarction: a meta-analysis. Eur Heart J. 2010;31(17):2156-2169. doi:10.1093/eurheartj/ehq204.
- Sutton AGC, Campbell PG, Graham R, et al. A randomized trial of rescue angioplasty versus a conservative approach for failed fibrinolysis in ST-segment elevation myocardial infarction: the Middlesbrough Early Revascularization to Limit INfarction (MERLIN) trial. J Am Coll Cardiol. 2004;44(2):287-296. doi:10.1016/j.jacc.2003.12.059
- Rescue Angioplasty after Failed Thrombolytic Therapy for Acute Myocardial Infarction | Accessed November 30, 2021. https:// www.nejm.org/doi/full/10.1056/NEJMoa050849.
- 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC) – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/28886621/.
- Authors/Task Force members, Windecker S, Kolh P, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35(37):2541-2619. doi:10.1093/eurheartj/ehu278.
- Comparison of door‐to‐balloon times for primary PCI using transradial versus transfemoral approach – Pancholy – 2010 – Catheterization and Cardiovascular Interventions – Wiley Online Library. Accessed November 30, 2021. https://onlinelibrary.wiley.com/doi/abs/10.1002/ ccd.22425.
- Arterial access and door-to-balloon times for primary percutaneous coronary intervention in patients presenting with acute ST-elevation myocardial infarction – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/20146306/.
- Siudak Z, Zawislak B, Dziewierz A, et al. Transradial approach in patients with ST-elevation myocardial infarction treated with abciximab results in fewer bleeding complications: data from EUROTRANSFER registry. Coron Artery Dis. 2010;21(5):292-297. doi:10.1097/ MCA.0b013e32833aa6d1.
- Bazemore E, Mann Problems and complications of the transradial approach for coronary interventions: a review. J Invasive Cardiol. 2005;17(3):156-159.
- Transradial versus transfemoral percutaneous coronary intervention in acute myocardial infarction Systematic overview and meta-analysis – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/19853703/.
- Valgimigli M, Gagnor A, Calabró P, et al. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet Lond Engl. 2015;385(9986):2465-2476. doi:10.1016/S0140-6736(15)60292-6.
- A randomized comparison of direct stenting with conventional stent implantation in selected patients with acute myocardial infarction – PubMed. Accessed November 30, 2021. https://pubmed.ncbi.nlm.nih.gov/11755281/.
- Predictors and time-related impact of distal embolization during primary angioplasty – PubMed. Accessed November 30, 2021. https:// pubmed.ncbi.nlm.nih.gov/19153179/.