Bệnh mạch vành trên ECG

I. Mục tiêu học tập
– Khái quát cơ chế và tiến triển của bệnh mạch vành.
– Hiểu được vai trò quan trọng của ECG trong chẩn đoán và điều trị bệnh mạch vành.
– Nắm được các dấu hiệu của bệnh mạch vành trên ECG.
II. Tổng quan
Bệnh mạch vành (CAD) là thuật ngữ mô tả tình trạng xơ vữa mạch vành tiến triển có thể gây tắc hay không tắc mạch [16]. Theo thống kê, ngày nay có khoảng 15.5 triệu người Mỹ trưởng thành có CAD [15]. Bệnh tim thiếu máu cục bộ là thủ phạm gây ra 1.8 triệu trường hợp tử vong/năm, chiếm 20% trường hợp tử vong do mọi nguyên nhân ở châu Âu [14].
Bệnh mạch vành bao gồm hội chứng vành cấp (ACS) và hội chứng vành mạn (CCS) [16].
Hội chứng vành mạn (CCS) đã được ESC tách từ thuật ngữ CAD và có hướng dẫn lâm sàng riêng từ năm 2019 [16].
Thuật ngữ hội chứng vành cấp (ACS) nhằm mô tả một nhóm dấu hiệu lâm sàng, cận lâm sàng của tình trạng giảm tưới máu mạch vành làm cho một vùng cơ tim mất khả năng hoạt động bình thường hoặc chết [7].
Bất chấp sự phát triển của công nghệ y học, ECG vẫn là cận lâm sàng bắt buộc và cần phải thực hiện đầu tiên khi một bệnh nhân nhập viện nghi ngờ ACS và đóng vai trò không thể thay thế trong tầm soát, chẩn đoán và phân loại CAD. ECG đơn giản, rẻ tiền, thực hiện nhanh, và sẵn có ở hầu hết cơ sở y tế, nhờ đó ECG giúp bác sỹ đưa ra những quyết định lâm sàng kịp thời nhằm cải thiện tiên lượng sống và giảm biến chứng cho bệnh nhân [9].
III. Phân loại
1. Phân loại lâm sàng:
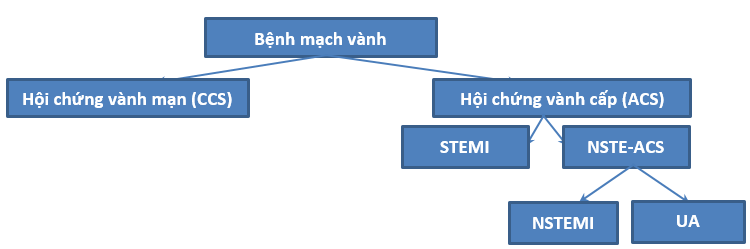
Hình 1. Phân loại bệnh mạch vành
ACS là một thuật ngữ rộng bao gồm các bệnh lý sau:
– Nhồi máu cơ tim ST chênh lên (STEMI)
– Nhồi máu cơ tim không có ST chênh lên (NSTEMI)
– Đau thắt ngực không ổn định (UA)
Trong đó hội chứng vành cấp ST chênh lên (cũng là nhồi máu cơ tim ST chênh lên) phân biệt với hội chứng vành cấp không có ST chênh lên (NSTE-ACS bao gồm NSTEMI và UA) bằng các tiêu chuẩn trên ECG. Còn UA và NSTEMI chỉ có thể phân biệt dựa vào kết quả của dấu ấn sinh học (Troponin) [10].
2. Phân loại nhồi máu cơ tim (MI) theo bệnh học [21]:
– Type 2: MI do mất cân bằng cung/cầu oxy cho mạch vành do các nguyên nhân không phải do bệnh mạch vành xơ vữa.
– Type 3: MI có bằng chứng trên lâm sàng và sự biến đổi ECG hoặc có bằng chứng MI trên mổ tử thi nhưng chưa có kết quả dấu ấn sinh học, chưa kịp làm do bệnh nhân đột tử.
– Type 4, type 5: MI liên quan tới can thiệp mạch vành (type 4) và bắc cầu động mạch vành (type 5).
IV. Cơ chế bệnh học và biến đổi ECG
1. Cơ chế bệnh sinh và tiến triển bệnh mạch vành
Nền tảng trong sinh lý bệnh của bệnh mạch vành là nguyên lý về sự cân bằng cung cầu oxy cơ tim và sự tiến triển xơ vữa.
Nhu cầu oxy cơ tim được xác định dựa vào công cơ tim (workload). Những yếu tố chính tác động trực tiếp lên mức tiêu thụ oxy cơ tim gồm: nhịp tim, sức co cơ tim, và sức căng buồng tim trong thời kỳ tâm thu. Sức căng buồng tim trong kỳ tâm thu phản ánh công cần thiết để tống máu trong kỳ tâm thu. Cả việc giãn buồng tim và tăng áp suất buồng tim đều làm tăng sức căng buồng tim và từ đó làm tăng nhu cầu oxy cơ tim [15].
Trong khi đó việc cung cấp oxy phụ thuộc vào sự tưới máu mạch vành và khả năng khai thác nồng độ oxy máu của cơ tim. Cơ tim có khả năng khai thác sử dụng oxy trong máu rất cao, lên đến 70-75% khi nghỉ và 80% khi gắng sức. Do đó khi gắng sức, nhu cầu oxy tăng cao đòi hỏi phải có sự đáp ứng bằng tăng tưới máu mạch vành [15].
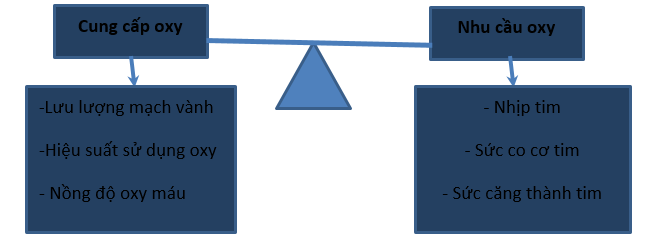
Hình 2. Cân bằng` cung cầu oxy cơ tim [15]
Tình trạng bệnh mạch vành xơ vữa cản trở khả năng tăng tưới máu mạch vành. Dưới tác động của các yếu tố nguy cơ như thuốc lá, rối loạn mỡ máu, béo phì, đái tháo đường, tình trạng xơ vữa tăng dần gây hẹp mạch vành và từ đó gây ra các triệu chứng lâm sàng của CCS.
Phần lớn ACS là hậu quả của tắc nghẽn mạch vành do sự hình thành huyết khối tại vị trí bong mảng xơ vữa. Đi sau các kích thích giao cảm như tăng huyết áp đột ngột, tăng nhịp tim, tăng co bóp và tăng tưới máu động mạch vành gây ra hiện tượng xói mòn, nứt vỡ lớp vỏ bảo vệ tại mảng xơ vữa. Khi bong ra, mảng xơ vữa để lộ các thành phần collagen, mô, nội mô gây kích hoạt tiểu cầu và cuối cùng là sự hình thành huyết khối gây tắc mạch cũng như tiến triển tình trạng thiếu máu cục bộ. Ở bệnh nhân UA, lưu lượng vành vẫn đủ để giữ tế bào cơ tim không bị chết trong khi tình trạng thiếu máu cục bộ dẫn tới hoại tử tế bào cơ tim xảy ra ở STEMI và NSTEMI [15].
Một cơ chế khác là trong MI type 2 đó là MI do mất cân bằng cung cầu tưới máu mạch vành không do bệnh mạch vành xơ vữa. Thường những bệnh nhân này đã có sẵn bệnh mạch vành làm giảm dự trữ vành, giảm khả năng tăng tưới máu vành trong trường hợp thiếu máu nặng, rối loạn nhịp hay các stress khác [21].
Cơ tim vùng nội tâm mạc có một nguồn cấp máu bổ sung so với vùng phía trên nó đó là khả năng nhận máu trực tiếp từ buồng tim. Điều này giúp cho vùng nội tâm mạc được bảo vệ tốt hơn khỏi tình trạng thiếu máu cục bộ. Cơ tim ở tâm nhĩ rất mỏng và hầu như chỉ có nội tâm mạc và lớp dưới nội tâm mạc. tuy nhiên cơ tim tâm thất dày hơn nhiều và chỉ có một lớp tế bào ở trong cùng là được bảo vệ theo cơ chế này. Hệ purkinjer nằm trong lớp tế bào này nên cũng được bảo vệ khá tốt khỏi thiếu máu cục bộ [23].
Hình 3. Minh họa so sánh độ dày tương đối của các lớp cơ tim tại tâm thất và tâm nhĩ [23].
Cơ tim càng dày thì càng nhạy cảm với nhồi máu cơ tim [23]. Công cơ tim thấp nhất ở nhĩ, trung bình ở thất phải và cao nhất ở thất trái. Về mặt lý thuyết, một người với mạch vành bình thường cũng có thể tiến triển tình trạng thiếu máu cục bộ cơ tim nếu công cơ tim tăng lên (tăng huyết áp, tăng nhịp tim) và/hoặc khi nồng độ oxy trong máu không đủ trong khi một người với tình trạng bệnh mạch vành hẹp rất nặng nhưng có thể không có các dấu hiệu của tình trạng thiếu máu cục bộ bởi công cơ tim thấp và máu có nồng độ oxy đảm bảo [23].
Cơ tim tâm thất được nuôi bởi các nhánh mạch vành. Chúng bắt nguồn từ động mạch chủ và chạy dọc theo bề mặt thượng tâm mạc trước khi thâm nhập vào chiều dày cơ tim. Vùng dưới nội tâm mạc là vùng xa xôi nhất nhưng cũng là đơn vị cung cấp sức co nhiều nhất và nhu cầu oxy cao nhất. Vì vậy vùng dưới nội tâm mạc là vùng nhạy cảm nhất với tình trạng thiếu máu cục bộ [23].
Khi xuất hiện tình trạng thiếu máu cục bộ, nguồn oxy cung cấp cho quá trình chuyển hóa của tế bào bị giảm sút. Tế bào cơ tim chuyển sang cơ chế chuyển hóa yếm khí không cần oxy. Tuy nhiên chuyển hóa yếm khí không hiệu quả bằng chuyển hóa hiếu khí, chỉ đủ để duy trì sự sống chứ không thể đảm bảo chức năng. Và cơ chế chuyển hóa này chỉ là tạm thời cho tới khi nguồn cung cấp năng lượng – glucose cạn kiệt [23]. Để duy trì được sự sống, tế bào cơ tim phải tách rời hoạt động điện học khỏi sự co cơ và duy trì trạng thái nghỉ ngơi. Vùng cơ tim bị thiếu máu sẽ không thể thực hiện chức năng co bóp được nữa. Thuật ngữ được mô tả cho trình trạng này là ‘choáng cơ tim’ [23].
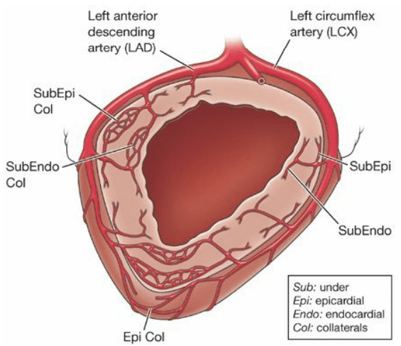
Hình 4. Minh họa phân bố tưới máu của mạch vành. LAD: Động mạch vành trái, LCX: động mạch mũ, Epi: thượng tâm mạc, Endo: nội tâm mạc, SubEpi: dưới thượng tâm mạc, SubEpi Col: tuần hoàn bằng hệ dưới nội tâm mạc, Col: tuần hoàn bàng hệ dưới thượng tâm mạc, SubEndo: dưới nội tâm mạc, SubEndo Col: tuần hoàn bằng hệ dưới nội tâm mạc [23].
2. Những thay đổi trong điện thế tế bào
Hiểu được những biến đổi về điện thế hoạt động tế bào khi có tình trạng thiếu máu cục bộ là cơ sở để hiểu được những biến đổi trên ECG [23]. 4 biến đổi về điện thế hoạt động sau sẽ diễn ra khi có thiếu máu cục bộ [20, 23]:
– Điện thế hoạt động ngắn lại.
– Biên độ điện thế hoạt động giảm
– Pha khử cực của điện thế hoạt động bị kéo dài (tốc độ dẫn truyền giảm)
– Điện thế nghỉ qua màng bớt âm
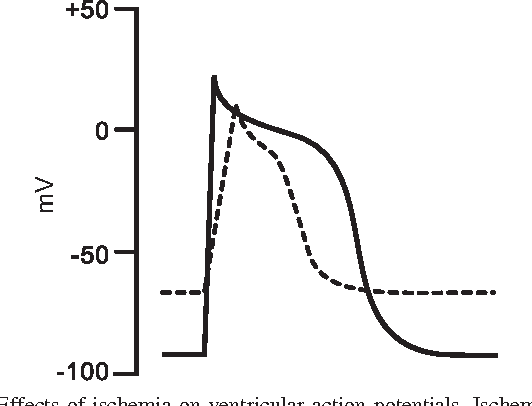
Hình 5. Sự thay đổi về điện thế hoạt động và điện thế nghỉ trong thiếu máu cục bộ giữa vùng bình thường (nét liền) và vùng thiếu máu (nét đứt).
3. Biến đổi trên ECG do thay đổi điện thế tế bào trong thiếu máu cơ tim cục bộ
Ta biết rằng quá trình khử cực cơ tim đi từ nội tâm mạc ra thượng tâm mạc còn quá trình tái cực thì ngược lại. Sự khác biệt về điện thế màng do chiều của các lớp tế bào trong và ngoài tại cùng một thời điểm là lý do chúng ta ghi nhận được hình ảnh trên điện tâm đồ bề mặt. Những biến đổi về điện thế hoạt động và điện thế nghỉ trong tình trạng thiếu máu cục bộ sẽ làm biến đổi hình thái ECG.
Nếu nguyên nhân của thiếu máu cục bộ là do tăng nhu cầu, như những cơ chế đã được nêu trên, vùng bị ảnh hưởng nhất đó là vùng dưới nội tâm mạc thất trái, được gọi với thuật ngữ ‘thiếu máu dưới nội tâm mạc’. Bởi tình trạng tăng nhu cầu này diễn ra trên toàn bộ vùng cơ tim dưới nội tâm mạc thất trái nên sẽ không thể xác định được vị trí cụ thể trên ECG. Thay vì ST và T có xu hướng dịch chuyển về vùng nhồi máu như thiếu máu cục bộ do giảm tưới máu, ở nguyên nhân tăng nhu cầu, ST và T có xu hướng dịch chuyển ra xa vùng thiếu máu cục bộ. Đó là lý do mà ST và T thường âm ở hầu như cả trên 12 chuyển đạo ngoại trừ aVR là chuyển đạo duy nhất sẽ dương khi nhận các dòng điện đi ra xa vùng dưới nội tâm mạc thất trái nên có thể có ST chênh lên và tăng biên độ sóng T khi có tình trạng thiếu máu cục bộ do tăng nhu cầu [23]. Đây là hình thái chúng ta sẽ thường gặp ở bệnh nhân bệnh mạch vành khi gắng sức hoặc khi làm test gắng sức.

Hình 6. Biến đổi ECG do bất thường tưới máu. A, thiếu máu dưới nội tâm mạc do tăng nhu cầu. B, Thiếu máu xuyên thành do tắc mạch vành. Mũi tên chỉ xu hướng dịch chuyển của ST [23].

Hình 7. Minh họa ảnh hưởng của biến đổi điện thế tế bào lên sự thay đổi sóng T trên ECG. Trái: Sự hình thành sóng T bình thường. Phải: Sóng T đảo trong thiếu máu vùng dưới nội tâm mạc. Endo: vùng nội tâm mạc, Epi: vùng thượng tâm mạc [18].

Hình 8. Minh họa ảnh hưởng của biến đổi điện thế tế bào lên sự thay đổi sóng T trên ECG. Trái: Sóng T tăng biên độ (hay sóng T khổng lồ cấp) trong thiếu máu cơ tim xuyên thành. Phải: Sóng T đảo trong thiếu máu xuyên thành ở giai đoạn muộn. Endo: vùng nội tâm mạc, Epi: vùng thượng tâm mạc [18].
Những biến đổi ECG tại những chuyển đạo nằm trên vùng thiếu máu cục bộ do thiếu máu cục bộ xuyên thành [23]:
– Thời gian điện thế hoạt động ngắn lại làm biên độ sóng T tăng lên.
– Biên độ điện thế hoạt động giảm làm ST chênh lên.
– Thời gian pha khử cực tăng do khử cực bị trì hoãn làm phức bộ QRS trở nên dương hơn (tăng biên độ sóng R và giảm biên độ sóng S).

Hình 9. Hình ảnh chuyển đạo V2 mô tả 3 mức độ của thiếu máu cơ tim cục bộ do giảm tưới máu theo thang điểm của Sclarovsky-Birnbaum. A, Độ 1: Sóng T tăng biên độ. B, Độ 2: Sóng T tăng biên độ kèm ST chênh lên. C, Độ 3: Có biến đổi ở cả sóng T, đoạn ST và QRS (Tăng biên độ sóng R, giảm biên độ sóng S) –Hình ảnh dạng bia mộ [23].
Diễn tiến ECG từ thiếu máu cơ tim xuyên thành tới nhồi máu cơ tim với khởi đầu là sóng T khổng lồ cấp (hyperacute T wave). Sau đó là ST chênh lên, cả ST và T chênh lên đều dịch chuyển về phía vùng nhồi máu. Khi sự trì hoãn trong khử cực xuất hiện, QRS bắt đầu dương lên về phía vùng nhồi máu (tăng biên độ sóng R, giảm biên độ sóng S). Nếu tình trạng tắc mạch tồn tại kéo dài, tình trạng hoại tử xuất hiện. Khi quá trình hoại tử tiến triển, cả QRS và T đều có xu hướng dịch chuyển đi xa khỏi vùng nhồi máu. Sự xuất hiện của sóng Q bất thường là dấu hiệu của tình trạng nhồi máu đã thực sự diễn ra và sóng T đảo lúc này gọi là ‘sóng T sau thiếu máu cục bộ’ [23].

Hình 10. Diễn tiến của thiếu máu cục bộ theo thời gian. A, giai đoạn sớm của thiếu máu cục bộ xuyên thành với sóng T khổng lồ cấp, mũi tên chỉ hướng dịch chuyển của sóng T. B, giai đoạn theo sau đó là ST chênh lên, mũi tên chỉ hướng dịch chuyển của sóng T và đoạn ST. C, Giai đoạn sau nhồi máu (khi các tế bào đã chết), triến triển sóng Q và sóng T đảo chiều, mũi tên chỉ hướng dịch chuyển của sóng Q và T [23].
4. Hình thái biến đổi ECG của hoại tử cơ tim
Quá trình thiếu máu cục bộ kéo dài sẽ dẫn tới sự chết tế bào – hoại tử cơ tim. Hình thái của hoại tử cơ tim đặc trưng bởi sự hình thành sóng Q [12]. Ngày nay chúng ta biết rằng có rất nhiều trường hợp bệnh nhân có MI nhưng lại không có sự hình thành sóng Q. Hơn nữa, sóng Q khi đã hình thành cũng có thể biến mất sau một thời gian. Điều này gợi ý rằng sóng Q cũng có thể hình thành sau quá trình tái tưới máu và là bằng chứng của tình trạng choáng cơ tim chứ không hẳn là do hoại tử cơ tim [12].
V. Hội chứng vành cấp ST chênh lên
1. Tiêu chuẩn ST chênh lên trên ECG
Các tiêu chuẩn dưới đây được tính toán trên ECG đo ở cài đặt 10mm/mV, nghĩa là 1 mm = 0.1mV tương đương 1 ô nhỏ trên trục dọc [14].

Hình 11. ST chênh lên trong STEMI có rất nhiều hình dạng, từ chênh lồi, chênh lõm, có bình nguyên hay dạng dốc. Mũi tên chỉ vào các vị trí xác định điểm J [8].

Hình 12. Một trường hợp STEMI thành trước và thành dưới với ST chênh lên ở V1-V3. Sóng T đảo ở tất cả các chuyển đạo trước tim và V1. Các chuyển đạo thành dưới (DII, DIII, avF) có ST chênh lên và sóng T đảo ngược [20].
Ở bệnh nhân nhồi máu cơ tim thành dưới, khuyến cáo đo thêm các chuyển đạo ngực bên phải V3R, V4R nhằm xác định nhồi máu thất phải [14].

Hình 13. Cách mắc các chuyển đạo bên phải nhằm đánh giá thất phải

Hình 14. ECG ghi trên cùng một bệnh nhân. A, Nhồi máu cơ tim thành sau dưới với ST chênh lên ở DII, DIII, aVF và ST chênh xuống soi gương ở aVL. ST âm và T đảo chiều ở các chuyển đạo trước ngực. B, bệnh nhân được đo thêm các chuyển đạo ngực bên phải (V1R-V6R) cho thấy ST chênh lên ở V3R-V6R khoảng 1mm. Chẩn đoán nhồi máu thất phải được thiết lập [9].
Ở bệnh nhân có block nhánh trái (LBBB), việc chẩn đoán AMI khó khăn hơn. Nhiều lưu đồ chẩn đoán được đưa ra nhưng hiệu quả là chưa chắc chắn [14]. Hướng dẫn STEMI của ESC 2018 đưa ra tiêu chuẩn nếu đoạn ST chênh lên đồng hướng (ở chuyển đạo mà QRS có biên độ dương) là một dấu hiệu gợi ý mạnh tới nhồi máu cơ tim [14].
ESC cũng lưu ý rằng, LBBB mới xuất hiện không phải là một dấu hiệu dự đoán nhồi máu cơ tim như những suy nghĩ trước đây [14]. Các nghiên cứu mới cho thấy một bệnh nhân vào nhập khoa cấp cứu với một tình trạng LBBB mới xuất hiện cũng không làm tăng tỷ lệ mắc AMI [1].
Một vài tiêu chuẩn để cải thiện độ chính xác khi chẩn đoán nhồi máu cơ tim ở bệnh nhân có LBBB [14]:
– ST chênh xuống đồng hướng ≥ 1mm ở chuyển đạo V1-V3.
– Đoạn ST chênh lên đồng hướng ≥ 5mm ở chuyển đạo có QRS âm.
Tương tự với bệnh nhân đặt máy tạo nhịp cũng có thể làm mất các dấu hiệu để chẩn đoán nhồi máu cơ tim và có thể phải chụp mạch vành ngay nếu nghi ngờ nhiều hoặc cài đặt lại máy tạo nhịp để đánh giá sự biến đổi động học của ECG nhằm chẩn đoán mà không bị trì hoãn thời gian. Bởi ECG ở bệnh nhân đặt máy tạo nhịp thường có dạng LBBB nên có thể áp dụng tiêu chuẩn ở trên nhưng độ đặc hiệu thấp [14].

Hình 15. Tiêu chuẩn Sgarbossa chẩn đoán nhồi máu cơ tim ở bệnh nhân có LBBB hoặc máy tạo nhịp. 3 tiêu chí được áp dụng gồm: ST chênh lên đồng hướng >1mm ở chuyển đạo có phức bộ QRS dương (5 điểm), ST chênh xuống đồng hướng >1mm với QRS ở V1-V3 (3 điểm), ST chênh lên nghịch hướng >5mm với QRS ở chuyển đạo có QRS âm (2 điểm). Tổng số điểm ≥3 có giá trị chẩn đoán nhồi máu cơ tim với độ đặc hiệu 90% nhưng độ nhạy không cao.
● ST chênh lên đồng hướng ≥ 1mm ở ≥1 chuyển đạo.
● ST chênh xuống đồng hướng ≥1mm ở ≥ 1 chuyển đạo ở V1-V3
● ST chênh lên ngược chiều QRS đáng kể ở ít nhất 1 chuyển đạo với ST chênh lên ≥ 1mm và ≥ 25% chiều sâu sóng S.

Hình 16. ECG của một bệnh nhân nam 60 tuổi vào viện vì đau ngực. ST chênh lên đồng hướng ở V5-V6 và ST ngược hướng QRS ở V2, V3 V4. Kết quả chụp mạch vành: tắc đoạn gần LAD.
Bệnh nhân nhồi máu cơ tim và có block nhánh phải (RBBB) là một dấu hiệu tiên lượng xấu và rất khó để xác định được nhồi máu cơ tim xuyên thành ở bệnh nhân có đau ngực kèm RBBB, do vậy ESC 2018 khuyến cáo nên cân nhắc PCI tiên phát cho bệnh nhân có các triệu chứng đau thắt ngực dai dẳng và có RBBB trên ECG [14].
● Tìm một chuyển đạo mà ở đó dễ dàng đo đạc khoảng thời gian QRS nhất.
● Sử khoảng thời gian QRS đã xác định được ở trên để áp vào chuyển đạo cần đánh giá ST. Điểm cuối của QRS đó chính là ST.
● Do RBBB làm cho QRS kéo dài, quá trình tái cực nhĩ cũng sẽ diễn ra hoàn toàn tại điểm cuối của QRS. Do đó việc đo đạc ST chênh tại vị trí khởi đầu ST là chính xác.

Hình 17. ECG của một bệnh nhân nam 27 tuổi tiền sử phẫu thuật tứ chứng Fallot vào viện vì đau ngực. ECG có QRS giãn rông dạng RBBB hoàn toàn. Sóng Q ở V1-V4 gợi ý MI cũ hoặc mới. Khoảng thời gian QRS đo được ở V2, V3 hoặc DII, DIII là 133ms. Khi đặt vào V4-V6 cho thấy ST sau khoảng thời gian QRS này có ST chênh lên. Kết quả chụp mạch vành: Tắc LAD [19].
Hình ảnh soi gương là một trong những dấu hiệu quan trọng nhất cần xác định trên ECG nghi ngờ STEMI. Hình ảnh soi gương giúp phân biệt với các nguyên nhân gây ST chênh khác. Như tên gọi, hình ảnh soi gương là thuật ngữ chỉ dấu hiệu ST âm ở chuyển đạo đối diện với chuyển đạo có ST chênh lên [8].

Hình 18. Ví dụ minh họa về hình ảnh soi gương trong STEMI. Chuyển đạo DIII và aVL gần như đối xứng nhau trên trục, do đó có hình ảnh ST âm soi gương tại aVL khi chuyển đạo DIII ghi nhận ST chênh lên trong STEMI [8].
2. Định khu tổn thương
Nắm vững các vị trí chuyến đạo cũng như giải phẫu mạch vành giúp các bác sỹ có thể định khu tổn thương mà không cần phải học thuộc lòng, tóm tắt như sau [19]:
● aVL là chuyển đạo tốt nhất để đánh giá thành bên cao và do đó nó là chuyển đạo nhạy nhất đối với MI thành bên. Chú ý, DI, V5, V6 cũng có thể sử dụng để đánh giá thành bên.
● V1 thường dùng để đánh giá nhồi máu vách (thường kết hợp với nhồi máu cơ tim thành trước). Ngoài ra trong nhồi máu cơ tim thất phải, ST có thể chênh lên ở V1.
● V1-V2 (có thể cả V3-V4) đối diện với thành sau thất trái.
● V2-V4 được đặt trực tiếp phía trên vùng thành trước tim, do vậy dùng để đánh giá nhồi máu cơ tim thành trước.
● Chuyển đạo bổ sung: V7, V8, V9 được đặt ở nách sau và phía sau lồng ngực nhằm quan sát trực tiếp thành sau thất trái trong khi các chuyển đạo bên phải V1R-V6R nhằm đánh giá thất phải.
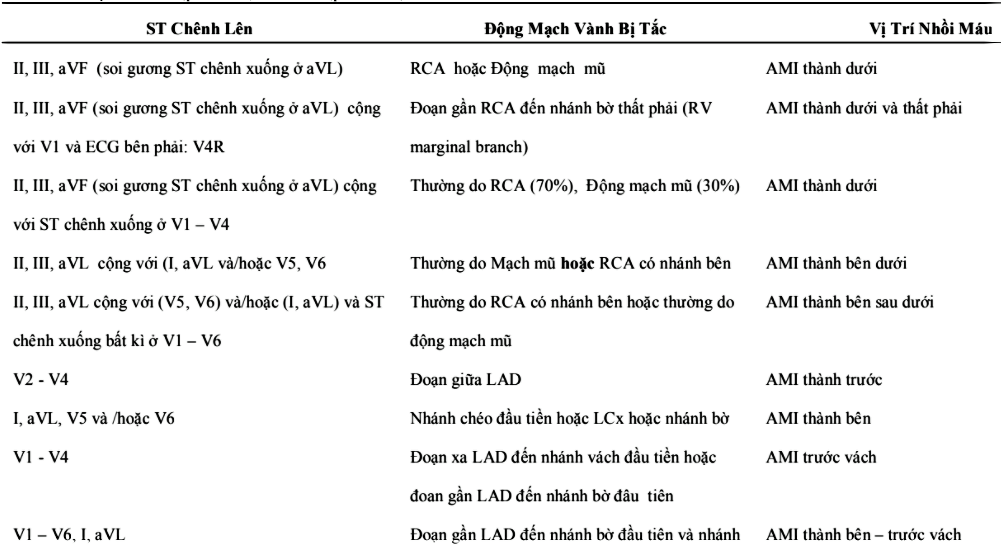
Bảng 1. Tóm tắt các chuyển đạo đánh giá cụ thể từng vùng cơ tim tương ứng với mạch vành chi phối [19].

Hình 19. Giải phẫu động mạch vành trái gồm thân chung động mạch vành (LMCA) tách ra động mạch mũ (LCx), động mạch liên thất trước (LAD) và các nhánh con của chúng.

Hình 20. Giải phẫu động mạch vành phải (RCA)
TẮC ĐỘNG MẠCH LIÊN THẤT TRƯỚC (LAD)
LAD cấp máu cho vùng thành trước, trước bên và phần lớn vách liên thất. Đôi khi LAD kéo dài có thể đi xuống cấp máu cho thành dưới, gọi là “wraparound LAD” [19].
Theo Wellens et al. [20], vùng cơ tim được nuôi bởi LAD gồm 3 phần chính: (1) Vách liên thất do nhánh vách 1 cấp máu, (2) Thành bên do nhánh chéo 1 (hoặc nhánh bờ của LCx) cấp máu, (3) phần mỏm do đoạn xa LAD cấp máu. Tắc từng vị trí trên LAD sẽ cho những biến đổi khác nhau trên ECG.
Do phía sau đoạn gần có nhánh chéo 1 và nhánh vách 1 nên tắc đoạn gần LAD sẽ gây nhồi máu cơ tim thành trước-bên, trước-vách hay thành trước-bên-vách. Do có nhồi máu vách, sẽ có thế có ST chênh lên ở aVR, bất kì một ST chênh lên nào ở aVR đều gợi ý tắc đoạn gần LAD tới nhánh vách đầu tiên với độ nhạy 43% và độ đặc hiệu 95% [19].
Tắc đoạn giữa LAD sẽ không ảnh hưởng tới nhánh chéo 1 và nhánh vách 1 nên thường là nhồi máu cơ tim thành trước [19].
Tắc nhánh chéo 1 của LAD thường gây ST chênh lên ở DI và aVL và ít hơn ở các chuyển đạo trước ngực [20].
Tắc nhánh vách của LAD thường gây ST chênh lên ở V1, V2 và hình ảnh soi gương ở DII, DIII, aVF, V5, V6 [20].

Hình 21. ECG của một bệnh nhân nam 71 tuổi được chẩn đoán STEMI thành trước rộng (thành bên và trước vách) do tắc đoạn gần LAD. ECG có ST chênh lên ở DI và aVL, V1-V5. ST chênh xuống soi gương ở DIII và aVF [20]. Ngoài ra sóng R cũng chiếm ưu thế trong phức bộ QRS ở V2-V6.

Hình 22. ECG của một bệnh nhân nữ 47 tuổi với STEMI do tắc hoàn toàn nhánh chéo 1 và hẹp 40% đoạn giữa LAD. EF của bệnh nhân còn 25%. ECG cho thấy hình thái của nhồi máu cơ tim thành trước trên với ST chênh lên ở DI, aVL, V2-V4 và soi gương ở DII, DIII, aVF [20].
NHỒI MÁU VÙNG THÀNH SAU DƯỚI VÀ THẤT PHẢI
Liên quan tới MI vùng sau dưới và thất phải là động mạch vành phải (RCA) và động mạch mũ (LCx). Mặc dù theo nghiên cứu, cả 2 động mạch này cùng tham gia tưới máu cho khu vực thành dưới nhưng RCA có xu hướng chi phối vùng dưới vách liên thất trong khi LCx chi phối thành sau và thành bên [20]. Do đó, Tắc RCA thường có xu hướng ST chênh lên ở thành dưới lệch phải trong khi LCx lệch trái với biểu hiện cụ thể trên ECG là ST chênh lên ở DIII>DII. RCA cấp máu chủ yếu cho thành dưới tới 80-85% trường hợp, được gọi là ‘động mạch vành phải ưu thế’, 20% trường hợp là nhánh liên thất sau của LCx chi phối được gọi là ‘động mạch vành trái ưu thế’ [19].
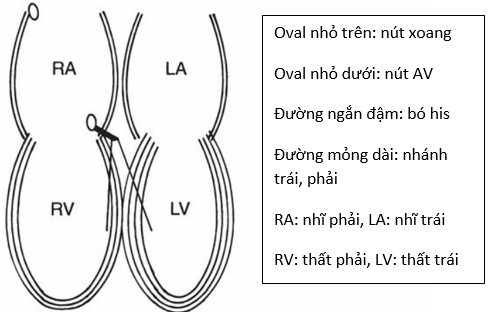
Trong mối liên quan với RCA và LCx còn có sự tưới máu cho nút xoang và nút AV. Cả 2 cùng được nuôi bởi RCA hoặc LCx. Nút xoang được cấp máu từ RCA (trong 50% trường hợp) hoặc LCx (50% trường hợp) trong khi nút AV được tưới máu bởi một nhánh tách ra từ đoạn gần RCA (90% trường hợp) hoặc LCx (10% trường hợp) [12].
– DII, DIII, aVF là các chuyển đạo đánh giá thành dưới. aVL là chuyển đạo soi gương của DIII.
– Luôn tìm kiếm các dấu hiệu của nhồi máu cơ tim thất phải: ST chênh lên ở V1 và có thể chênh xuống soi gương ở V5, V6 và luôn ghi các chuyển đạo bên phải [19].
– Trên một bệnh nhân nhồi máu thành dưới với ST chênh lên ở DII, DIII, aVF nhưng kèm theo ST chênh lên ở aVL, DI gợi ý nguyên nhân tắc LCx trên bệnh nhân động mạch vành trái ưu thế [20].

Hình 23. ECG của một bệnh nhân nam 57 tuổi với chẩn đoán STEMI thành dưới do tắc động mạch vành phải (RCA). Để ý tới ST chênh lên ở các chuyển đạo DII, DIII, aVF. Hình ảnh soi gương ở D1, aVL,V1, V2. Ngoài ra PQ kéo dài 280ms cho thấy có block AV cấp 1. Đây là dấu hiệu gợi ý tới tổn thương nút AV do tắc đoạn gần RCA [9]. ST chênh xuống ở V1-V2 gợi ý nhồi máu cơ tim thành sau sẽ được phân tích dưới đây.
Nhồi máu cơ tim thành sau đơn độc thường ít gặp và thường đi kèm với tổn thương vùng khác như thành dưới – thất phải khi tắc RCA hoặc thành bên khi tắc LCx. Tắc một trong 2 động mạch này có thể gây nhồi máu cơ tim thành sau bất kể ‘ưu thế’. 12 chuyển đạo chính thức của ECG không có chuyển đạo nào đánh giá trực tiếp thành sau. Thay vào đó, chúng ta đánh giá thành sau bằng chuyển đạo soi gương (các chuyển đạo trước ngực từ V1-V6) và các chuyển đạo tăng cường (V7-V9). Vì vậy, nhồi máu cơ tim thành sau đơn độc không đáp ứng đủ các tiêu chí theo tiêu chuẩn STEMI điển hình và dễ bị bỏ sót trên lâm sàng [19].
– ST chênh xuống liên tục từ V1-V4, có thể kéo dài tới V5, V6 gợi ý MI thành sau đơn độc [19].
– ST chênh xuống ≥ 2mm ở bát kì chuyển đạo nào ở V1-V3 có độ đặc hiệu 90% với MI thành sau. ST chênh xuống ở V4-V6 có giá trị thấp hơn [19].
– Độ nhạy của các chuyển đạo V7-V9 là chưa rõ nhưng độ đặc hiệu rất cao, gần như 100% khi ST chênh lên ≥ 1mm [19].

Hình 24. ECG của một bệnh nhân nam 56 tuổi tiền sử CABG. ECG có các biểu hiện chậm dẫn truyền trong thất với QRS = 135ms, ST chênh xuống ở V2-V6, DII, DIII, aVF gợi ý MI thành sau bên [19].

Hình 25. ECG của một bệnh nhân nam 76 tuổi sau nong LAD 1 tuần vào viện với tình trạng shock, phù phổi cấp, suy hô hấp. ECG có sóng Q ở V3-V6 gợi ý nhồi máu cơ tim cũ thành trước bên kèm theo ST chênh xuống sâu ở V1-V4 gợi ý MI thành sau [19].
Nhồi máu cơ tim thất phải thường xảy ra đồng thời với nhồi máu cơ tim thành dưới, và việc xử trí ban đầu cho MI thất phải có những lưu ý đặc biệt do vậy luôn phải tìm kiếm các dấu hiệu của MI thất phải ở bệnh nhân nhồi máu cơ tim thành dưới [19].
Thất phải được cấp máu bởi nhánh bờ thất phải của RCA và một phần nhỏ từ LAD [19]. Tắc đoạn gần LAD có thể gây MI thành dưới kèm MI thất phải trong khi tắc nhánh bờ thất phải gây MI thất phải đơn thuần sẽ ít gặp hơn [19].
Các dấu hiệu của MI thất phải [19]:
– Trong bối cảnh đồng thời có MI thành dưới, ST chênh lên ở V1, ST chênh xuống ở V5-V6 gợi ý tới MI thất phải. ST chênh lên ở V2-V5 có thể gặp ở MI thất phải rộng, phân biệt với MI thành trước thất trái với ST chênh lên giảm dần từ V2-V5 (trong khi MI thành trước thất trái chênh cao nhất ở V2-V4).
– Trong bối cảnh xảy ra đồng thời MI thành sau dưới, ST chênh lên ở V1 có thể bị che khuất (do MI thành sau) đồng thời ST chênh xuống do MI thành sau cũng bị che khuất bởi ST chênh lên trong MI thất phải. đây là một trường hợp rất khó khăn để nhận biết trên ECG.
– Tại các chuyển đạo bên phải, V3R và V4R là nhạy nhất. Tuy nhiên cũng có thể bị che khuất bởi MI thành sau.

Hình 26. ECG ghi các chuyển đạo bên phải với ST chênh lên ở DII, DIII, aVF và chênh xuống soi gương ở DI, aVL. Ngoài ra ST chênh lên ở các chuyển đạo V1R-V6R. Chẩn đoán MI thất phải – thành dưới [19].

Hình 27. ECG của cùng một bệnh nhân nam 67 tuổi. ECG trên: ST chênh lên ở DII, DIII, aVF, ST chênh xuống soi gương tại DI, aVL gợi ý MI thành dưới. ST chênh xuống ở V1-V6 gợi ý MI tim thành sau, nhưng ST chênh xuống ở V4-V6 cũng có thể là biểu hiện của hình ảnh soi gương MI thất phải hoặc thiếu máu cục bộ do động mạch vành trái. ECG dưới được ghi ở các chuyển đạo bên phải V1R-V6R cho thấy ST chênh lên ở V1R-V6R khẳng định MI thất phải bị che khuất [19].
NHỒI MÁU CƠ TIM THÀNH BÊN
Thành bên thất trái được cấp máu bởi LCx và nhánh bờ của nó và nhánh chéo 1 của LAD (đã được phân tích một phần ở trên). Đôi khi các nhánh của RCA cũng chi phối một phần thành bên trong trường hợp RCA ưu thế rộng [19].
MI thành bên thường có hình ảnh ST chênh lên ở DI, aVL, đôi khi ở V5, V6. Một số trường hợp chỉ chênh lên đơn độc ở aVL khi nhồi máu thành bên cao và thường bị bỏ qua [19].
ST chênh xuống soi gương ở DI, DII, aVF có thể bắt gặp trong MI thành bên. Thường thấy do tắc nhánh chéo 1 của LAD nhưng thường khó quan sát khi tắc LCx do hình ảnh chồng lấp với ST chênh lên do MI thành sau dưới kèm theo.
ST chênh lên trong MI thành bên do tắc LCx thường không cao rõ ràng, thường ≤1mm, thậm chí không chênh lên do thường bị che lấp bởi ảnh hưởng soi gương do nhồi máu thành sau dưới kèm theo [19].
MI thành bên trong bối cảnh tắc đoạn gần LAD (xem lại Hình 21) hoặc tắc nhánh chéo 1 LAD (xem lại Hình 22) đã được mô tả ở trên.

Hình 28. ECG của một bệnh nhân nam 41 tuổi tiền sử MI thành dưới sau đau ngực dữ dội 5 giờ. ECG có sóng Q ở DII, DIII, aVF gợi ý MI trước đó. ST chênh lên ở V2-V4 không đặc trưng, có thể chỉ là biểu hiện của tái cực sớm. ST chênh lên ở aVL cùng hình ảnh soi gương ở DII, DIII, aVF gợi ý chẩn đoán MI thành bên. Kết quả chụp mạch vành cho thấy hẹp mới 99% nhánh bờ thứ 2 của LCx, hẹp nặng LCx và LAD (50-70%) [19].

Hình 29. Hình ảnh ECG của một bệnh nhân 54 tuổi sau đau ngực 1 giờ. ST chênh xuống ở V1-V3 gợi ý MI thành sau. ST chênh lên ở DII, DIII, aVF gợi ý MI thành dưới. ST chênh lên ở V5-V6 gợi ý M thành bên. Không có ST chênh lên ở aVL. Kết quả chụp mạch vành cho thấy tắc LCx tuần hoàn trái ưu thế. Trường hợp này cho thấy ST chênh xuống soi gương ở chuyển đạo thành dưới và ST chênh lên ở DI, aVL trong MI thành bên có thể bị che khuất bởi tổn thương rộng vùng sau dưới [19].
VI. Các dấu hiệu tương đương hội chứng vành cấp ST chênh lên
Có một số trường hợp mà biểu hiện trên ECG có ý nghĩa của tình trạng tắc mạch vành nhưng không đạt đủ các tiêu chí của tiêu chuẩn STEMI truyền thống. Điều này đôi khi làm chậm trễ thực hiện các thủ thuật tái tưới máu mà bệnh nhân đáng được nhận. Vì vậy, các ý kiến chuyên gia gần đây đề xuất các thuật ngữ nhồi máu cơ tim có tắc mạch (OMI) và nhồi máu cơ tim không tắc mạch (NOMI) trong đó mỗi loại OMI và NOMI có thể được chia làm 2 nhóm: (1) STEMI, (2) dấu hiệu tương đương với STEMI [5]. Các bác sỹ lâm sàng nên nhận biết được các dấu hiệu này để có những can thiệp kịp thời cho bệnh nhân.
1. Nhồi máu cơ tim tối cấp
Sóng T khổng lồ tối cấp (hyperacute T wave) là một trong những thay đổi sớm nhất trên ECG của tình trạng thiếu máu cục bộ [9].
Sóng T khổng lồ có đặc trưng: to lớn, có đáy rộng, dạng cân xứng. Sóng T vẫn tiếp tục lớn như vậy kể cả khi đã có ST chênh lên [9].
Sóng T khổng lồ xuất hiện sau 1-2 phút có tắc nghẽn (chỉ sau dấu hiệu QT kéo dài xuất hiện sau chưa đầy 1 phút có tắc nghẽn) và thường tồn tại trong khoảng 30 phút. Tuy vậy trên thực hành lâm sàng dấu hiệu này không thường găp bởi thời điểm ghi nhận ECG đầu tiên thì sóng T khổng lồ khó nhận ra hơn bởi đã có sự tiến triển ST chênh lên hoặc biến mất khi đã có hiện tượng tái thông [9].
Trong MI thành sau bên hoặc thành sau xuyên thành, sóng T khổng lồ tối cấp ở V1-V2 lúc này là hình ảnh của sau tái tưới máu chứ không phải đang tắc. Đó là kết quả của hình ảnh sóng T đảo sau tái tưới máu được ghi nhận ở chuyển đạo đối diện [9].

Hình 30. Hình ảnh ECG cho thấy sóng T khổng lồ tối cấp ở chuyển đạo V4-V6, DI, DII, aVL gợi ý nhồi máu cơ tim thành bên tối cấp [9].

Hình 31. Hình ảnh sóng T cao nhọn đặc trưng của tăng Kali máu có thể gây nhầm lẫn. Lưu ý những đặc điểm của sóng T khổng lồ tối cấp như đáy rộng, cân đối, không có đỉnh nhọn trong khi sóng T của tăng Kali máu cao nhọn, đáy hẹp, QT ngắn [9].
2. Hội chứng Wellens
Hội chứng Wellens được mô tả lần đầu vào năm 1982 bởi Zwaan et al [13].
Đặc trưng của hội chứng này là sự biến đổi trên ECG bao gồm sóng T đảo âm sâu (type A) hoặc sóng T 2 pha đối xứng (type A) ở chuyển đạo V2-V3 [9].
Hình thái ECG này có ý nghĩa tương đương tình trạng tắc đoạn gần LAD đã tái thông (tự nhiên hoặc do can thiệp), với biểu hiện lâm sàng là bệnh nhân có cơn đau ngực nhưng tại thời điểm ghi ECG đã cải thiện [9].
Các tiêu chuẩn cộng thêm vào cho hội chứng Wellens bao gồm: có tiền sử cơn đau thắt ngực, chất chỉ điểm sinh học bình thường hoặc tăng nhẹ, không có sóng Q và ST chênh lên, sóng R tiến triển bình thường ở chuyển đạo trước ngực (sóng R chậm tiến triển sẽ được phân tích ở dưới, phần về sóng Q).
Nghiên cứu cho thấy 75% bệnh nhân có hội chứng Wellens sẽ tiến triển tới MI thành trước rộng trong vòng 1 vài tuần sau khi nhập viện [13]. Một số nghiên cứu khác báo cáo hội chứng Wellens bắt gặp trong trường hợp tắc hoàn toàn hoặc không hoàn toàn LAD. Vì vậy chụp mạch vành và tái thông được khuyến cáo cho trường hợp này.

Hình 32. ECG có biểu hiện đặc trưng của hội chứng wellens type A [9].

Hình 33. ECG của một bệnh nhân được ghi ở 3 thời điểm cho thấy hình thái Wellens có xu hướng dịch chuyển từ type A về type B (mặc dù chưa hoàn toàn) [9].

Hình 34. ECG của một bệnh nhân nữ 45 tuổi vào viện sau khi cơn đau ngực dịu bớt 3 giờ. Hình ảnh hội chứng Wellens type B điển hình với sóng T âm sâu và cân đối. không có sóng Q và ST chênh lên ở chuyển đạo trước ngực [9].
3. Sóng T de Winter
Hình thái ECG đặc biệt này được mô tả lần đầu tiên năm 2008 bởi Winter RJ, et al. Sóng T de Winter có giá trị tương đương với STEMI thành trước nhưng không hề có ST chênh lên [4].
Đặc điểm của sóng T de Winter:
● Sóng T cao, cân đối, chiếm ưu thế ở các chuyển đạo trước ngực
● ST chênh xuống >1mm dạng dốc đi lên đánh giá tại điểm J
● Không có ST chênh lên ở các chuyển đạo trước ngực
● ST chênh lên soi gương ở aVR (0.5-1mm)
● Hình thái STEMI điển hình có thể xuất hiện trước hoặc sau sóng T de Winter

Hình 35. Sóng T de Winter

Hình 36. Một trường hợp có sóng T de Winter điển hình

Hình 37. Một trường hợp có sóng T de Winter nhưng ST chênh xuống có xu hướng nằm ngang hoặc dốc xuống. ST chênh lên nhẹ ở aVR.
4. MI thành sau và MI thất phải
Như đã được phân tích ở những phần trên. 12 chuyển đạo chính không có chuyển đạo nào đánh giá trực tiếp thành sau thất trái. Các chuyển đạo tăng cường như V7, V8, V9 mặc dù độ đặc hiệu rất cao nhưng độ nhạy thấp. do đó MI thành sau thường không có hình ảnh ST chênh lên (xem lại Hình 24, 25). Trong khi MI thành sau xuất hiện trong 15-21% trường hợp MI [22].
Tương tự với MI thất phải. V1 là chuyển đạo duy nhất trong 12 chuyển đạo chính thức có thể đánh giá trực tiếp được thất phải nhưng hoàn toàn có thể bị che khuất bởi MI thành sau xuất hiện kèm theo (vốn rất thường xuyên) (xem lại Hình 27). Nhấn mạnh lại một lần nữa rằng luôn luôn đo các chuyển đạo bên phải khi bệnh nhân có MI thành dưới. Tuy nhiên, việc vắng mặt ST chênh lên ở các chuyển đạo bên phải cũng không được loại trừ MI thất phải.
VII. Hội chứng vành cấp ST không chênh lên
Khác với STEMI, NSTEMI và UA không được mô tả trên một một hình thái ECG. NSTEMI/UA là một chẩn đoán lâm sàng với rất nhiều hình thái ECG khác nhau [20]. NSTEMI và UA chỉ có thể được chẩn đoán phân biệt cho tới khi có bằng chứng về dấu ấn sinh học từ xét nghiệm máu [17].
Về mặt phân tích ECG, dựa vào những cơ chế điện học đã được phân tích ở trên, chúng ta biết có những biến đổi ở đoạn ST, sóng T hay QRS có giá trị gợi ý tới bệnh tim thiếu máu cục bộ ngoài những biến đổi đặc hiệu kiểu STEMI gồm: sóng T đảo, ST chênh xuống, QT kéo dài.
1. Sóng T đảo
Trong một bối cảnh lâm sàng phù hợp, một ghi nhận sóng T đảo có động học, nhất là khi đi kèm với ST chênh xuống, QT kéo dài (>425ms) gợi ý nhiều tới tình trạng bệnh tim thiếu máu cục bộ [9].
T đảo cực kì có giá trị khi biên độ > 1mm và trên >1 chuyển đạo trong vùng mạch vành chi phối, tuy nhiên kể cả là một sóng T đảo đơn độc biên độ thấp nhưng trong một bối cảnh đau ngực chưa phân biệt được nguyên nhân cũng làm tăng nghi ngờ tới ACS [9].
Sóng T đảo đôi khi là dấu hiệu của hiện tượng tái thông mạch (ví dụ trường hợp của hội chứng Wellens) [9].
Sóng T dẹt thường có ý nghĩa là biểu hiện sau thiếu máu cục bộ hơn là đang trong cơn thiếu máu cục bộ. Dù thế biến đổi này xuất hiện trong bối cảnh lâm sàng phù hợp và hoặc có biến đổi động học trên ECG cũng có thể có giá trị gợi ý bệnh tim thiếu máu cục bộ [9, 12].

Hình 38. ECG của một bệnh nhân 45 tuổi sau đau ngực 12 giờ. ECG có sóng T đảo ở aVL. Kết quả chụp mạch vành cho thấy bệnh nhân bị tắc hoàn toàn nhánh bờ của LCx, hẹp 70% đoạn giữa LCx [20].

Hình 39. ECG của một bệnh nhân nữ 50 tuổi sau 1 ngày khởi phát đau ngực ECG cho thấy sóng T đảo lan tỏa ở nhiều chuyển đạo với QT kéo dài (511ms). Bệnh nhân đã được chẩn đoán NSTEMI dựa trên kết quả xét nghiệm máu [20].

Hình 40. Một bệnh nhân nam 55 tuổi đã được chẩn đoán NSTEMI. ECG có sóng T đảo nhẹ và cân đối ở V1-V3. Sóng T phẳng ở V4. Kết quả chụp mạch vành cho thấy hẹp đáng kể đoạn gần LAD [12].
Một số nguyên nhân không do bệnh tim thiếu máu cục bộ cũng có thể gây ra sóng T đảo trên ECG [9]:
● T đảo do dày thất trái thường không cân xứng (đến sớm, đoạn xuống thoải, đoạn lên dốc). T đảo xuất hiện ở các chuyển đạo có ST chênh xuống dạng dốc xuống. Không có T đảo ở V1-V3 và thường có ST chênh lên nhẹ ở V1-V3 đối nghịch với sóng S sâu ở những chuyển đạo này.
● Dày thất phải (RVH): Nên nghi ngờ khi có sự xuất hiện của sóng R chiếm ưu thế ở các đạo trình trước ngực bên phải, sóng S ở V5, V6, hoặc DI, có thể có block nhánh phải hoàn toàn hoặc không hoàn toàn, trục lệch phải. T đảo do dày thất phải có thể có hoặc không có kèm theo ST chênh xuống ở các đạo trình ngực bên phải. trong bối cảnh RVH, ST chênh xuống ở các chuyển đạo ngực bên phải thường là biểu hiện thứ phát của RVH.
● Bệnh cơ tim phì đại: sự thay đổi của đoạn ST và sóng T có thể xuất hiện ở bất kỳ chuyển đạo nào. Một phân nhóm của bệnh cơ tim phì đại là bệnh cơ tim phì đại mỏm đơn độc nên được nhắc tới ở đây vì nó có thể gây nhầm lẫn với các dấu hiệu trên ECG của bệnh nhân thiếu máu cục bộ thành trước gây ra do tổn thương LAD.
● Wolff-Parkinson-White syndrome: Là một tình trạng khử cực bất thường thông qua đường phụ. Nó có thể gây ra tình trạng tái cực bất thường với đoạn ST chênh xuống và/hoặc có sóng T đảo cũng như ST chênh và sóng Q.
2. Đoạn ST chênh xuống
ST chênh xuống tiên phát có thể là do thiếu máu cục bộ vùng dưới nội tâm mạc, hoặc nếu nó chỉ xuất hiện ở các chuyển đạo ngực bên phải thì có thể là do thiếu máu cục bộ thượng tâm mạc hoặc thiếu máu xuyên thành vùng thành sau có hay không có nhồi máu cơ tim (soi gương với ST chênh lên của thành sau). ở những trường hợp đó, ST chênh xuống chỉ khoảng 0.5 mm cũng đã liên quan tới sự tăng tỷ lệ tử vong, và khi ≥ 1.0 mmđặc biệt là ≥ 2 chuyển đạo liên tiếp thì tỷ lệ tử vong của bệnh nhân sẽ tăng lên rất cao [9].

Hình 41. Thiếu máu cục bộ vùng dưới nội tâm mạc với ST chênh xuống ở thành bên, bị hiểu nhầm là do LVH với tái cực bất thường. Kết quả chụp mạch vành cho thấy hẹp 90% nhánh chéo 1 và nhánh bờ của LCx [9].
Dạng ST biến đổi chênh xuống dạng nằm ngang hay dốc xuống rất đặc hiệu cho thiếu máu cục bộ vùng dưới nội tâm mạc. có thể có hay không có T đảo kèm theo. Nếu ecg trước đó của bệnh nhân không có bất thường đoạn ST nhưng sau đó tiến triển thành dạng chênh xuống kiểu nằm ngang hay dốc xuống (≥ 0.05 mV) thì mức độ nghi ngờ thiếu máu cục bộ còn cao hơn nữa, đặc biệt là nếu nó tự khỏi hoặc sau điều trị chống thiếu máu cục bộ. Vì thế, một ECG được ghi từ trước đó của bệnh nhân là rất giá trị [9].
Đoạn ST âm càng rõ và càng trên nhiều chuyển đạo thì càng có khả năng là MI. Lloyd-Jones là các đồng nghiệp đã chứng minh được rằng, ở những bệnh nhân có triệu chứng khó chịu ở ngực mà nghi ngờ MI, odds ratio cho non-STEMI được chẩn đoán bằng CK-MB (không dùng troponin) là 3.3 (1.6–6.9) nếu ST chênh xuống ở ít nhất 3 chuyển đạo và odd ratio là 5.1 (2.2–11.6) nếu ST cũng chênh xuống ở ít nhất 3 chuyển đạo nhưng biên độ ≥ 0.2 mV (2 mm). Ngoài ra, tổng độ chênh của đoạn ST trên tất cả các chuyển đạo (tổng ST chênh lên + ST chênh xuống ở tất cả các chuyển đạo) > 12 mm liên quan tới bệnh lý đa mạch vành hoặc bệnh lý của thân chung động mạch vành, bởi ST chênh xuống thường có biên độ lớn nhất ở V4. Cuối cùng, sự xuất hiện, mức lan rộng và biên độ của ST chênh xuống có vai trò quan trọng trong việc tiên lượng và hỗ trợ đưa ra phương hướng điều trị thích hợp [9].

Hình 42. Hình ảnh ECG của cùng một bệnh nhân NSTEACS. A, ECG ghi nhận trong cơn đau ngực với ST chênh xuống sâu và lan tỏa trên nhiều chuyển đạo, rõ ràng nhất ở V4-V5 với sóng T dương có biên độ cao. ST chênh lên ở aVR và V1. B, ECG ghi nhận lúc nghỉ của bệnh nhân với ST chênh xuống nhẹ ở DI, DII, aVL, V4-V6 và ST chênh lên tinh tế ở aVR. Kết quả chụp mạch vành cho thấy bệnh nhân có bệnh mạch vành 3 thân [12].
3. Sóng U bất thường
Sóng U là một sóng có biên độ thấp, có thể âm hoặc dương, thường chỉ có 1 pha và xuất hiện ngay sau sóng T, thông thường là cùng hướng với sóng T. Vì thế, nó thường dương ở DII, gần như đẳng điện ở aVL và aVR và đôi khi là âm ở DIII và aVF. Khi nó âm ở các đạo trình ngực thì ngụ ý có thể có bệnh tim cấu trúc hoặc thiếu máu cục bộ. Cơ chế xuất hiện sóng U là chưa rõ ràng. Việc xuất hiện sóng U âm, ngoại trừ ở các chuyển đạo aVR, III hoặc aVF, gợi ý bệnh tim thiếu máu cục bộ. Nó đã được mô tả trong các cơn đau ngực biến thái và trong test gắng sức, với một độ đặc hiệu cao (nhưng độ nhạy thấp) cho tình trạng hẹp LAD [12].
Nó cũng có thể xuất hiện ở những bệnh nhân tăng huyết áp không được kiểm soát, sóng U xuất hiện với dạng 2 pha âm- dương, trong khi ở bệnh tim thiếu máu cục bộ thì thường có dạng dương – âm hơn [12].
Ở những bệnh nhân đau ngực, một sóng U âm xuất hiện ở các chuyển đạo trước ngực nên cân nhắc tới tình trạng hẹp LAD cho tới khi được chứng minh là không phải [12].

Hình 43. ECG của một bệnh nhân 89 tuổi nhập viện với cơn mất ý thức. ECG dưới là ECG cũ của bệnh nhân. ECG trên đo tại thời điểm nhập viện với hình ảnh ST chênh xuống nhẹ ở các chuyển đạo thành bên và sóng U âm ở V3-V5. Kết quả chụp mạch vành cho thấy hẹp LAD gần hoàn toàn [12].
VIII. Ý nghĩa của sóng Q
Sóng âm đầu tiên trong phức bộ QRS được gọi là sóng Q. Sóng Q có thể là sinh lý hoặc bệnh lý. Một sóng Q được xem là bệnh lý khi nó rộng ≥ 30ms và sâu ≥ 25% biên độ của sóng R phía sau nó. Chuyển đạo DIII và aVR có thể có sóng Q sâu như vậy nhưng nó không phải Q bệnh lý trong khi sóng Q xuất hiện ở DI, DII, aVL, V4-V6 thường được xem là bất thường [9]. Sóng Q trong MI thường xuất hiện ở trên ít nhất 2 chuyển đạo liên tiếp với chiều sâu ít nhất 1mm. Việc luôn tuân thủ tiêu chuẩn này có thể cho ra những chẩn đoán dương tính giả hoặc âm tính giả [9].
Một số trường hợp ta không thể quan sát thấy sóng Q bệnh lý, thay vào đó là hình ảnh gián tiếp có giá trị tương đương bao gồm [9]:
– Sóng R kém tiến tiển hoặc sóng R tiến triển ngược ở các chuyển đạo trước ngực. Nguyên nhân là sự hình thành sóng Q ở các chuyển đạo có sóng R chiếm ưu thế, sóng Q chồng vào sóng R sau nó làm các sóng R này bị giảm biên độ. Tình trạng này có thể gợi ý MI thành trước (không chẩn đoán). Trường hợp này cần phải chẩn đoán phân biệt với mắc sai điện cực ở ngực, dày thất trái, dày thất phải, bệnh cơ tim giãn và một số hình thái ECG bình thường cũng cho kết quả như vậy. Sóng R kém tiến triển được định nghĩa là sóng R < 2mm ở chuyển đạo V4.
– Sóng R rất cao ở V1-V2 có thể là hình ảnh soi gương của sóng Q bệnh lý do MI thành sau.
Như những phân tích ở phần sinh lý bệnh, sóng Q bệnh lý có thể là hậu quả của tổn thương hoại tử cơ tim không hồi phục cũng có thể là do hiện tượng choáng cơ tim có thể hồi phục nếu được tái tưới máu kịp thời.

Hình 44. Sóng R kém tiến triển do MI thành trước cũ

Hình 45. ECG của một người 36 tuổi không có bệnh lý tim mạch. Sóng Q ở V1-V2 được xem là bình thường [9].

Hình 46. Một trường hợp MI thành trước đến sớm nhưng đã có sóng Q. Có thể thấy ST chênh lên ở V2-V6, DI, chênh nhẹ ở aVL. Sóng Q có thể được quan sát rõ ở V3-V4. Sóng Q xuất hiện sớm ở 50% bệnh nhân MI thành trước nhưng không phải là bằng chứng của nhồi máu sớm mà là hậu quả của thiếu máu cục bộ và bất thường dẫn truyền. Chúng thường biến mất sau khi tái tưới máu thành công [9].
IX. Động học ECG
ECG 12 chuyển đạo tiêu chuẩn là kết quả của sự ghi nhận điện học của tim trong khoảng 10 giây trong khi ACS là một quá trình bệnh học thay đổi liên tục. Một nghiên cứu báo cáo rằng chỉ có 45% bệnh nhân AMI được chẩn đoán với 1 ECG đầu tiên [9]. Do đó, việc ghi nhận chuỗi ECG giúp bác sỹ lâm sàng không bỏ sót chẩn đoán và không bỏ sót diễn biến bệnh.

Hình 47. ECG của cùng một bệnh nhân được ghi cách nhau 90 phút. Kết quả: STEMI thành sau bên do tắc đoạn xa wraparound LAD (nếu bạn đã quên, wraparound LAD là trường hợp tuần hoàn LAD phát triển ưu thế và tưới máu cả thành dưới thất trái). ECG thứ nhất không có gì bất thường, ECG thứ 2 cho thấy ST chênh lên ở DII, DIII, aVF, V4, V5. ST chênh xuống, T đảo soi gương ở aVL [9].
Ngoài ra series ECG cũng được sử dụng nhằm đánh giá sự tái thông, hiệu quả của liệu pháp tái tưới máu. ST giảm chênh >50% sau khi bắt đầu thực hiện liệu pháp tiêu sợi huyết 60-90 phút được xem là dấu hiệu tiên lượng tốt về mặt cải thiện tưới máu cơ tim. ST giảm chênh >70% so với ban đầu cho thấy tái tưới máu hoàn toàn [15].
X. ECG trong hội chứng vành mạn
Những dấu hiệu có thể gặp trong bệnh mạch vành mạn [12]:
● Sóng Q bệnh lý (đã được phân tích ở trên)
● QRS phân mảnh (fQRS): fQRS gồm sự hiện diện của sóng R thêm vào (R’) hoặc chẻ đôi ở chỗ đi xuống của sóng R hoặc sóng S, hoặc có mặt của > R’ (phân đoạn) ở 2 chuyền đạo liên tiếp, tương ứng khu vực động mạch vành lớn [6]. Nguyên nhân của fQRS được cho là sự chậm dẫn truyền trong thất do sẹo cơ tim. Mặc dù không nhạy nhưng fQRS đã được báo cáo cho thấy có giá trị dự báo nguy cơ rối loạn nhịp, suy tim và tử vong [6]. fQRS cũng là một dấu hiệu tiên lượng xấu ở bệnh nhân MI cũ [3]. Tuy nhiên fQRS cũng có thể xuất hiện trong một số bệnh lý khác mà không phải do bệnh mạch vành.

Hình 48. QRS phân mảnh ở DII, DIII, aVF và V4-V6. Ngoài ra có sóng Q ở DI và aVF. Sóng R cao bất thường ở V1 có thể là soi gương sóng Q của thành sau [2].
● Chậm dẫn truyền trong thất: Chậm dẫn truyền trong thất (IVCDs) và block nhánh có thể bắt gặp ở những bệnh nhân không có tiền sử bệnh tim mạch và ở những bệnh nhân có bệnh cơ tim do hoặc không do bệnh tim thiếu máu cục bộ [11]. Một số nghiên cứu cho thấy RBBB có thể là hậu quả của một sẹo cơ tim lớn vùng thành trước-vách ở bệnh nhân có bệnh cơ tim có hay không có bệnh tim thiếu máu cục bộ trong khi LBBB cũng được chứng minh có mối liên quan tới tăng tỷ lệ biến cố tim mạch ở những bệnh nhân có bệnh mạch vành đã biết trước [11]. Mặc dù những thăm dò xâm lấn là không cần thiết nhưng có thể xem xét các xét nghiệm không xâm lấn trong đó có ECG gắng sức để tầm soát cho những bệnh nhân này.
● Ngoại tâm thu thất: Ngoại tâm thu thất (PVC) cũng thường được phát hiện ở những bênh nhân có bệnh mạch vành ổn định. Chúng có thể không có triệu chứng nhưng thường sẽ gây ra các triệu chứng hồi hộp. Các khuyến cáo dựa trên kết quả của nghiên cứu CAST cho thấy việc can thiệp bằng các thuốc chống loạn nhịp để xóa bỏ PVCs ở những bệnh nhân này là nên tránh mà thay vào đó có thể tăng liều các thuốc chẹn beta và chẹn canxi mà bệnh nhân đang dùng [11].
● Biến đổi ST và sóng T đảo hoặc T dẹt: Những biến đổi này có thể bắt gặp ở những bệnh nhân bệnh tim thiếu máu cục bộ ổn định hoặc đang có triệu chứng. Cơ chế hình thành những biến đổi này trên những bệnh nhân ổn định không triệu chứng chưa được hiểu rõ trong khi ở những bệnh nhân gắng sức hay test gắng sức, những biến đổi này là hâu quả của tình trạng thiếu máu cục bộ do tăng nhu cầu oxy. Như những gì chúng ta tìm hiểu ở phần sinh lý bệnh, có những bệnh nhân có bệnh mạch vành nhưng hoàn toàn bình thường về mặt lâm sàng lẫn hình ảnh ECG khi nghỉ ngơi và chỉ xuất hiện khi tim phải gắng sức. Đây chính là mục đích chính của nghiệm pháp gắng sức – tạo ra tình trạng thiếu máu cục bộ trong kiểm soát.
● Những biến đổi ECG trong test gắng sức
– ST chênh xuống: Dấu hiệu dương tính với bệnh tim thiếu máu cục bộ được định nghĩa là xuất hiện ST chênh xuống dạng nằm ngang hoặc dốc xuống tối thiểu 1mm ( 0.1mV) ở 3 nhịp liên tiếp trên ít nhất 1 chuyển đạo ECG. Đoạn PQ được dùng làm chuẩn cho đường đẳng điện và độ sâu của ST chênh xuống được tính ở vị trí 60-80ms phía ngoài điểm J. ST chênh xuống trên 2mm là tiêu chuẩn chấm dứt test gắng sức. ST chênh xuống dạng dốc lên không được xem là dương tính [11] như đã trình bày ở phần sinh lý, ST chênh xuống do thiếu máu cục bộ gây ra bởi tăng nhu cầu thường có tính lan tỏa và sẽ không có nhiều giá trị định khu tổn thương.
– ST chênh lên: thông thường ST chênh lên khi thực hiện test gắng sức xuất hiện ở những bệnh nhân có sẵn sóng Q bệnh lý, điều này gợi ý tới tình trạng phình thất hoặc thiếu máu cục bộ. Nhưng nếu không có sóng Q bệnh lý trong ECG lúc nghỉ, điều này gợi ý tới bệnh mạch vành đoạn gần (ví dụ đoạn gần LAD) hoặc co thắt mạch vành [11].
– Block nhánh: LBBB trong ECG lúc nghỉ là một chống chỉ định của test gắng sức bởi sự thay đổi ST khi làm test ở những bệnh nhân này không thể được diễn giải cho mục đích chẩn đoán. Có khoảng 0.5% bệnh nhân sẽ xuất hiện block nhánh khi làm test gắng sức. Nếu LBBB xuất hiện khi nhịp tim > 125 lần/phút thì không được kết luận hướng tới bệnh mạch vành nhưng nếu LBBB xuất hiện khi nhịp tim < 125 lần/phút, nó có giá trị dự đoán biến cố tim mạch trong tương lai. RBBB xuất hiện khi gắng sức không liên quan đến tăng biến cố tim mạch [11].
– Biến đổi sóng T: Sự biến đổi của sóng T (kể cả T đảo hay sóng T giả bình thường) trong test gắng sức không có giá trị chẩn đoán nhưng có thể gợi ý tăng nguy cơ rối loạn nhịp thất [11].
– Rối loạn nhịp: Ngoại tâm thu thất có thể bắt gặp ở khoảng 20% bệnh nhân làm test gắng sức và không có nhiều giá trị chẩn đoán quan trọng. Tuy nhiên ngoại tâm thu thất dày hay thậm chí là nhanh thất mặc dù hiếm gặp nhưng có giá trị chẩn đoán cao. Rối loạn nhịp trên thất, rung nhĩ cũng có thể xuất hiện nhưng không có giá trị tiên đoán bệnh mạch vành nhưng có giá trị tiên đoán nguy cơ loạn nhịp sau này [11].
TÀI LIỆU THAM KHẢO
1. Chang A. M., Shofer, F. S., Tabas, J. A., Magid, D. J., McCusker, C. M., & Hollander, J. E., (2009). Lack of association between left bundle-branch block and acute myocardial infarction in symptomatic ED patients. Am J Emerg Med, 27(8), 916-921.
2. Das M. K., Khan, B., Jacob, S., Kumar, A., & Mahenthiran, J., (2006). Significance of a fragmented QRS complex versus a Q wave in patients with coronary artery disease. Circulation, 113(21), 2495-2501.
3. Das M. K., Suradi, H., Maskoun, W., Michael, M. A., Shen, C., Peng, J., Mahenthiran, J., (2008). Fragmented wide QRS on a 12-lead ECG: a sign of myocardial scar and poor prognosis. Circ Arrhythm Electrophysiol, 1(4), 258-268.
4. de Winter R. J., Verouden, N. J., Wellens, H. J., & Wilde, A. A., (2008). A new ECG sign of proximal LAD occlusion. N Engl J Med, 359(19), 2071-2073.
5. Meyers H. P., Bracey, A., Lee, D., Lichtenheld, A., Li, W. J., Singer, D. D., Smith, S. W., (2021). Comparison of the ST-Elevation Myocardial Infarction (STEMI) vs. NSTEMI and Occlusion MI (OMI) vs. NOMI Paradigms of Acute MI. J Emerg Med, 60(3), 273-284.
6. Take Y., & Morita, H., (2012). Fragmented QRS: What Is The Meaning? Indian Pacing Electrophysiol J, 12(5), 213-225.
7. Amsterdam Ezra A, Wenger, Nanette K, Brindis, Ralph G, Casey, Donald E, Ganiats, Theodore G, Holmes, David R, Kontos, Michael C %J Journal of the American College of Cardiology, (2014). 2014 AHA/ACC guideline for the management of patients with non–ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 64(24), e139-e228.
8. Baltazar Romulo F. (2009). Basic and bedside electrocardiography: Lippincott Williams & Wilkins.
9. Brady William, Truwit, Jonathon Dean, & Brady, William. (2009). Critical decisions in emergency and acute care electrocardiography: Wiley Online Library.
10. Collet Jean-Philippe, Thiele, Holger, Barbato, Emanuele, Barthélémy, Olivier, Bauersachs, Johann, Bhatt, Deepak L, Folliguet, Thierry %J European heart journal, (2021). 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: the Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). 42(14), 1289-1367.
11. De Lemos James, & Omland, Torbjørn. (2017). Chronic coronary artery disease: a companion to Braunwald’s heart disease E-book: elsevier Health Sciences.
12. de Luna Antoni Bayés, & Fiol-Sala, Miquel. (2020). Electrocardiography in ischemic heart disease: clinical and imaging correlations and prognostic implications 2nd edition: John Wiley & Sons.
13. De Zwaan Chris, Bär, Frits WHM, & Wellens, Hein JJ %J American heart journal, (1982). Characteristic electrocardiographic pattern indicating a critical stenosis high in left anterior descending coronary artery in patients admitted because of impending myocardial infarction. 103(4), 730-736.
14. Ibanez Borja, James, Stefan, Agewall, Stefan, Antunes, Manuel J, Bucciarelli-Ducci, Chiara, Bueno, Hector, Halvorsen, Sigrun %J European heart journal, (2018). 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). 39(2), 119-177.
15. Kimble MA Koda, Young, LY, Alldredge, BK, Corelli, RL, Guglielmo, BJ, Kradjan, WA %J Betsy A . Diabetes mellitus, & et al., (2017). Applied therapeutics: the clinical use of drugs 11th. 8, p231-260.
16. Knuuti Juhani, Wijns, William, Saraste, Antti, Capodanno, Davide, Barbato, Emanuele, Funck-Brentano, Christian, Cuisset, Thomas %J European heart journal, (2020). 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: the Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). 41(3), 407-477.
17. Morrow David A. (2016). Myocardial Infarction: A Companion to Braunwald’s Heart Disease E-Book: Elsevier Health Sciences.
18. Roland X. Stroobandt S. Serge Barold, Alfons F. Sinnaeve. (2018). ECG from Basics to Essentials Step by Step 1st Edition Wiley-Blackwell.
19. Stephen W. Smith Ph.D. Zvosec, Deborah L., M.D. Henry, Timothy D., M.D. Sharkey, Scott W. (2002). The Ecg in Acute Mi: An Evidence-Based Manual of Reperfusion Therapy Lippincott Williams & Wilkins.
20. Surawicz Borys, & Knilans, Timothy. (2008). Chou’s Electrocardiography in Clinical Practice E-Book: Adult and Pediatric: Elsevier Health Sciences.
21. Thygesen Kristian, Alpert, Joseph S, Jaffe, Allan S, Chaitman, Bernard R, Bax, Jeroen J, Morrow, David A, Infarction, Executive Group on behalf of the Joint European Society of Cardiology /American College of Cardiology /American Heart Association /World Heart Federation Task Force for the Universal Definition of Myocardial, (2018). Fourth universal definition of myocardial infarction (2018). 72(18), 2231-2264.
22. Van Gorselen EOF, Verheugt, FWA, Meursing, BTJ, & Ophuis, AJM Oude %J Netherlands Heart Journal, (2007). Posterior myocardial infarction: the dark side of the moon. 15(1), 16.
23. Wagner Galen S. (2021). Marriott’s practical electrocardiography (13th ed.): Lippincott Williams & Wilkins.