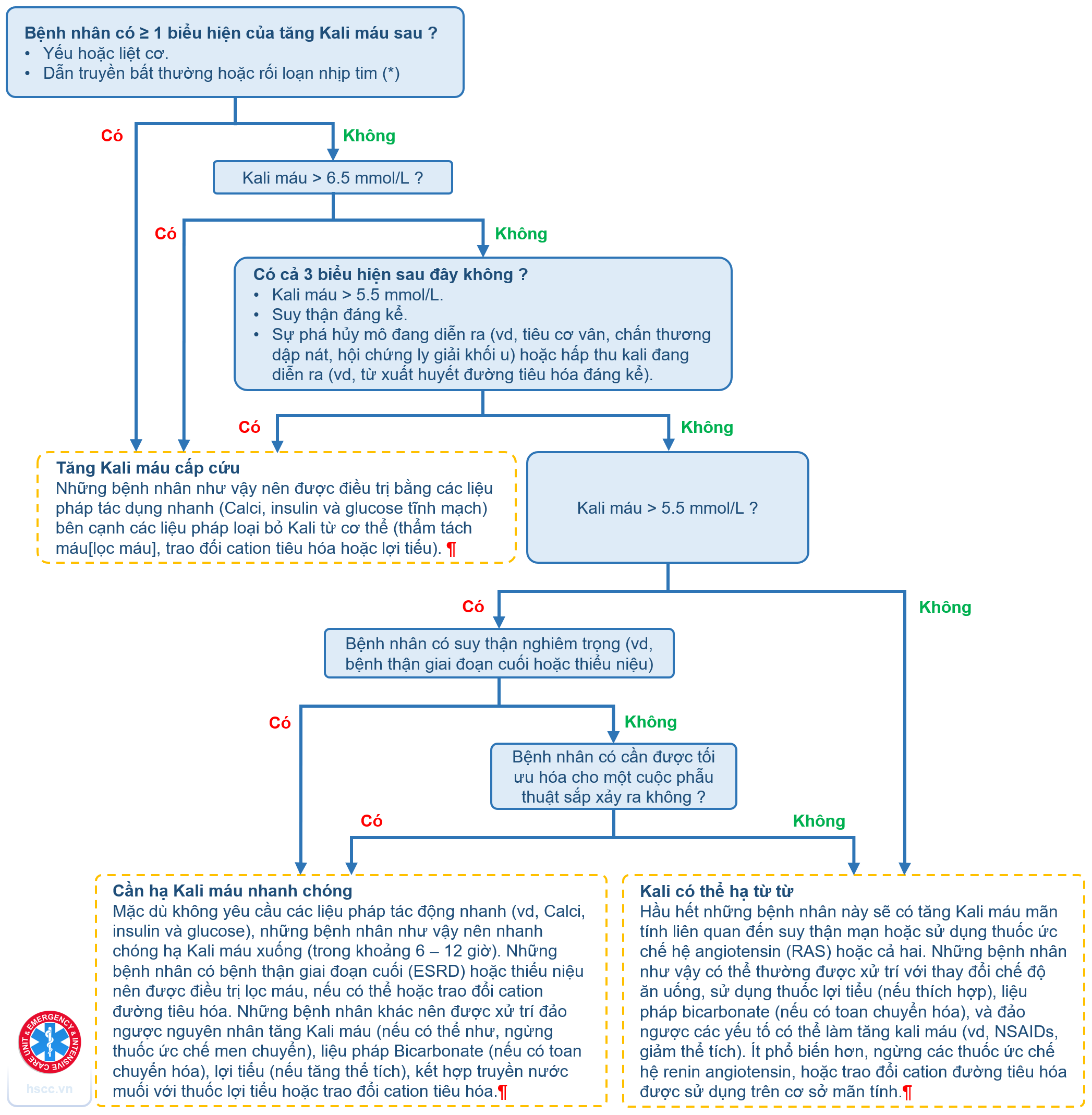
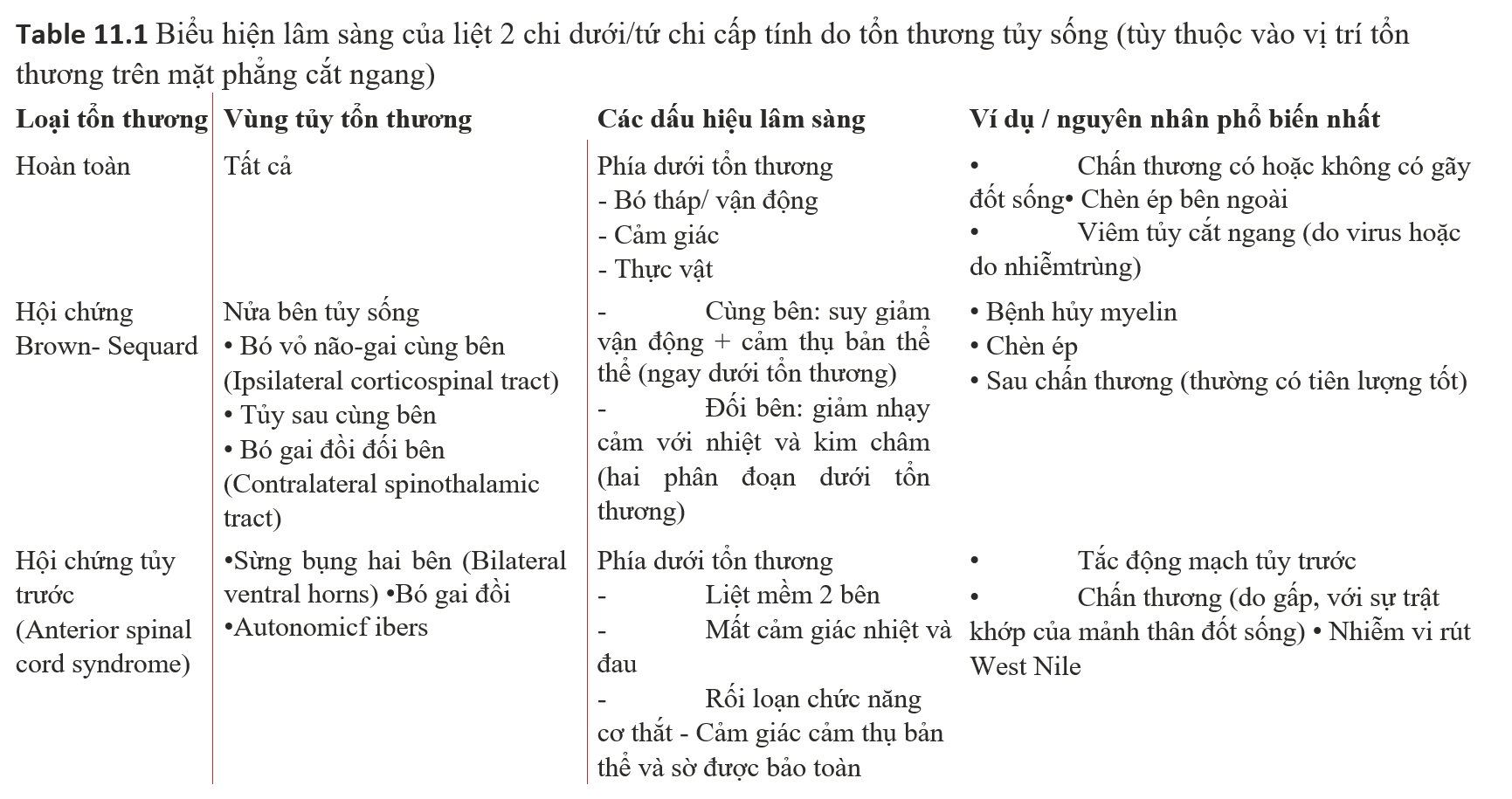
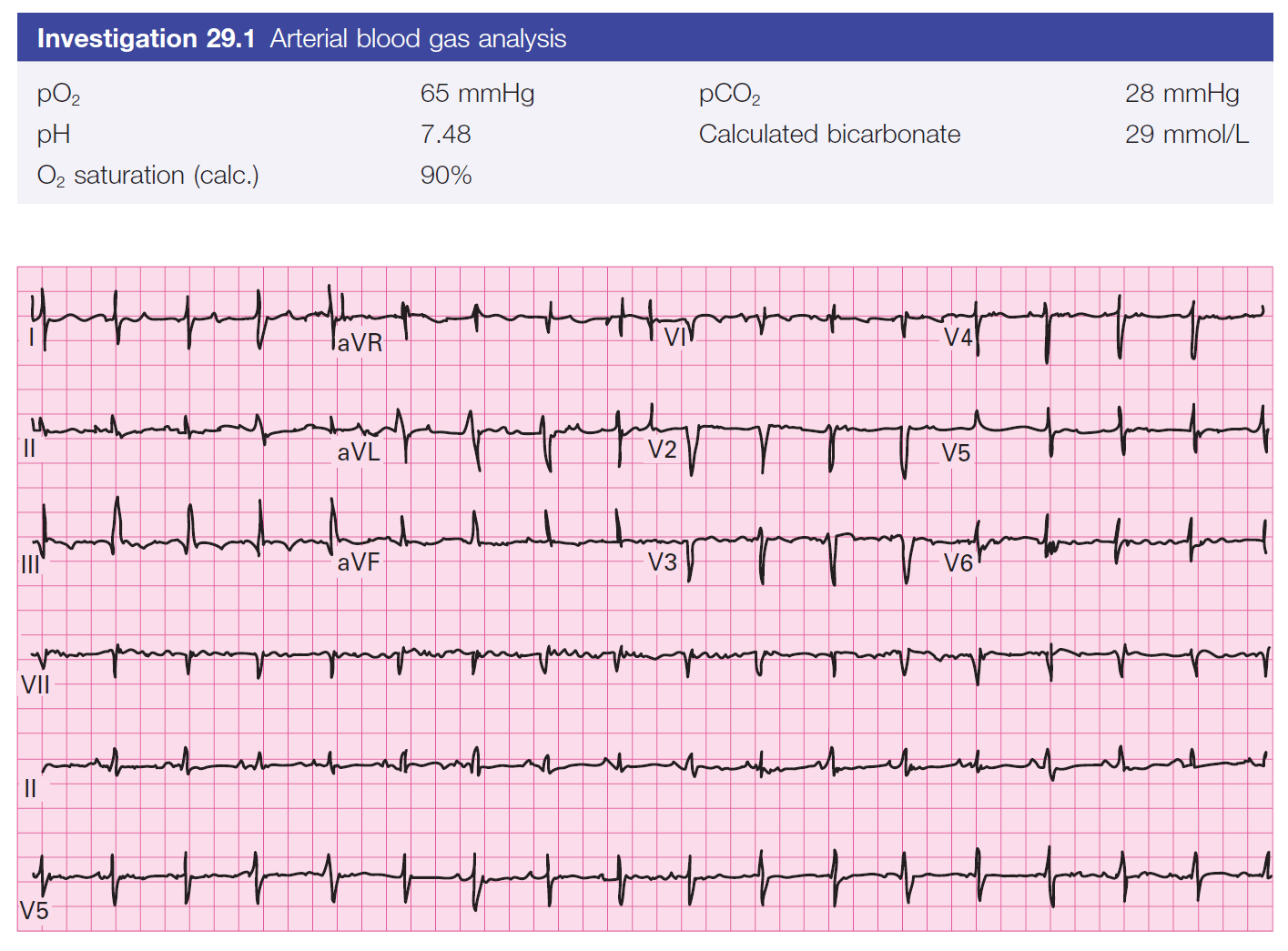
Phân tích CXR/CT IV
 Fig. 47.1 Chest X-ray
Fig. 47.1 Chest X-ray Fig. 47.2 Chest computed tomography
Fig. 47.2 Chest computed tomography1. Hình ảnh trên phim và chẩn đoán phân biệt?
2. Định nghĩa hiện tại của hội chứng suy hô hấp cấp?
3. Tên 1 vài yếu tố khởi phát tiến triển ARDS.
4. Chiến lược thở máy với bệnh nhân có chẩn đoán trên?
5. Có chỉ định dùng steroids, statins, or giãn cơ (NMB) ở bệnh nhân ARDS?
6. Biện pháp tăng cường khả năng oxy hóa ở bệnh nhân ARDS nặng?
7. Vai trò của nitric oxide và prostaglandins trong ARDS?
Trả lời
1. XQ phổi (Fig. 47.1) tổn thường mờ lan tỏa 2 trường phổi trong khi CT ngực có tổn thương dạng kính mờ (Fig. 47.2) cho thấy giảm toàn bộ khả năng chứa khí của phổi. cũng có thể thấy giãn phế quản ở khu vực kính mờ. chẩn đoán phân biệt gồm (a) ARDS, (b) suy tim sung huyết, (c) xuất huyết phổi, (d) viêm phổi, (e) tổn thương phổi cấp do truyền máu, và (f) phù phổi không do tim
2. Theo định nghĩa Berlin, năm 2012, hội chứng suy hô hấp cấp đặc trưng bởi thiếu oxy và phổi đặc lại xảy ra trong vòng 1 tuần với tình trạng lâm sàng mới/hoặc nặng lên với triệu chứng hô hấp đang có. Biểu hiện mờ 2 phổi trên XQ phổi ít nhất ¾ mà không giải thích được do tràn dịch, xẹp phổi hay tổn thương u. CT có đám mờ dày đặc hơn,dạng kính mờ lan tỏa, đây là dấu hiệu không đặc hiệu cho thấy giảm tổng thể lượng khí có trong toàn bộ phổi bị ảnh hưởng. suy hô hấp trong hội chứng ARDS không thể giải thích hoàn toàn được do suy tim, cần loại trừ khách quan bằng cách cho siêu âm tim. Cuối cùng, ARDS phân mức độ nhẹ, vừa hoặc nặng dựa trên tỷ số PaO2/ FiO2 và PEEP. Nếu PaO2/FiO2 từ 200 – 300 mmHg với PEEP ≥5, phân loại là nhẹ. Nếu PaO2/FiO2 100 – 200 mmHg với PEEP ≥5, phân loại vừa. PaO2/FiO2 dưới 100 mmHg với PEEP ≥5 là nặng. lưu ý thuật ngữ tổn thương phổi cấp đã bị bỏ, cũng như đòi hỏi áp lực mao mạch phổi bít phải ≤18 mmHg [1].
3. Yếu tố nguy cơ thường gặp với ARDS được chia làm 2 nhóm: trực tiếp và gián tiếp
(a) Nguyên nhân trực tiếp như viêm phổi, hít dịch dạ dày, tổn thương do hít phải, đụng dập phổi, viêm mạch phổi và ngạt nước
(b) Gián tiếp như sepsis không do phổi, chấn thương lớn, viêm tụy, bỏng nặng, sốc không do tim, quá liều thuốc, truyền lượng lớn máu gây tổn thương phổi (TRALI).
4. Chiến lược bảo vệ phổi (còn gọi tiếp cận phổi mở hoặc thông khí bảo vệ phổi) là tiêu chuẩn trong điều trị bệnh nhân ARDS. Nghiên cứu ARDS ngẫu nhiên cho thấy hạn chế sức căng của phổi cuối kỳ hít vào có thể làm giảm tỷ lệ tử vong ở nhóm bệnh nhân này. Bệnh nhân này có thể tích khí lưu thông thấp (Vt 4–6 ml/kg cân nặng lý tưởng) và duy trì áp lực plateau 25–30 mmhg sẽ có tiên lượng tốt hơn, giảm tỷ lệ tử vong từ 40 còn 31% [2]. Hạn chế của chế độ này là giảm thông khí dẫn tới tăng C02 và tổn thương do lặp đi lặp lại đóng và mở phế nang mỗi chu kỳ. do đó, PEEP nên để thấp hơn
Để ngăn xẹp mỗi chu kỳ thở. Thật khó để mô tả phương pháp sử dụng PEEP tối ưu với mỗi bệnh nhân. Sử dụng PEEP cao nhất cho phép duy trì áp lực plateau tối ưu có thể là lý do tiếp cận. trong nghiên cứu đó, tỷ lệ sống liên quan tới giảm nồng độ IL-6 huyết tương, ủng hộ giả thiết chiến lược bảo vệ phổi giúp ngăn giải phóng chất trung gian và hệ tuần hoàn, có thể gây suy đa tạng. trong trường hợp hạ oxy kháng trị, kéo dài thời gian hít vào bằng cách tăng tỷ số I:E có thể cải thiện oxy hóa, tuy nhiên, theo dõi sát để tránh bẫy khí, auto- PEEP, tổn thương khí áp và ảnh hưởng huyết động
5. Việc sử dụng glucocorticoid trong ARDS vẫn còn tranh cãi. Nghiên cứu ARDS Network LaSRS cho thấy không có lợi khi dùng steroid ở bệnh nhân ARDS. Ngoài ra, nó còn làm tăng tỷ lệ biến chứng thần kinh cơ, cũng như tử vong nếu bắt đầu dùng 2 tuần sau khởi phát ARDS. Tác dụng phụ của dùng steoird gồm suy giảm miễn dịch, nhiễm trùng cơ hội và tăng đường máu. Thành phần mineralocorticoid góp phần giữ muối/nước, cả 2 đều làm cân bằng dịch “dương”, được coi là yếu tố nguy cơ tiên lượng xấu trong tổn thương phổi. Hiện tại không đủ bằng chứng hỗ trợ sử dụng steroid ở bệnh nhân ARDS [3]. Nghiên cứu SAILS năm 2014 so sánh statin với giả dược ở bệnh nhân ARDS trong sepsis. Sử dụng Statin không làm giảm tỷ lệ tử vong hay tăng số ngày thở máy, do đó không có bằng chứng hỗ trợ sử dụng nó trong ARDS [4]. Sử dụng giãn cơ với bệnh nhân hạ oxy máu có ít tác dụng có lợi. Tránh thể tích khí lưu thông lớn do tổn thương khí áp làm giảm hấp thụ oxy do thiếu hoạt động của cơ và cải thiện đồng bộ thở máy ở bệnh nhân. Nhiều tài liệu cho thấy sử dụng NMB sớm (trong 48h đầu) có cải thiện tỷ lệ tử vong.
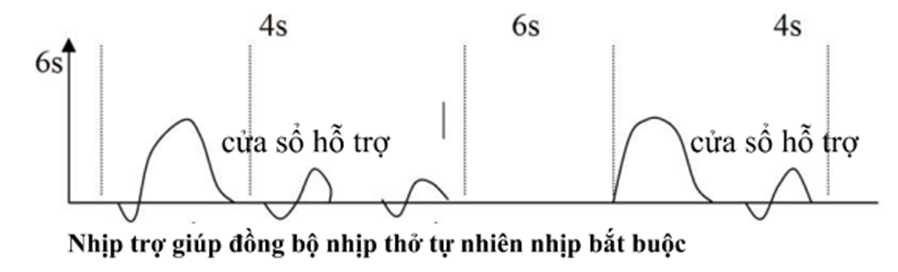
6. Thông khí xả áp đường thở (APRV) kết hợp giữa thông khí kiểm soát áp lực và thông khí tỷ lệ nghịch theo thời gian, mục tiêu áp lực và chế độ time-cycled (hết thời gian Ti) (Fig. 47.3). cài PEEP cao hoặc thấp hơn, 80–95% chu kỳ hô hấp nghỉ trong thì hít vào ở PEEP cao hơn. Bệnh nhân tự thở trong cả 2 chế độ PEEP thấp và cao. Áp lực đường thở trung bình tăng mà không tăng nhiều áp lực đỉnh, thích hợp bảo vệ phổi. phương pháp này giúp rút ngắn thời gian thở máy và nằm ICU ở bệnh nhân ARDS nhưng vẫn còn tranh cãi, chưa có bằng chứng rõ ràng về cải thiện tỷ lệ tử vong
Thở máy tần số cao (HFOV) được đánh giá gần đây bởi 2 nghiên cứu ngẫu nhiên có đối chứng (OSCAR, và OSCILLATE) cho thấy không có lợi. nhóm sử dụng HFOV trong nghiên cứu OSCILLATE có tỷ lệ tử vong cao hơn,
 Fig. 47.3 thông khí xả áp đường thở (APRV
Fig. 47.3 thông khí xả áp đường thở (APRVCần dùng an thần, giãn cơ và vận mạch cao hơn, do đó không có bằng chứng hỗ trợ việc sử dụng nó
Tư thế nằm sấp do trọng lực và chuyển tư thế của tim trong lồng ngực giúp cải thiện thông khí- tưới máu. Cơ chế được cho là do sự thay đổi chuyển động của cơ hoành, tăng thể tích chức năng và dung tích cặn chức năng, làm sạch dịch tiết tốt hơn, và giảm tổn thương phổi do thở máy. Nghiên cứu PROSEVA năm 2013, đã thu hút sự chú ý trở lại phương pháp này cho thấy giảm tỷ lệ tử vong trong 28 và 90 ngày, tăng thời gian thở máy và giảm thời gian rút ống. tăng PaO2 10 mmHg trong 30 phút đầu tiên của tư thế nằm sấp thường dự đoán sẽ tăng bền vững PaO2 và coi như đó là “phản ứng hồi phục”
Cuối cùng, oxy hóa màng ngoài cơ thể (ECMO) vẫn là công cụ quan trọng trong xử trí hạ oxy kháng trị nhưng thường là biện pháp cuối cùng. Tài liệu hỗ trợ nó vẫn còn thiếu và còn tranh cãi. Guideline gợi ý nên dùng với trường hợp nguyên nhân có thể đảo ngược, thở máy dưới 7 ngày, tuổi <65, không có bệnh phối hợp, không có chống chỉ định với chống đông và không có rối loạn chức năng thần kinh. Trong trường hợp chỉ có suy hô hấp đơn thuần, sử dụng tiếp cận tĩnh mạch- tĩnh mạch, trường hợp huyết động không ổn định, sử dụng tĩnh mạch-động mạch. Cần thêm bằng chứng hỗ trợ sử dụng nó trong điều trị ARDS [5].
7. Dùng thuốc giãn mạch dạng hít để giảm áp lực động mạch phổi và phân phối lại dòng máu tới khu vực phổi thông khí tốt với ít tác dụng phụ, cải thiện thông khí tưới máu. Hít nitric oxide cho thấy cải thiện tỷ lệ PaO2/FiO2 và
Chỉ số oxy hóa. Nó rất tốn kém, nhanh chóng bị bất hoạt bởi hemoglobin, có thể gây methemoglobine và tăng nguy cơ gây suy thận. Không có tác dụng có lợi với tỷ lệ tử vong hay số ngày thở máy khi sử dụng nitric oxide. Hít prostaglandin có tác dụng giãn mạch tương tự khi so sánh với nitric oxide, bao gồm cải thiện oxy hóa và giảm tăng áp phổi, tuy nhiên bằng chứng thì chưa đủ. Bệnh nhân coi như đáp ứng nếu cải thiện oxy hóa trong vòng 1h sau dùng. Dựa trên bằng chứng hiện tại, hít thuốc giãn mạch nên cân nhắc và là biện pháp điều trị tạm thời với tình trạng hạ oxy máu kháng trị (kèm hoặc không tăng áp phổi) khi các biện pháp khác không có tác dụng
References
1. Fanelli V, et al. Acute respiratory distress syndrome: new definition, current and future thera- peutic options. J Thorac Dis. 2013;5(3):326–34.
2. Donahoe M. Acute respiratory distress syndrome: a clinical review. Pulm Circ. 2011;1(2):192–211.
3. Bihari S, et al. Steroids in ARDS: to be or not to be. Intensive Care Med. 2016;42(5):931–3.
4. Truwit J, et al. SAILS: statins for acutely injured lungs (ARDS) from sepsis. Am J Respir Crit Care Med. 2014;189:A5088.
5. Mehta C, et al. Management of refractory hypoxemia. Ann Card Anesth. 2016;19(1):89–96.