Sử dụng thuốc tiêu sợi huyết trong thực hành lâm sàng
1. GIỚI THIỆU CHUNG
1.1. Sự hình thành và ly giải huyết khối
Huyết khối là một phần quan trọng của phản ứng đông cầm máu bình thường nhằm hạn chế xuất huyết do tổn thương mạch máu. Trong điều kiện bình thường, huyết khối bị giới hạn ở vùng tổn thương ngay lập tức và không gây cản trở dòng máu đến các khu vực quan trọng, ngoại trừ lòng mạch xơ vữa. Trong điều kiện bệnh lý, huyết khối có thể lan rộng, có thể cản trở dòng chảy trong lòng mạch và ảnh hưởng đến huyết động. Các hội chứng lâm sàng cấp tính có thể là hậu quả của huyết khối:
- Nhồi máu cơ tim cấp.
- Huyết khối tĩnh mạch sâu.
- Thuyên tắc động mạch phổi.
- Đột quỵ thiếu máu não cấp.
- Tắc động mạch ngoại biên cấp.
Huyết khối bệnh lý có thể xảy ra ở bất kỳ vị trí nào trong cơ thể. Các yếu tố thuận lợi hình thành huyết khối bao gồm: xơ vữa động mạch, lưu lượng máu thay đổi, rối loạn chuyển hóa (đái tháo đường, tăng lipid máu), tình trạng tăng đông, hút thuốc lá, chấn thương và bỏng.
Cơ chế hình thành huyết khối: Cầm máu và huyết khối đều phụ thuộc vào quá trình đông máu, tính toàn vẹn của thành mạch máu và phản ứng tiểu cầu. Một số yếu tố tế bào cũng liên quan đến hình thành huyết khối. Khi có tác nhân gây tổn thương thành mạch, phản ứng tế bào cục bộ ngay lập tức diễn ra. Tiểu cầu di chuyển đến khu vực tổn thương và tiết ra các yếu tố tế bào và các chất trung gian hóa học. Các chất trung gian này thúc đẩy sự hình thành cục máu đông. Ba thành phần chính của cục máu đông gồm tiểu cầu, thrombin và fibrin. Mỗi thành phần này là một mục tiêu điều trị quan trọng. Trong quá trình hình thành huyết khối, prothrombin được hoạt hóa thành yếu tố đông máu hoạt động thrombin bằng tiểu cầu được kích hoạt. Fibrinogen được hoạt hóa thành fibrin bởi thrombin. Fibrin sau đó được hình thành vào phức hợp fibrin. Tất cả quá trình diễn ra trong khi tiểu cầu đang kết tập.
Quá trình ly giải huyết khối: Sự ly giải huyết khối thông qua việc phá vỡ các liên kết fibrin bởi plasmin. Plasmin được hình thành trong hệ tuần hoàn sẽ làm thoái triển fibrin trong máu và tại cục máu đông thành những chất hoà tan được. Tiền chất của plasmin là plasminogen lưu hành trong máu và là một enzyme không hoạt động. Để chuyển plasminogen thành plasmin cần có sự tham gia của các chất hoạt hóa plasminogen. Tuy nhiên, các chất này lại bị ức chế bởi chất ức chế hoạt hóa plasminogen (plasminogen activating inhibitor – PAI). Trong máu còn có Alpha2-antiplasmin, chất ức chế plasmin mới hình thành. Để quá trình ly giải huyết khối diễn ra, sự hoạt hóa plasminogen phải mạnh hơn quá trình ức chế bởi PAI và alpha2-antiplasmin. Plasminogen tập hợp trong phức hợp fibrin.
Plasminogen gắn với fibrin sẽ được chuyển hóa bằng thuốc tiêu sợi huyết thành plasmin trong quá trình tan huyết khối. Cần lưu ý rằng quá trình tan huyết khối hoạt động tốt nhất trên huyết khối được hình thành gần đây. Huyết khối cũ với phức hợp fibrin lớn làm cho chúng có khả năng kháng thuốc tiêu sợi huyết cao hơn; do đó, thời gian là yếu tố quan trọng đối với liệu pháp tiêu sợi huyết.
1.2. Lược sử các thuốc tiêu sợi huyết
Các thuốc tiêu sợi huyết ngày nay là các protease serine hoạt động bằng cách chuyển đổi plasminogen thành tác nhân tiêu sợi huyết tự nhiên plasmin.
Lịch sử của liệu pháp tiêu sợi huyết bắt đầu vào năm 1933, khi người ta phát hiện ra rằng các màng nuôi cấy canh thang của một số chủng streptococcus chứa streptokinase có thể làm tiêu fibrin. Streptokinase được ứng dụng lâm sàng ban đầu trong việc điều trị viêm dính màng phổi xơ hóa, tràn máu màng phổi và viêm màng não do lao. Năm 1958, streptokinase lần đầu tiên được sử dụng ở những bệnh nhân nhồi máu cơ tim cấp và điều này đã làm thay đổi chiến lược điều trị. Hiệu quả của streptokinase ban đầu còn nhiều tranh cãi. Tuy nhiên, năm 1986 thử nghiệm (GISSI-1) đã xác nhận sử dụng streptokinase có hiệu quả trong điều trị nhồi máu cơ tim cấp. Kể từ đó, streptokinase được đưa vào phác đồ điều trị nhồi máu cơ tim cấp.
Khả năng tiêu sợi huyết của nước tiểu người được mô tả lần đầu tiên vào năm 1947 và phân tử hoạt động được đặt tên là urokinase. Không giống như streptokinase, urokinase không có tính kháng nguyên và trực tiếp hoạt hóa plasminogen để tạo thành plasmin. Chất này xúc tác cho sự chuyển đổi plasminogen thành plasmin chỉ bị ảnh hưởng đôi chút bởi sự hiện diện hoặc vắng mặt của cục máu đông fibrin cục bộ.
Chất hoạt hóa plasminogen mô (tissue plasminogen activator – tPA) là một tác nhân tiêu sợi huyết tự nhiên được tìm thấy trong các tế bào nội mô mạch máu và có liên quan đến sự cân bằng giữa tan huyết khối và tạo huyết khối. Nó thể hiện tính đặc hiệu và ái lực với fibrin đáng kể. Tại vị trí huyết khối, sự liên kết của tPA và plasminogen với bề mặt fibrin làm thay đổi về hình dạng tạo điều kiện cho sự chuyển plasminogen thành plasmin và làm tan cục máu đông.
1.3. Cơ chế tác dụng
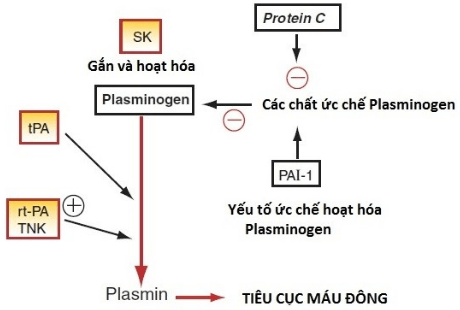
Các thuốc tiêu sợi huyết đều hoạt hóa plasminogen thành plasmin. Plasmin làm tiêu fibrin và có tác dụng làm tan cục máu đông.

Hình 10.1: Sơ đồ vị trí tác dụng của các thuốc tiêu sợi huyết. PAI-1, Plasminogen activator inhibitor – 1; r-PA, reteplase; SK, streptokinase; tPA, tissue-type plasminogen activator; TNK, tenecteplase. (Nguồn: Lionel H. Opie, Bernard J. Gersh (2013). Drugs for the Heart 8e)
Các thuốc tiêu sợi huyết, hay chất kích hoạt plasminogen, được chia thành hai loại sau:
- Các tác nhân đặc hiệu fibrin bao gồm alteplase (tPA), reteplase (chất hoạt hóa plasminogen tái tổ hợp [r-PA]) và tenecteplase, xúc tác sự chuyển hóa plasminogen trong trường hợp có fibrin.
- Các tác nhân không đặc hiệu fibrin (ví dụ: streptokinase) xúc tác cho quá trình tiêu sợi huyết toàn thân. Streptokinase được chỉ định để điều trị NMCT cấp, thuyên tắc động mạch phổi cấp (PE), huyết khối tĩnh mạch sâu (DVT), huyết khối động mạch cấp và huyết khối cầu nối động – tĩnh mạch. Nó không được sử dụng rộng rãi ở Hoa Kỳ nhưng vẫn được sử dụng ở nhiều nơi khác vì chi phí thấp hơn.
- Thuốc tiêu sợi huyết có thể được sử dụng đường toàn thân (truyền tĩnh mạch) hoặc có thể được đưa trực tiếp vào khu vực huyết khối qua đường ống thông. Truyền tĩnh mạch sử dụng để điều trị nhồi máu cơ tim cấp, đột quỵ thiếu máu não cấp và hầu hết các trường hợp thuyên tắc động mạch phổi lớn cấp tính. Huyết khối động mạch ngoại biên, huyết khối tĩnh mạch sâu và huyết khối cầu nối động – tĩnh mạch có thể được điều trị qua đường ống thông trực tiếp đến vị trí huyết khối.
2. CÁC THUỐC TIÊU SỢI HUYẾT
2.1. Alteplase (chất hoạt hóa plasminogen tổ chức – tPA)
- Alteplase (biệt dược: Activase, Actilyse) là một enzym có nguồn gốc tự nhiên có khả năng gắn fibrin với ái lực cao hơn streptokinase và urokinase. Sau khi gắn với fibrin, alteplase lập tức chuyển plasminogen thành plasmin ngay trên bề mặt fibrin.
- Về lý thuyết, alteplase chỉ có hiệu quả ở bề mặt của fibrin. Tuy nhiên, trên thực tế, nhìn thấy một tình trạng tiêu sợi huyết toàn thân, với các sản phẩm giáng hóa fibrin tuần hoàn và nguy cơ chảy máu toàn thân đáng kể. Alteplase không phải là kháng nguyên nên biểu hiện dị ứng thấp hơn các thuốc tiêu sợi huyết khác.
- Thuốc có thời gian bán thải rất ngắn nên bắt buộc phải điều trị phối hợp với heparin để tránh tái phát huyết khối.
- Alteplase dùng đường tĩnh mạch. Thuốc đào thải nhanh ra khỏi máu chủ yếu qua gan với độ thanh thải khoảng 572 ± 132 mL/ph. Sau 5 phút tiêm truyền tĩnh mạch, trên > 50% nồng độ thuốc được đào thải ra khỏi huyết tương và sau 10 phút thì 80 % bị đào thải.
2.2. Reteplase (rPA)
- Reteplase là một chất hoạt hóa plasminogen loại tái tổ hợp thế hệ thứ hai hoạt động nhanh hơn và có nguy cơ chảy máu thấp hơn so với alteplase thế hệ thứ nhất. Nó là một sản phẩm non-glycosyl tổng hợp có chứa 355 trong số 527 acid amin của tPA tự nhiên. Thuốc được sản xuất nhờ vi khuẩn Escherichia coli bằng các kỹ thuật DNA tái tổ hợp.
- Reteplase không liên kết chặt chẽ với fibrin như tPA tự nhiên nên có thể khuếch tán tự do hơn qua cục máu đông chứ không chỉ liên kết với bề mặt như tPA. Ở nồng độ cao, reteplase không cạnh tranh với plasminogen cho các vị trí gắn với fibrin, cho phép plasminogen ở vị trí của cục máu đông được chuyển thành plasmin hòa tan cục máu đông. Những đặc điểm này giúp reteplase làm tiêu sợi huyết nhanh hơn alteplase.
- Reteplase có thời gian bán hủy dài hơn (khoảng 13-16 phút). Giống như alteplase, reteplase không phải là kháng nguyên và ít gây dị ứng.
2.3. Tenecteplase (TNK)
- Tenecteplase đã được FDA chấp thuận là thuốc tiêu sợi huyết vào năm 2000. Thuốc được sản xuất bằng công nghệ DNA tái tổ hợp sử dụng tế bào buồng trứng của chuột hamster Trung Quốc. Cơ chế hoạt động của thuốc tương tự như cơ chế của alteplase.
- Tenecteplase là một glycoprotein chứa 527 amino acid với một số thay đổi trong các phân tử acid amin. Những thay đổi này bao gồm thay thế asparagine cho threonine 103 và glutamine cho asparagine 117, cũng như thay thế tetra-alanine tại các acid amin 296-299 trong vùng protease. Những thay đổi này giúp tenecteplase có thời gian bán hủy trong huyết tương dài hơn và độ đặc hiệu fibrin cao hơn. Tenecteplase có thời gian bán hủy dao động từ 20-24 phút đến 130 phút và chủ yếu được chuyển hóa ở gan. Ngoài ra, những thay đổi acid amin này cho phép sử dụng một liều bolus và làm giảm tác dụng phụ chảy máu do độ đặc hiệu fibrin cao.
- Thử nghiệm ASSENT-2 đã đánh giá hiệu quả và độ an toàn của tenecteplase so với alteplase ở những bệnh nhân nhồi máu cơ tim cấp và cho thấy tỷ lệ tử vong tương đương sau 30 ngày. Tuy nhiên, tenecteplase có liên quan đến các biến chứng chảy máu ít hơn, đặc biệt biến cố chảy máu lớn (4,66% so với 5,94%) và tỷ lệ truyền máu thấp hơn (4,25% so với 5,49%). Tỷ lệ xuất huyết nội sọ là tương tự nhau (0,93% so với 0,94%). Nghiên cứu tiếp theo cho thấy tỷ lệ tử vong sau 1 năm ở hai nhóm là tương đương nhau.
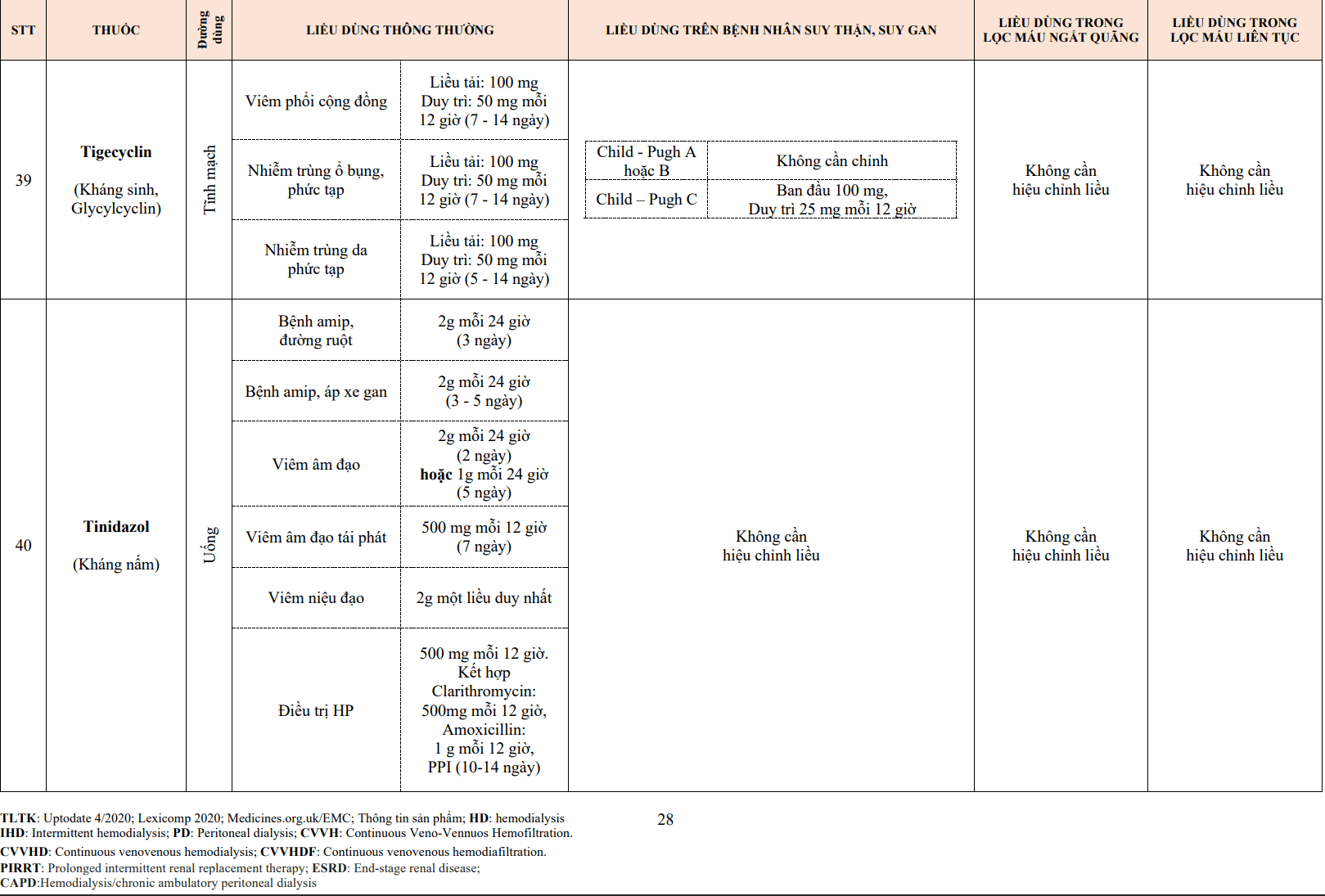
- Một số thử nghiệm lâm sàng đã được bắt đầu để đánh giá các chỉ định mới có thể cho tenecteplase.
2.4. Urokinase
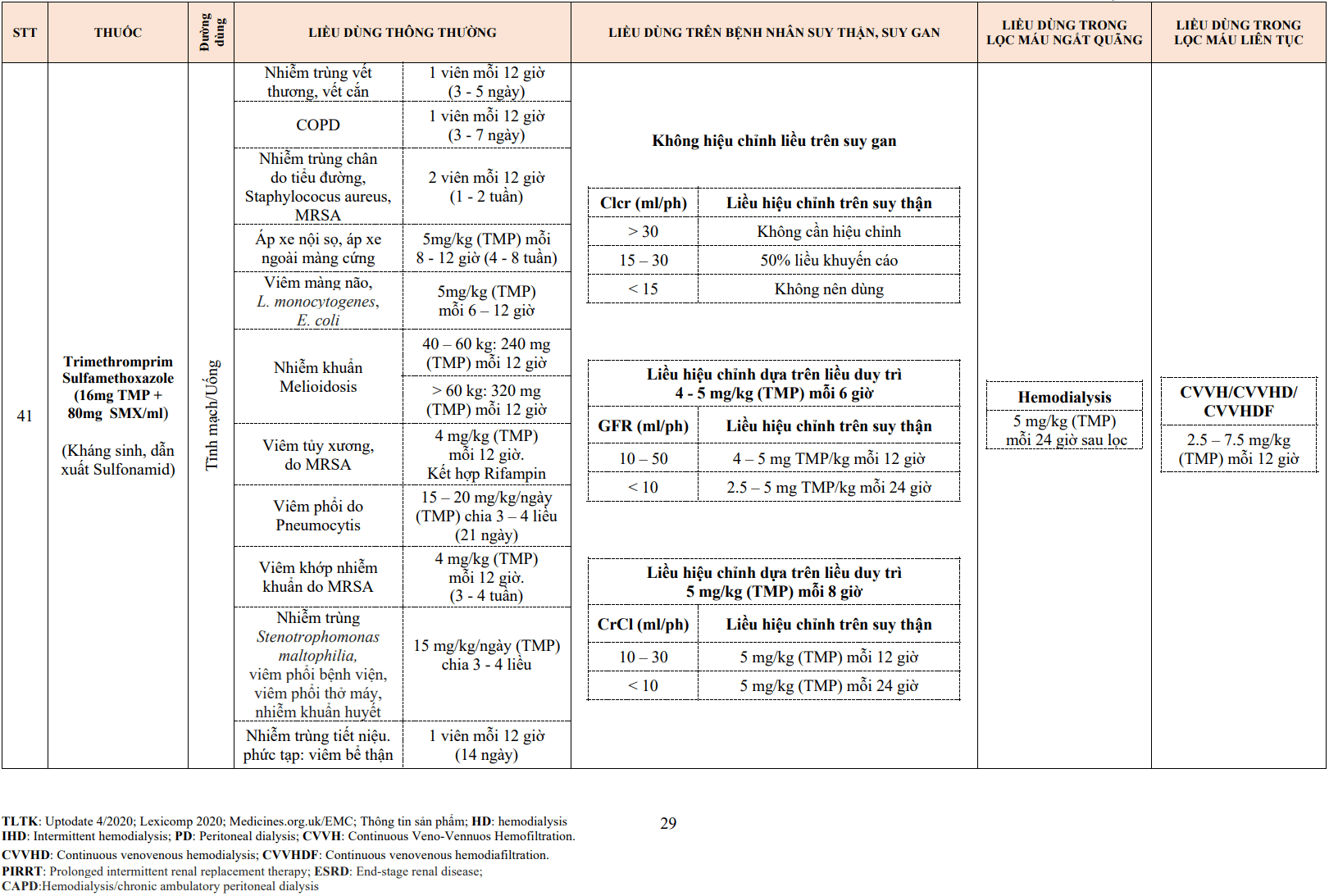
- Urokinase là thuốc tiêu sợi huyết được sử dụng phổ biến với các bác sĩ điện quang can thiệp, thường dùng cho tắc động mạch ngoại biên cấp và cầu nối động – tĩnh mạch do huyết khối.
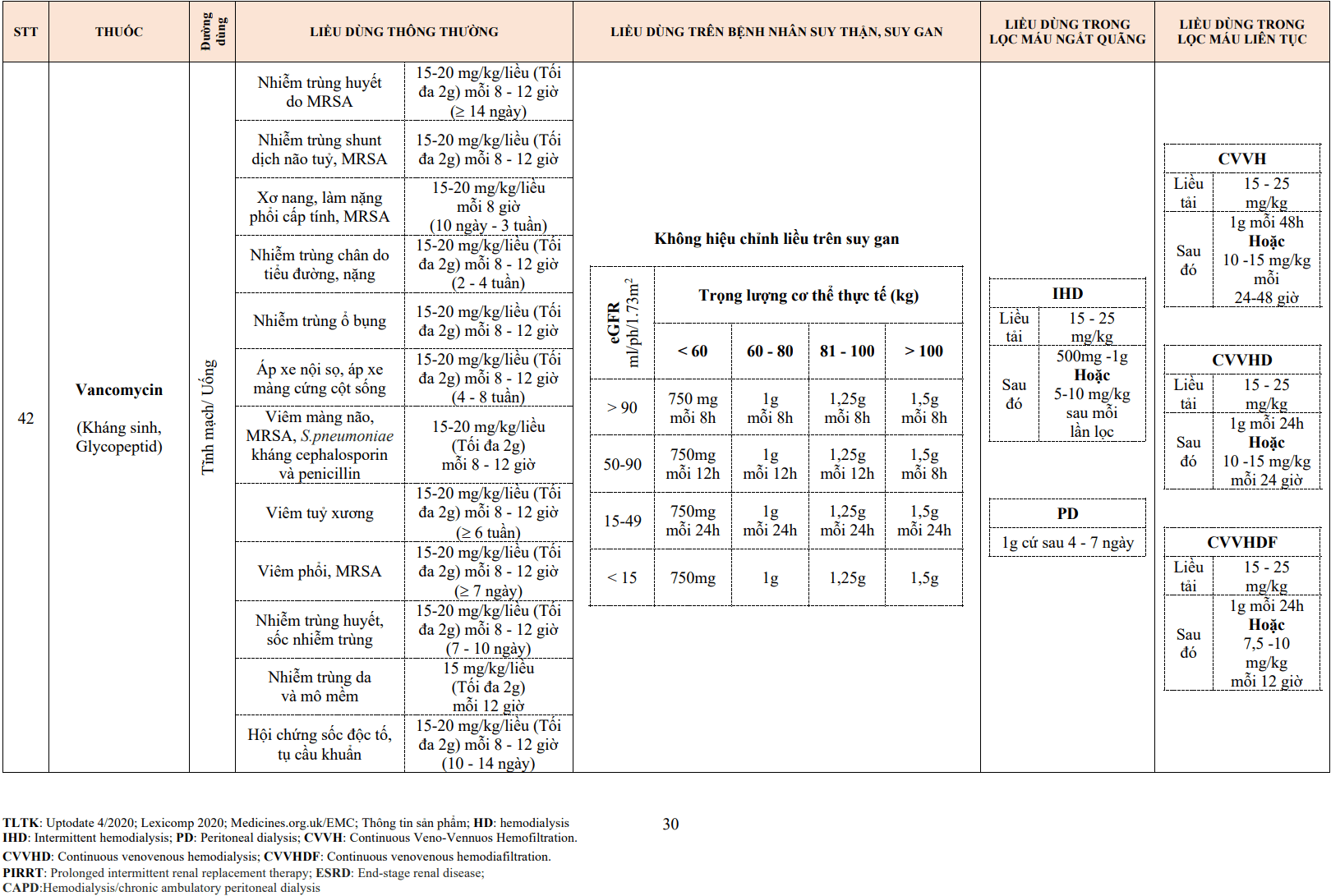
- Urokinase là chất tiêu sợi huyết sinh lý được sản xuất trong các tế bào nhu mô thận. Không giống như streptokinase, urokinase trực tiếp cắt plasminogen để tạo ra plasmin. Khi nó được tinh chế từ nước tiểu người, cần khoảng 1500 lít nước tiểu sản xuất đủ urokinase để điều trị cho một bệnh nhân. Urokinase được sản xuất từ nuôi cấy mô hoặc trong môi trường nuôi cấy E coli bằng kỹ thuật DNA tái tổ hợp.
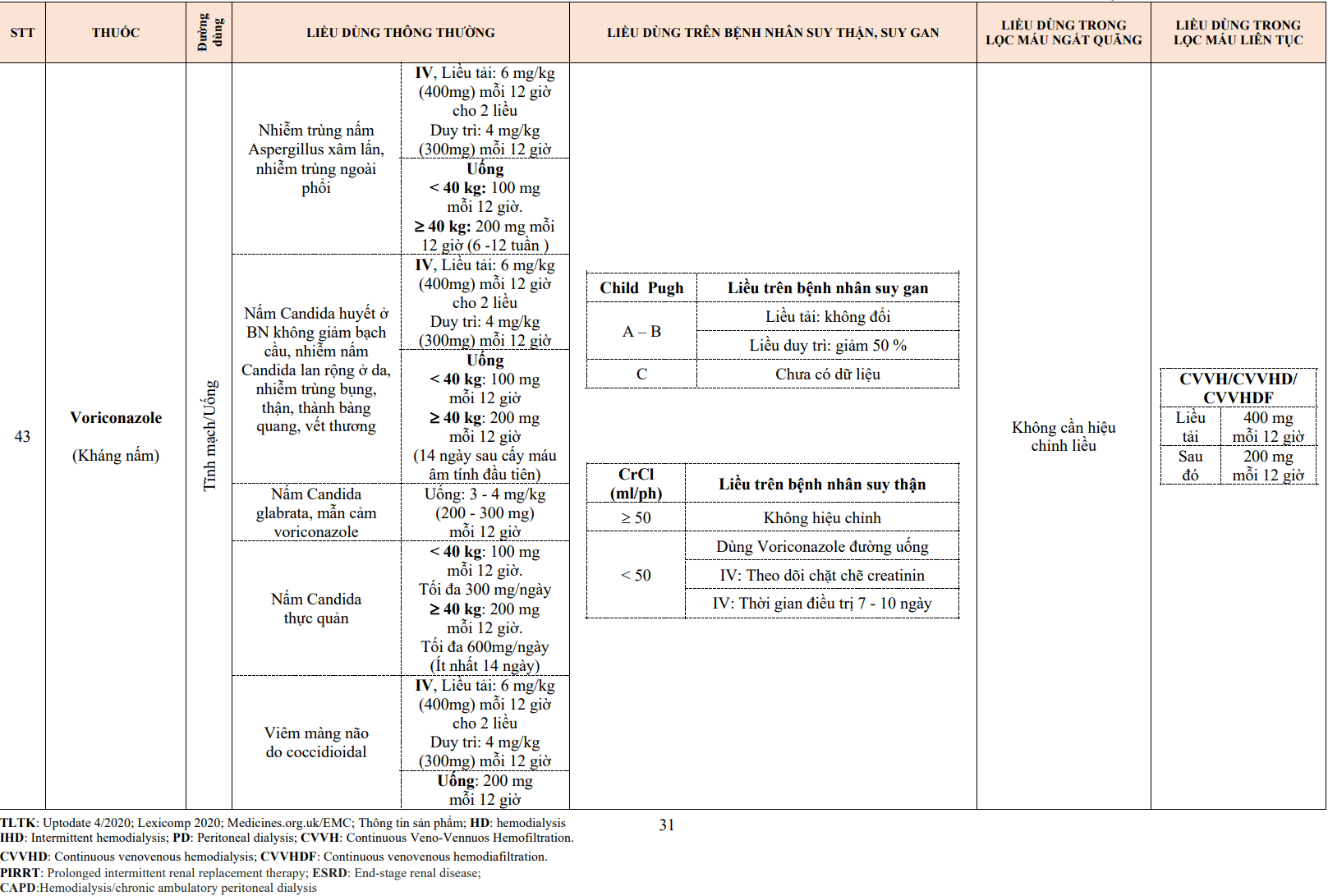
- Hiện nay, urokinase được chỉ định cho thuyên tắc động mạch phổi lớn có huyết động không ổn định.
- Trong huyết tương, urokinase có thời gian bán hủy khoảng 20 phút.
- Phản ứng dị ứng với urokinase là hiếm gặp.
2.5. Prourokinase
- Prourokinase là thuốc tiêu sợi huyết mới hiện đang được thử nghiệm lâm sàng cho nhiều chỉ định khác nhau.
- Nó là một tiền chất không hoạt động được chuyển thành urokinase dạng hoạt động. Quá trình chuyển hóa này làm mất khả năng khai thác các đặc tính sinh lý đặc hiệu fibrin của prourokinase.
- Tính đặc hiệu fibrin tương đối của prourokinase được giải thích bằng cách hoạt hóa ưu tiên plasminogen gắn với fibrin được tìm thấy trong huyết khối hơn là plasminogen tự do trong máu. Tác nhân này đang được nghiên cứu trong các bệnh lý nhồi máu cơ tim cấp, đột quỵ não cấp và tắc động mạch ngoại biên. Các nhà nghiên cứu đã phát triển một đột biến prourokinase (M5) có độ ổn định huyết tương cao hơn và hoạt hóa plasminogen nhanh hơn và ly giải cục máu đông đặc hiệu fibrin lớn hơn prourokinase loại thông thường.
2.6. Streptokinase
- Streptokinase được sản xuất bởi streptococci tan huyết beta. Streptokinase không phải là chất hoạt hóa plasminogen, nhưng liên kết với plasminogen lưu hành tự do (hoặc với plasmin) để tạo thành phức hợp có thể chuyển đổi plasminogen thành plasmin. Hoạt động của streptokinase không được tăng cường khi có fibrin. Ngoài ra streptokinase còn làm tăng nồng độ protein C hoạt hóa trong máu tuần hoàn, do đó thúc đẩy quá trình ly giải cục huyết khối.
- Các nghiên cứu sử dụng streptokinase phóng xạ đã ghi nhận hai thời gian bán huỷ khác nhau: thời gian bán hủy nhanh (khoảng 18 phút) và thời gian bán hủy chậm hơn (khoảng 83 phút).
- Vì streptokinase được sản xuất từ vi khuẩn streptococci nên có thể gây ra sốt và các phản ứng dị ứng khác. Thuốc đồng thời có thể gây hạ huyết áp dường như liên quan đến liều dùng. Streptokinase thường không được sử dụng một cách an toàn lần thứ hai trong vòng 6 tháng bởi vì có tính kháng nguyên cao và xuất hiện lượng lớn kháng thể kháng streptococci.
- Do nguy cơ dị ứng và gặp phải các tác dụng không mong muốn, streptokinase được sử dụng hạn chế trên lâm sàng. Tuy nhiên, ở các quốc gia đang phát triển, streptokinase vẫn tiếp tục được sử dụng vì có giá thành thấp hơn các thuốc tiêu sợi huyết khác.
2.7. Phức hợp hoạt hóa streptokinase (Anisoylated purified streptokinase activator complex – APSAC).
- APSAC (anistreplase) là một phức hợp streptokinase và plasminogen
- Có nhiều lợi ích về mặt lý thuyết so với streptokinase nhưng mắc phải các vấn đề về kháng nguyên tương tự như các hợp chất gốc. Giống như streptokinase, anistreplase không phân biệt giữa plasminogen gắn với fibrin và plasminogen tự do trong máu; do đó, tạo ra một trạng thái tiêu sợi huyết hệ thống.
- Thời gian bán hủy của APSAC trong huyết tương là khoảng từ 40 đến 90 phút.
Bảng 10.1: Đặc điểm của các thuốc tiêu sợi huyết
| Streptokinase | Alteplase (tPA) | Reteplase (rPA) | Tenecteplase (TNK) | |
| Tính chọn lọc trên fibrin | Không | Có | Có | Có >tPA |
| Sự gắn plasminogen | Gián tiếp | Trực tiếp | Trực tiếp | Trực tiếp |
| Thời gian bán thải (phút) | 23 | <5 | 13-16 | 20 |
| Phân hủy fibrinogen | 4+ | 1-2+ | Không rõ | >tPA |
| Dùng heparin trước đó | Có thể | Có | Có | Có |
| Gây tụt áp | Có | Không | Không | Không |
| Phản ứng dị ứng | Có | Không | Không | Không |
3. CHỈ ĐỊNH
3.1. Nhồi máu cơ tim cấp
- Chỉ áp dụng với các trường hợp nhồi máu cơ tim cấp có ST chênh lên (STEMI). Theo khuyến cáo của ESC năm 2017 về sử dụng liệu pháp tiêu sợi huyết trong STEMI: NMCT cấp có ST chênh lên (STEMI) mà thời gian xuất hiện triệu chứng dưới 12h (và có thể tới dưới 24h) ở những bệnh nhân không có các chống chỉ định với thuốc tiêu sợi huyết và ở những cơ sở mà can thiệp ĐMV không thể thực hiện được trong thời gian 120 phút.
- Khi được chỉ định nên sử dụng thuốc tiêu sợi huyết cho bệnh nhân trong vòng 10 phút từ khi bệnh nhân được chẩn đoán STEMI.
3.2. Thuyên tắc động mạch phổi cấp
- Thuốc tiêu sợi huyết được chỉ định cho thuyên tắc động mạch phổi cấp nguy cơ cao (khuyến cáo loại I mức độ bằng chứng B): thuyên tắc động mạch phổi có rối loạn huyết động.
3.3. Đột quỵ thiếu máu não cấp
- Thời gian < 4,5h kể từ khi xuất hiện triệu chứng đến lúc bệnh nhân nhập viện.
- Các đối tượng sau cần cân nhắc nếu đến viện trong khoảng thời gian từ 3-4,5h từ lúc xuất hiện triệu chứng:
- Tuổi cao > 80.
- Đang sử dụng các thuốc chống đông (với bất kỳ PT-INR nào).
- Điểm NIHSS > 25.
- Tiền sử đột quỵ thiếu máu não, đái tháo đường.
3.4. Kẹt van cơ học do huyết khối
Bên cạnh phẫu thuật, liệu pháp tiêu sợi huyết cũng là một lựa chọn trong điều trị kẹt van cơ học do huyết khối. Chỉ định điều trị tùy thuộc vào vị trí van cơ học:
Van tim bên trái:
- Bệnh nhân có triệu chứng khó thở NYHA I-II, kích thước huyết khối trên siêu âm tim qua thực quản nhỏ < 0,8 cm2, ít di động.
- Bệnh nhân có triệu chứng khó thở NYHA III-IV, có chỉ định phẫu thuật nhưng nguy cơ phẫu thuật quá cao trong khi nguy cơ chảy máu, thuyên tắc mạch chấp nhận được.
Van tim bên phải: Hướng dẫn điều trị của ESC 2017 và AHA/ACC 2017 đều khuyến cáo ưu tiên liệu pháp tiêu sợi huyết hơn so với phẫu thuật (do nguy cơ huyết khối van tim mới thay cao).
4. CHỐNG CHỈ ĐỊNH
4.1. Các chống chỉ định tuyệt đối
- Tiền sử đột quỵ xuất huyết não hoặc đột quỵ không rõ nguyên nhân.
- Tổn thương hệ thần kinh trung ương hoặc u não ác tính.
- Đột quỵ thiếu máu não trong vòng 3 tháng.
- Nghi ngờ tách thành động mạch chủ.
- Xuất huyết tiêu hóa nặng trong vòng 21 ngày.
- Có tình trạng chảy máu tiến triển hoặc chảy máu nội tạng.
- Chấn thương đầu hay có phẫu thuật chấn thương nặng trong vòng 3 tháng.
- Phẫu thuật sọ não hoặc tủy sống trong vòng 3 tháng.
4.2 Các chống chỉ định tương đối
- THA kiểm soát kém (HATT trên 180 mmHg).
- Cơn thiếu máu não thoáng qua trong 6 tháng.
- Hồi sinh tim phổi kéo dài ( >10 phút) hay chấn thương sau thủ thuật hồi sinh tim phổi, hay phẫu thuật lớn trong 3 tuần.
- Vị trí chọc động mạch không thể đè ép.
- Có thai hay hậu sản trong vòng 1 tuần.
- Loét dạ dày tiến triển.
- Đang dùng thuốc chống đông đường uống có PT-INR >1,7 hay thời gian prothrombin >15 giây.
- Tiểu cầu < 100.000 G/l.
- Fibrinogen < 100 mg/dl
- Tuổi >75 tuổi.
- Bệnh võng mạc đái tháo đường.
- Bệnh viêm nội tâm mạc nhiễm khuẩn.
- Bệnh gan nặng.
- Đối với streptokinase: đã được sử dụng (trên 5 ngày) hoặc có tiền sử dị ứng với thuốc này.
- Đang dùng thuốc ức chế trực tiếp Thiombon hoặc ức chế trực tiếp yếu tố xa (liều cuối cùng trong vòng 48h ở bệnh nhân có chức năng thận bình thường) với bằng chứng ảnh hưởng đến đông máu thông qua các xét nghiệm như aPTT, ENR, ECT, thời gian hay hoạt tính yếu tố xa.
5. TÁC DỤNG KHÔNG MONG MUỐN
Chảy máu: là tác dụng phụ thường gặp nhất trên lâm sàng với các mức độ khác nhau. Chảy máu trong (nội sọ, sau phúc mạc, tiêu hóa, sinh dục, hô hấp) hoặc chảy máu ra bên ngoài, đặc biệt là tại động mạch và tĩnh mạch các vị trí (có thể gây tử vong). Tổng liều alteplase không được vượt quá 90 mg cho đột quỵ thiếu máu não cấp tính hoặc 100 mg cho nhồi máu cơ tim cấp hoặc thuyên tắc động mạch phổi. Liều ≥ 150 mg liên quan đến tăng đáng kể nguy cơ xuất huyết nội sọ so với liều ≤ 100 mg. Cần theo dõi sát tất cả các vị trí có nguy cơ chảy máu; nếu chảy máu nghiêm trọng xảy ra, phải ngừng truyền alteplase và các thuốc chống đông máu khác (ví dụ: heparin) và bệnh nhân cần được điều trị thích hợp.
Thuyên tắc cholesterol: Hiếm gặp. Tuy nhiên, đã được báo cáo ở những bệnh nhân được điều trị bằng thuốc tiêu sợi huyết; có thể xuất hiện tím đầu chi, suy thận cấp, viêm tụy, nhồi máu cơ tim, nhồi máu não, nhồi máu tủy sống, tắc động mạch võng mạc.
Biến cố thuyên tắc huyết khối: Sử dụng thuốc tiêu sợi huyết có thể làm tăng nguy cơ biến cố huyết khối ở bệnh nhân có xác suất huyết khối tim trái cao (ví dụ, bệnh nhân hẹp van hai lá khít hoặc rung nhĩ).
Phản ứng quá mẫn: Hay gặp với streptokinase do bản chất đây là một kháng nguyên, đặc biệt nếu bệnh nhân được sử dụng streptokinase nhiều lần. Khoảng 10% bệnh nhân sử dụng có các biểu hiện lâm sàng: sốt, nổi ban, rét run. Hiếm khi bắt gặp phản ứng nguy hiểm với tỷ lệ sốc phản vệ dưới 0,5%.
Mặc dù điển hình là nhẹ và thoáng qua, phù mạch có thể xảy ra trong vòng 2h sau khi truyền alteplase ở bệnh nhân điều trị đột quỵ thiếu máu não cấp tính và nhồi máu cơ tim cấp; Các yếu tố như giới nữ, bệnh nhân đang sử dụng các thuốc ức chế men chuyển hoặc đột quỵ liên quan đến vỏ não, có liên quan đến nguy cơ gia tăng phản ứng quá mẫn. Theo dõi chặt chẽ các phản ứng quá mẫn trong khi truyền và trong vài giờ sau đó; nếu có dấu hiệu quá mẫn hoặc phù mạch tiến triển, ngừng truyền thuốc tiêu sợi huyết và xử trí quá mẫn/ sốc phản vệ (nếu có).
Tụt huyết áp: Có thể gặp khi truyền tốc độ cao, hay gặp khi sử dụng streptokinase (đặc biệt nếu truyền với tốc độ trên 500 UI/kg/phút). Xử trí bằng cách giảm tốc độ truyền, truyền dịch, sử dụng các thuốc vận mạch.
6. CÁC THUỐC SỬ DỤNG ĐỒNG THỜI VỚI THUỐC TIÊU SỢI HUYẾT
6.1. Thuốc chống đông đường uống
- Cần thận trọng ở bệnh nhân đang dùng thuốc chống đông đường uống (kháng vitamin K, DOACs) vì làm tăng nguy cơ chảy máu.
- Theo hướng dẫn của AHA/ASA 2013, trong điều trị đột quỵ thiếu máu não trong vòng 3h kể từ khi xuất hiện triệu chứng, việc sử dụng thuốc tiêu sợi huyết khi bệnh nhân đang dùng chống đông đường uống mà chỉ số INR> 1,7 hoặc thuốc ức chế trực tiếp thrombin với các chỉ số đông máu vượt ngưỡng là chống chỉ định. Tuy nhiên, alteplase có thể được dùng cho bệnh nhân đột quỵ thiếu máu não cấp đã dùng thuốc ức chế trực tiếp thrombin (ví dụ: dabigatran) hoặc thuốc ức chế trực tiếp yếu tố Xa (ví dụ: rivaroxaban) khi xét nghiệm aPTT, INR, số lượng tiểu cầu, ECT, thời gian thrombin là bình thường hoặc bệnh nhân ngừng thuốc > 2 ngày (nếu chức năng thận bình thường).
- Đối với đột quỵ thiếu máu não cấp 3 đến 4,5h sau khi khởi phát triệu chứng nên tránh sử dụng alteplase khi đang sử dụng bất kỳ loại thuốc chống đông đường uống nào, bất kể chỉ số INR (AHA /ASA 2013). Tuy nhiên, theo AHA/ASA 2016, việc sử dụng alteplase có thể an toàn và có thể có lợi cho bệnh nhân dùng warfarin với chỉ số INR <1,7.
6.2. Aspirin
- Trong điều trị đột quỵ thiếu máu não cấp tính, tránh dùng aspirin trong vòng 24h sau khi dùng alteplase do làm tăng nguy cơ chuyển dạng xuất huyết đối với ổ nhồi máu não.
- Theo AHA/ASA 2016, alteplase được khuyến cáo cho những bệnh nhân sử dụng liệu pháp đơn trị bằng thuốc kháng kết tập tiểu cầu hoặc liệu pháp kháng tiểu cầu kép (ví dụ: aspirin và clopidogrel) trước khi đột quỵ thiếu máu não cấp xảy ra dựa trên bằng chứng lợi ích vượt trội so với nguy cơ xuất huyết nội sọ.
6.3. Heparin và heparin trọng lượng phân tử thấp
- Thuốc chống đông máu đường tiêm dùng đồng thời có thể làm tăng nguy cơ chảy máu.
- Trong điều trị đột quỵ thiếu máu não cấp, theo AHA/ASA 2013 không nên bắt đầu điều trị chống đông máu trong vòng 24h đầu điều trị bằng alteplase.
- Theo AHA/ASA 2016, sử dụng alteplase không được khuyến cáo cho đột quỵ thiếu máu não cấp tính ở những bệnh nhân đã được điều trị heparin trọng lượng phân tử thấp trong vòng 24h trước.
7. TƯƠNG TÁC THUỐC
- Các tác nhân có đặc tính chống tiểu cầu (ví dụ, các chất ức chế P2Y12, NSAID, …) làm tăng tác dụng chống đông máu của các thuốc tiêu sợi huyết.
- Thuốc chống đông máu: Thuốc tiêu sợi huyết có thể làm tăng tác dụng chống đông máu của các thuốc chống đông máu.
- Aprotinin: có thể làm giảm tác dụng điều trị của thuốc tiêu sợi huyết.
- Dabigatran: thuốc tiêu sợi huyết có thể làm tăng tác dụng chống đông máu của dabigatran.
- Desirudin: thuốc tiêu sợi huyết có thể làm tăng tác dụng chống đông máu của desirudin.
- Các loại thảo mộc có thuộc tính chống đông máu/kháng kết tập tiểu cầu (ví dụ: Alfalfa, Anise, Bilberry): có thể làm tăng tác dụng phụ của thuốc tiêu sợi huyết. Chảy máu có thể xảy ra.
- Limaprost: có thể tăng tác dụng phụ của thuốc tiêu sợi huyết. Nguy cơ chảy máu có thể tăng lên.
- Nitroglycerin: có thể làm giảm nồng độ trong huyết thanh của alteplase.
- Các dẫn xuất prostacyclin: các thuốc tiêu sợi huyết có thể làm tăng tác dụng phụ của các dẫn xuất prostacyclin (ví dụ: tăng nguy cơ chảy máu do tăng tác dụng kháng tiểu cầu của prostacyclin khi kết hợp với các thuốc tan huyết khối).
- Salicylates: có thể làm tăng tác dụng phụ của thuốc tiêu sợi huyết. Tăng nguy cơ chảy máu có thể xảy ra.
8. ÁP DỤNG LÂM SÀNG LIỆU PHÁP TIÊU SỢI HUYẾT
8.1. Nhồi máu cơ tim cấp
- Bằng chứng lâm sàng:
- Một nghiên cứu phân tích gộp năm 1994 từ các nhóm thử nghiệm liệu pháp tiêu sợi huyết cho thấy rằng lợi ích giảm tỷ lệ tử vong tuyệt đối từ liệu pháp tiêu sợi huyết khối ở thời điểm 5 tuần là 3% đối với những bệnh nhân được điều trị trong vòng 6h kể từ khi khởi phát triệu chứng; 2 % đối với những bệnh nhân được điều trị trong vòng 12h và 1% cho những bệnh nhân trong vòng 13 đến 18h. Hiệu quả trong các thử nghiệm thuốc tiêu sợi huyết đã làm giảm khoảng 30% tỷ lệ tử vong ngắn hạn xuống giá trị từ 7 đến 10%.
- Trong thử nghiệm GISSI-1 (The first Gruppo Italiano per lo Studio della Streptochinasi nell’Infarto) và ISIS-2 (The second International Study of Infarct Survival), lợi ích sinh tồn vẫn tồn tại sau 10 năm dùng alteplase. Lợi ích khi dùng alteplase là lớn nhất ở những bệnh nhân dưới 75 tuổi và ở những bệnh nhân nhồi máu thành trước. Tuy nhiên, lợi ích cải thiện tỷ lệ tử vong cũng nhận thấy ở hầu hết các nhóm nhỏ, bao gồm cả những bệnh nhân lớn tuổi, tăng huyết áp hoặc tiền sử nhồi máu cơ tim hoặc phẫu thuật bắc cầu chủ vành.
- Một đánh giá của 38 thử nghiệm liên quan đến trị liệu bằng reteplase, tenecteplase và lanoteplase cho thấy hiệu quả và độ an toàn tương tự như alteplase và các thuốc này thuận tiện hơn khi sử dụng vì sử dụng bolus. Tenecteplase (TNK) là loại tiêu sợi huyết dễ sử dụng nhất (bolus đơn) và trong thử nghiệm ASSENT-2 ( Assessment of the Safety of a New Thrombolytic) có liên quan đến tỷ lệ biến chứng chảy máu (ngoài não) thấp hơn so với alteplase. Ngược lại, lanoteplase có liên quan đến sự gia tăng đột quỵ xuất huyết ở thử nghiệm InTIME-II (1,12% so với 0,64%) đã hạn chế sử dụng lâm sàng và trong GUSTO III (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries), reteplase có hiệu quả kém hơn alteplase. Mặc dù điều trị kết hợp với một nửa liều điều trị tiêu sợi huyết và thuốc ức chế glycoprotein IIb / IIIa có liên quan đến các biến cố thiếu máu cục bộ ít hơn so với điều trị tiêu sợi huyết đơn thuần trong GUSTO V và ASSENT-3 nhưng không làm giảm nguy cơ tử vong mà còn tăng nguy cơ chảy máu, đặc biệt ở người lớn tuổi.
- Liều dùng:
– Alteplase: Liều khuyến cáo tổng liều dựa trên cân nặng bệnh nhân (không quá 100mg).
- Bệnh nhân ≤ 67 kg: 15 mg bolus trong 1-2 phút, sau đó 0,75 mg/kg (tối đa 50 mg) trong 30 phút, sau đó 0,5 mg/kg (tối đa 35 mg) trong 60 phút.
- Bệnh nhân > 67 kg: 15 mg bolus trong 1-2 phút, sau đó 50 mg trong 30 phút, sau đó 35 mg trong 60 phút.
– Reteplase: Liều reteplase dành cho người lớn bao gồm hai liều tĩnh mạch; mỗi liều bolus 10 đơn vị trong 2 phút; cách nhau 30 phút/ liều.
– Tenecteplase: Bolus 30-50 mg tĩnh mạch trong 5 giây tùy theo cân nặng của bệnh nhân:
- <60 kg: 30 mg
- 60 đến 69 kg: 35 mg
- 70 đến 79 kg : 40 mg
- 80 đến 89 kg: 45 mg
- ≥ 90 kg: 50 mg
– Streptokinase: 1,5 triệu đơn vị truyền tĩnh mạch trong 30- 60 phút.
– APSAC (anistreplase): 30 UI được truyền tĩnh mạch trong 2 – 5 phút.
8.2. Đột quỵ thiếu máu não cấp
- Bằng chứng lâm sàng
Một phân tích tổng hợp năm 2014 đánh giá từ 6756 bệnh nhân (bao gồm hơn 1700 người trên 80 tuổi) đột quỵ thiếu máu não cấp tính được sử dụng alteplase so với nhóm chứng trong các thử nghiệm NINDS, ATLANTIS, ECASS (1, 2 và 3), thử nghiệm EPITHET và IST-3. Kết cục đánh giá bệnh nhân sau ba hoặc sáu tháng được xác định bằng thang điểm Rankin đã sửa đổi là 0 hoặc 1 (nghĩa là không có khuyết tật đáng kể). Các kết quả sau đây đã được báo cáo:
- Điều trị trong vòng 3h kể từ khi khởi phát đột quỵ, alteplase cho kết quả tốt trong 33%, so với 23% ở nhóm chứng (OR: 1,75, 95% CI: 1,35-2,27).
- Đối với điều trị từ 3 đến 4,5h, tỷ lệ có kết quả tốt trong nhóm alteplase và nhóm chứng là 35% và 30% (OR: 1,26, 95% CI: 1,05-1,51).
- Đối với điều trị sau 4,5h, tỷ lệ có kết quả tốt trong nhóm alteplase và nhóm chứng là 33 % và 31 % (OR: 1,15, 95% CI: 0,95-1,40).
- Lợi ích của alteplase là tương tự nhau bất kể tuổi bệnh nhân hay mức độ nặng của đột quỵ.
- Alteplase làm tăng nguy cơ xuất huyết nội sọ có triệu chứng (6,8%, so với 1,3% đối với nhóm chứng, OR: 5,55, 95% CI: 4,01-7,70).
- Tử vong sau 90 ngày cao hơn một chút ở nhóm alteplase (17,9%, so với 16,5% ở nhóm đối chứng, OR: 1,11, 95% CI: 0,99-1,25).
- Liều dùng
– Alteplase: Tổng liều: 0,9 mg/kg (liều tối đa 90 mg)
- Bệnh nhân < 100 kg: Liều nạp bolus 0,09 mg/kg (10% của 0,9 mg/kg), sau đó 0,81 mg/kg (90% của 0,9 mg/kg) truyền tĩnh mạch trong 60 phút.
- Bệnh nhân ≥ 100 kg: Liều nạp bolus 9 mg (10% của 90 mg), sau đó 81 mg (90% của 90 mg) truyền tĩnh mạch trong 60 phút.
- Theo dõi
- Tất cả các bệnh nhân được điều trị bằng alteplase cần theo dõi tại đơn vị hồi sức tích cực trong ít nhất 24h.
- Cần loại trừ xuất huyết nội sọ ở bất kỳ bệnh nhân nào có triệu chứng suy giảm ý thức, đau đầu, buồn nôn và nôn hoặc tăng huyết áp đột ngột sau khi điều trị tiêu sợi huyết, đặc biệt là trong 24h đầu điều trị .
- Các biện pháp quan trọng trong 24h đầu điều trị alteplase bao gồm:
- Cần kiểm tra các dấu hiệu sinh tồn và tình trạng thần kinh sau mỗi 15 phút trong 2h đầu, sau đó cứ sau 30 phút trong 6h tiếp theo sau đó cứ sau 60 phút cho đến khi 24h kể từ khi bắt đầu điều trị alteplase.
- Huyết áp phải được duy trì không quá 180/105 mmHg trong 24h đầu tiên.
- Thuốc chống đông như heparin, warfarin hoặc các loại thuốc kháng kết tập tiểu cầu không nên dùng ít nhất 24h sau khi truyền alteplase.
- Nên chụp CT não (hoặc MRI) 24h sau khi bắt đầu sử dụng alteplase, trước khi bắt đầu điều trị bằng thuốc kháng kết tập tiểu cầu hoặc thuốc chống đông máu.
- Biến chứng và xử trí
Biến chứng nguy hiểm của điều trị tiêu sợi huyết là xuất huyết nội sọ có triệu chứng. Chảy máu toàn thân và phù mạch là những biến chứng khác có thể xảy ra.
– Xuất huyết nội sọ: Xuất huyết nội sọ nên nghi ngờ ở bất kỳ bệnh nhân nào bị suy giảm chức năng thần kinh đột ngột, giảm ý thức, đau đầu, buồn nôn và nôn hoặc tăng huyết áp đột ngột sau khi điều trị tiêu sợi huyết, đặc biệt là 24h đầu điều trị. Ở những bệnh nhân nghi ngờ xuất huyết nội sọ, cần ngừng truyền alteplase và chụp cắt lớp vi tính hoặc chụp cộng hưởng từ sọ não. Các biện pháp điều trị cho xuất huyết nội sọ liên quan đến điều trị alteplase chưa được chứng minh hiệu quả tuyệt đối nhưng sử dụng các tác nhân để đảo ngược tác dụng của điều trị tiêu sợi huyết là cần thiết:
- Cryoprecipitate: 10 đơn vị ngay lập tức (truyền trong vòng 10 đến 30 phút) và nhiều hơn nếu cần để đạt được mức fibrinogen huyết thanh từ 150 đến 200 mg /dL.
- Thuốc chống tiêu sợi huyết: acid aminocaproic truyền tĩnh mạch 4 – 5 g trong giờ đầu tiên, sau đó là 1 g/h trong 8h cho đến khi chảy máu được kiểm soát hoặc acid tranexamic 10 – 15 mg/kg truyền tĩnh mạch trong vòng 10 đến 20 phút.
- Phức hợp prothrombin như một liệu pháp bổ trợ đối với bệnh nhân dùng warfarin trước khi điều trị alteplase.
- Huyết tương tươi đông lạnh như một liệu pháp bổ trợ cho bệnh nhân dùng warfarin trước khi điều trị alteplase nếu không sẵn có phức hợp prothrombin.
- Vitamin K là liệu pháp bổ trợ cho bệnh nhân dùng warfarin trước khi điều trị bằng alteplase.
- Truyền khối tiểu cầu cho bệnh nhân giảm tiểu cầu (số lượng tiểu cầu < 100000/µL). Ở những bệnh nhân sử dụng heparin không phân đoạn vì bất kỳ lý do gì, cần tiêm 1 mg protamine cho mỗi 100 đơn vị heparin trong 4h trước đó.
- Ngoài ra, yếu tố tái tổ hợp VIIa cũng là biện pháp hỗ trợ cầm máu.
Hội chẩn cấp cứu chuyên khoa phẫu thuật thần kinh và huyết học cho bệnh nhân xuất huyết nội sọ có triệu chứng liên quan đến alteplase. Điều trị hỗ trợ bao gồm kiểm soát huyết áp, áp lực nội sọ, áp lực tưới máu não và kiểm soát đường máu.
– Chảy máu toàn thân: Chảy máu toàn thân nhẹ thường xảy ra ở các vị trí đặt ống thông tĩnh mạch, chảy máu niêm mạc miệng. Những biến chứng này thường không cần phải ngừng điều trị. Chảy máu nghiêm trọng hơn, chẳng hạn như xuất huyết tiêu hóa hoặc đường tiết niệu sinh dục, có thể phải ngừng sử dụng alteplase tùy thuộc vào độ nặng của chảy máu. Đôi khi, bệnh nhân đột quỵ não sau nhồi máu cơ tim có thể bị chảy máu khoang màng ngoài tim, dẫn đến ép tim cấp. Do đó, bệnh nhân tụt huyết áp sau khi dùng alteplase nên được đánh giá bằng siêu âm tim cấp.
– Phù mạch: xảy ra trong 1-8 % bệnh nhân đột quỵ được điều trị bằng alteplase và thường là nhẹ, thoáng qua. Phù mạch nghiêm trọng rất hiếm gặp nhưng cần xử trí cấp cứu nếu xảy ra.
- Kiểm soát đường thở: đặt nội khí quản hoặc mở khí quản cấp nếu cần.
- Ngừng truyền alteplase.
- Thuốc:
Methylprednisolone 125 mg tiêm tĩnh mạch.
Diphenhydramine 50 mg tiêm tĩnh mạch.
Ranitidine 50 mg hoặc famotidine 20 mg tiêm tĩnh mạch.
Epinephrine (0,1%) 0,3 mL tiêm dưới da hoặc 0,5 mL khí dung.
8.3. Thuyên tắc động mạch phổi cấp
- Bằng chứng lâm sàng
Một số thử nghiệm đã đánh giá hiệu quả của liệu pháp tiêu sợi huyết đường toàn thân ở bệnh nhân thuyên tắc động mạch phổi huyết động không ổn định với xu hướng chung là cải thiện tỷ lệ tử vong. Một phân tích gộp các thử nghiệm đã thực hiện phân tích phân nhóm 154 bệnh nhân mắc thuyên tắc động mạch phổi lớn (nguy cơ cao) và cho thấy điều trị tiêu sợi huyết đã làm giảm kết cục tử vong và thuyên tắc huyết khối tái phát (9,4% so với 19%, OR: 0,45, 95% CI: 0,22-0,92). Một phân tích gộp khác đã báo cáo giảm tỷ lệ tử vong do mọi nguyên nhân ngắn hạn ở những bệnh nhân thuyên tắc động mạch phổi huyết động không ổn định được điều trị bằng liệu pháp tiêu sợi huyết so với những bệnh nhân không được điều trị bằng thuốc tiêu sợi huyết.
- Liều dùng, cách dùng:
- tPA (alteplase): 100 mg truyền tĩnh mạch trong 2h hoặc 0,6 mg/kg trong 15 phút (liều tối đa 50 mg).
- Streptokinase: 250.000 đơn vị truyền tĩnh mạch trong 30 phút, sau đó 100000 đơn vị/giờ trong 12- 24h. Cần theo dõi chặt chẽ các nguy cơ hạ huyết áp, sốc phản vệ, phản ứng dị ứng.
- Urokinase: 4400 đơn vị/kg truyền tĩnh mạch trong 10 phút, sau đó 4400 đơn vị / kg mỗi giờ trong 12h.
8.4. Kẹt van cơ học do huyết khối
- Bằng chứng lâm sàng
Bằng chứng liên quan đến hướng dẫn sử dụng thuốc tiêu sợi huyết ở bệnh nhân huyết khối van tim cơ học còn hạn chế. Chủ yếu dữ liệu quan sát về hiệu quả và độ an toàn của phác đồ điều trị tiêu sợi huyết đối với huyết khối van cơ học giới hạn ở nghiên cứu đơn trung tâm. Còn hạn chế dữ liệu về so sánh trực tiếp giữa các thuốc tiêu sợi huyết. Hầu hết các bằng chứng được công bố về thuốc tiêu sợi huyết đều liên quan đến alteplase, trong khi streptokinase là thuốc đầu tiên được sử dụng thành công cho bệnh nhân kẹt van cơ học do huyết khối.
- Liều dùng
- Alteplase: 10 mg bolus trong sau đó 90 mg truyền tĩnh mạch trong 90 phút. Liều thấp kéo dài: 1 mg/h trong 25 h, có thể nhắc lại liều này, tổng liều có thể lên đến 200 mg nếu siêu âm qua thực quản còn huyết khối.
- Streptokinase: 1,5 triệu đơn vị truyền tĩnh mạch trong 60 phút.
TÀI LIỆU THAM KHẢO
- Phạm Mạnh Hùng. Lâm sàng Tim mạch học. NXB Y học, 2019.
- Katzan IL, Spertus J, Bettger JP, et al. Risk adjustment of ischemic stroke outcomes for comparing hospital performance: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014 Mar. 45(3):918-44.
- O’Gara PT, Kushner FG, Ascheim DD, et al, for the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013 Jan 29. 127(4):e362-425.
- Mozaffarian D, Benjamin EJ, Go AS, et al, American Heart Association Statistics Committee, et al. Heart disease and stroke statistics-2016 update: a report from the American Heart Association. Circulation. 2016 Jan 26. 133(4):e38-360
- Streptokinase (Streptase) [package insert]. Ottawa, Ontario: CSL Behring Canada, Inc. 2007
- Gurewich V, Pannell R, Simmons-Byrd A, et al. Thrombolysis vs bleeding from hemostatic sites by a prourokinase mutant compared with tissue plasminogen activator. J Thromb Haemost. July 2006. 4(7):1559-65.
- Urokinase (Abbokinase, Kinlytic) [package insert]. Tucson, Arizona: ImaRx Therapeutics, Inc. 2007.
- Van De Werf F, Adgey J, Ardissino D, et al. Single-bolus tenecteplase compared with front-loaded alteplase in acute myocardial infarction: the ASSENT-2 double-blind randomised trial. Lancet. August 1999. 354(9180):716-2.
- Tenecteplase [package insert]. South San Francisco, CA: Genentech, Inc. 2013.
- Reteplase [package insert]. McPherson, KS: EKR Therapeutics, Inc. 2009
- Ouriel K. A history of thrombolytic therapy. J Endovasc Ther. 2004 Dec. 11 Suppl 2:II128-33.
- Murao K, Leys D, Jacquin A, et al, for the OPHELIE-COG investigators. Thrombolytic therapy for stroke in patients with preexisting cognitive impairment. Neurology. 2014 Jun 10. 82(23):2048-54c