FFR (Fractional Flow Reserve) là gì?
Phân số dự trữ lưu lượng vành (Fractional Flow Reserve, FFR) được định nghĩa là tỉ số giữa lưu lượng tối đa cấp máu cho cơ tim của động mạch vành bị hẹp so với lưu lượng tối đa của động mạch đó khi không tổn thương. FFR thể hiện ảnh hưởng của chỗ hẹp đối với khả năng tưới máu của mạch vành, qua đó gián tiếp đánh giá mức độ nặng của tổn thương. FFR bằng 0,6 nghĩa là lưu lượng mạch vành chỉ đạt được 60% giá trị lý tưởng, và đòi hỏi sau đặt stent phải nâng FFR lên con số lý thuyết 1,0.
1. Giới thiệu về FFR
Ngay từ những ngày đầu tiên của kỷ nguyên nong bóng động mạch vành (ĐMV), Gruentzig và các nhà tim mạch can thiệp khác đã nhận thấy có thể dựa vào đo áp lực để xác định mức độ hẹp động mạch vành và đánh giá hiệu quả điều trị. Mặc dù vậy, kỹ thuật này ít được triển khai do còn thiếu cơ sở lý thuyết vững chắc. Nhất là trong những năm 1980, khi đo diện tích lòng mạch theo phương pháp QCA (Chụp mạch vành định lượng) phát triển mạnh mẽ, nhiều người tin rằng phim chụp mạch cản quang là đủ và không cần tiến hành thêm các thăm dò chức năng khác.
Tuy nhiên, thực tế đã chứng minh chụp mạch vành đơn thuần có nhiều hạn chế trong đánh giá và tiên lượng tổn thương. Chính vì vậy, các bác sĩ can thiệp lại bắt đầu quan tâm tới lưu lượng và áp lực mạch vành. Nhiều thông số như dự trữ vành (Coronary Flow Reserve, CFR), chỉ số sức cản tuần hoàn mao mạch (Index of Microcirculatory Resistance, IMR), phân số dự trữ lưu lượng vành (Fractional Flow Reserve, FFR) được nghiên cứu nhằm đưa ra một chỉ số tối ưu để đánh giá chức năng cấp máu của mạch vành. Nhiều loại dây dẫn (guidewire) cho phép đo vận tốc dòng chảy và áp lực nội mạch được sản xuất và triển khai trong thực hành lâm sàng.
Năm 1993, bác sĩ Pijls và cộng sự tiến hành thực nghiệm kinh điển trên chó, xây dựng cơ sở lý thuyết để tính toán FFR. Năm 1996, De Bruyne và Pijls so sánh FFR với các thăm dò không xâm nhập khác, như siêu âm tim gắng sức, MRI tim gắng sức, chụp xạ hình tưới máu cơ tim, đề ra ngưỡng FFR để chẩn đoán thiếu máu cơ tim. Kể từ đó, FFR dần được ứng dụng rộng rãi, và ngày càng chứng tỏ vai trò của mình trong chẩn đoán và điều trị bệnh mạch vành.
2. Các lợi ích của FFR
Về lý thuyết, phân số dự trữ lưu lượng vành có nhiều ưu điểm khiến nó có thể đánh giá chính xác mức độ hẹp chức năng của động mạch vành, đồng thời giúp bác sĩ đưa ra các quyết định can thiệp.
Trước hết, FFR không phụ thuộc vào tình trạng huyết động của bệnh nhân. Ở bệnh nhân chụp và can thiệp mạch vành, huyết áp, nhịp tim và sức co bóp cơ tim có xu hướng dao động và không ổn định so với trạng thái bình thường. Tuy nhiên, các biến đổi huyết động ít ảnh hưởng đến giá trị FFR; một phần nhờ áp lực đầu gần và đầu xa của động mạch được đo đồng thời, phần khác nhờ đặc tính giãn mạch tối đa của hệ mao mạch. Do đó, FFR có độ chính xác và độ tin cậy cao.
Thứ hai, FFR tính đến ảnh hưởng của tuần hoàn bàng hệ. Mô cơ tim có thể được cấp máu “xuôi chiều” nhờ hệ động mạch vành theo giải phẫu, hoặc “ngược chiều” qua hệ thống tuần hoàn bàng hệ. Áp lực đầu xa động mạch vành khi mạch vành giãn tối đa phản ánh vai trò tưới máu của cả hai hệ thống trên.
Thứ ba, FFR phản ánh mức độ hẹp động mạch vành chứ không phải diện tích tuyệt đối của lòng mạch. Chúng ta biết rằng các mạch máu có kích thước khác nhau (như thân chung ĐMV trái có kích thước lớn hơn nhánh chéo của động mạch liên thất trước), cũng như phụ thuộc kích cỡ của bệnh nhân (người cao thì mạch máu lớn hơn). Tuy nhiên với bất kì mạch máu nào, giá trị FFR đo được (ví dụ: FFR = 0,7) luôn gây ra một ảnh hưởng huyết động tương tự.
Cuối cùng, FFR đặc hiệu cho một tổn thương cụ thể. Nếu như xạ hình tưới máu cơ tim chỉ cung cấp thông tin về vùng cơ tim tổn thương, qua đó xác định nhánh động mạch vành tổn thương, thì cảm biến áp lực trên guidewire giúp bác sĩ can thiệp biết đích xác vị trí hẹp mạch vành gây triệu chứng lâm sàng, với biên độ dao động chỉ khoảng vài mm. Nhờ đó đưa ra quyết định can thiệp thích hợp.
3. Các bước tiến hành đo FFR
3.1. Thiết bị đo FFR
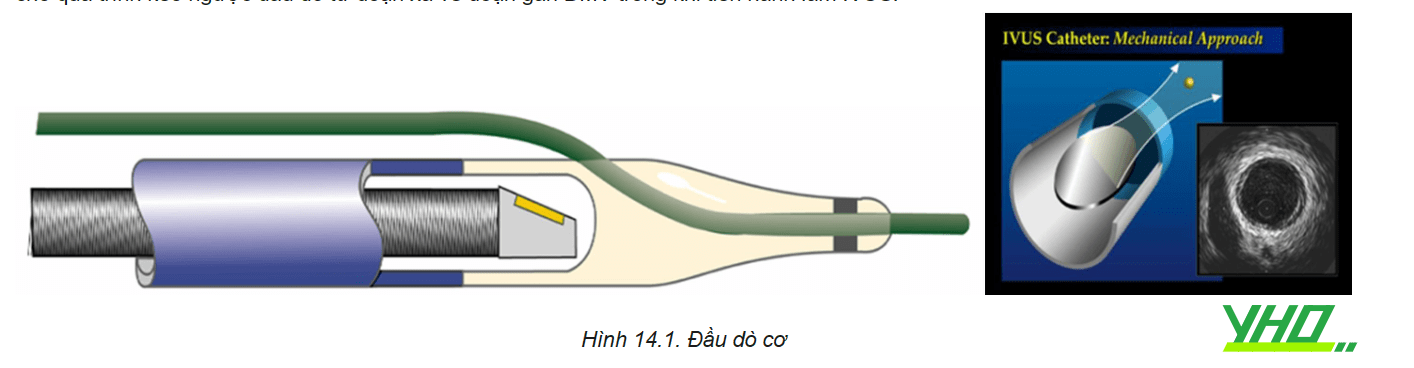
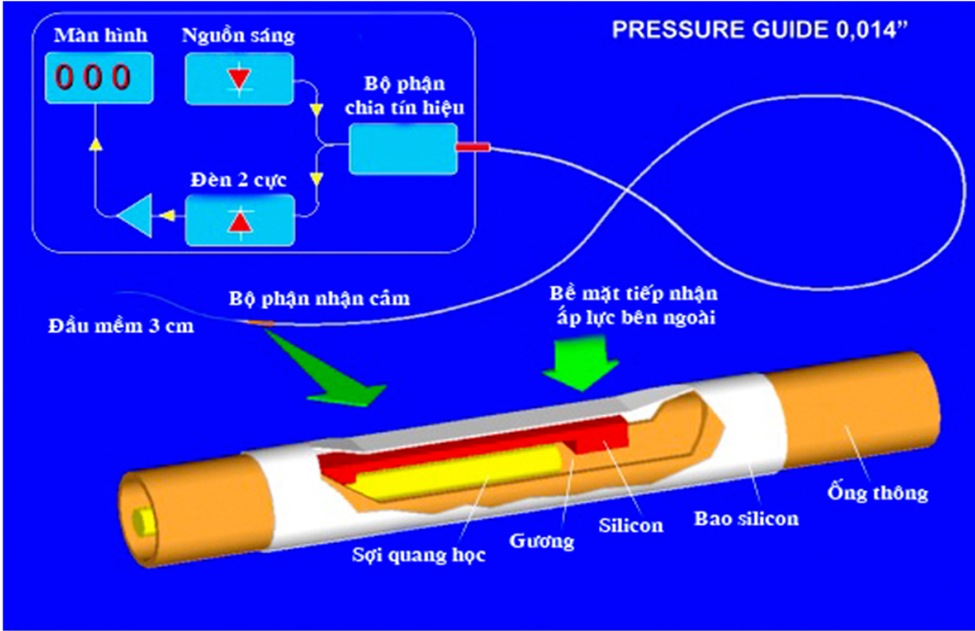
Để đo áp lực trong lòng mạch vành, người ta sử dụng một dây dẫn đặc biệt có gắn cảm biến áp lực. Cảm biến này nằm cách đầu xa của dây dẫn 3 cm. Áp lực đo được sẽ truyền về bộ phận nhận cảm, qua hệ thống xử lý và hiện lên màn hình theo dõi, cho phép bác sĩ tim mạch can thiệp đánh giá trực tiếp FFR trong lúc làm thủ thuật. Dây dẫn áp lực có kích cỡ 0,014 inch, thao tác hoàn toàn tương tự dây dẫn can thiệp mạch vành thông thường. Nó được đưa vào các nhánh động mạch vành qua ống thông can thiệp 5Fr, 6Fr hoặc 7Fr, mặc dù một số nghiên cứu cũng sử dụng cả ống thông chẩn đoán 5Fr.
Hiện nay có hai loại dây dẫn được FDA chấp thuận sử dụng là PressureWire của hãng Radi Medical và Volcano Wave- Wire của hãng Volcano Inc.
 Hình 1: Dây dẫn có gắn cảm biến áp lực dùng để khảo sát FFR
Hình 1: Dây dẫn có gắn cảm biến áp lực dùng để khảo sát FFR3.2 Quy trình kỹ thuật đặt ống thông can thiệp tại lỗ vào ĐMV
- Dây dẫn áp lực nối với hệ thống phân tích áp lực.
- Tiêm heparin như thủ thuật can thiệp ĐMV thông thường.
- Bơm nitroglycerin vào ĐMV (100-200 µg) để gây giãn tối đa ĐMV ở thượng tâm mạc.
- Trước khi đưa dây dẫn qua ống thông vào mạch vành, tiến hành cân bằng áp lực. Đặt dây dẫn ở vị trí sao cho cảm biến áp lực nằm ngay tại đầu ống thông can thiệp (Hình 2). Nhấn nút Equalizer trên máy đo. Áp lực đo ở đầu ống thông can thiệp và đo ở đầu cảm biến áp lực (khi dây dẫn còn nằm ngoài ĐMV) phải trùng nhau, chênh lệch không quá 5 mmHg.
- Đưa dây dẫn áp lực qua chỗ hẹp đến đầu xa của động mạch vành tổn thương.
- Gây trạng thái giãn mạch vành tối đa bằng adenosine tiêm mạch vành (50 µg với ĐMV phải, 60-100 µg với ĐMV trái), hoặc truyền adenosine tĩnh mạch liên tục.
- Khảo sát FFR bằng cách tính chỉ số Pd/Pa. FFR được đo tại thời điểm chỉ số Pd/Pa thấp nhất sau khi thuốc giãn mạch khởi phát tác dụng, thường trong vòng 2 phút sau tiêm adenosine tĩnh mạch và 15-20 giây sau tiêm adenosine nội mạch vành.
- Trường hợp FFR < 0,8, có tương quan chặt chẽ với thiếu máu cục bộ và là một chỉ định để tái tưới máu ĐMV. Nếu FFR ≥ 0,8, cho thấy tổn thương hẹp không gây ảnh hưởng dòng chảy ĐMV, vì thế có thể điều trị bảo tồn.
- Nếu cần can thiệp mạch vành qua da, tiến hành nong bóng và đặt stent ĐMV với dây dẫn áp lực, tương tự các ca can thiệp ĐMV thông thường.
- Khi đưa bóng vào chỗ hẹp và bơm bóng, áp lực đầu xa sẽ giảm đi, chênh áp sẽ tăng nhẹ (Pd/Pa giảm). Lúc bơm căng bóng tối đa, mạch vành bị tắc tạm thời, nhưng vẫn có thể tiếp tục đo áp lực ở đầu tận guide wire (Pw), qua đó đánh giá vai trò của tuần hoàn bàng hệ. Tỉ số Pw/Pa <0,25 thường gây đau ngực cùng biến đổi trên điện tâm đồ.
- Sau thủ thuật, đo lại FFR để đánh giá hiệu quả can thiệp và ảnh hưởng của phần hẹp còn lại lên các đoạn mạch khác.
- FFR sau thủ thuật dưới 0,75 đồng nghĩa với can thiệp ĐMV chưa đạt hiệu quả tối ưu, mặc dù có thể không còn hẹp trên phim chụp mạch. FFR nằm trong khoảng từ 0,75 đến 0,9 tương ứng với tỉ lệ tái hẹp sau 6 tháng cao tới 30%.
- FFR sau đặt stent phải đạt mức tối thiểu 0,9. Trong các trường hợp hẹp nhiều chỗ, hẹp lan tỏa mạch vành, cần đo thêm áp lực ở đầu gần và đầu xa stent sau can thiệp. Tỉ lệ áp lực đầu xa/đầu gần ≥ 0,94 tương ứng với kết quả can thiệp tối ưu khi đánh giá bằng
- Cuối cùng, tại thời điểm kết thúc thủ thuật, kéo dây dẫn áp lực lại vào trong ống thông để chắc chắn rằng tín hiệu áp lực ổn định (các kết quả áp lực bằng nhau) và không có chênh áp.
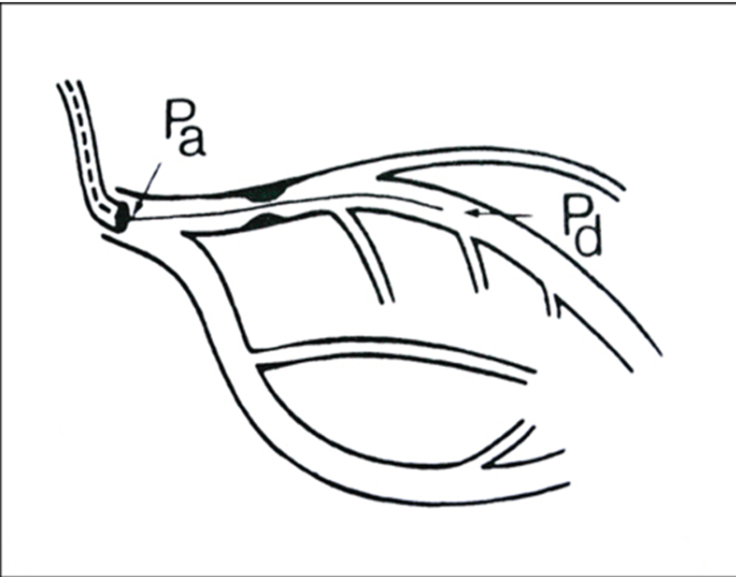 Hình 2: Mô tả kỹ thuật khảo sát FFR
Hình 2: Mô tả kỹ thuật khảo sát FFR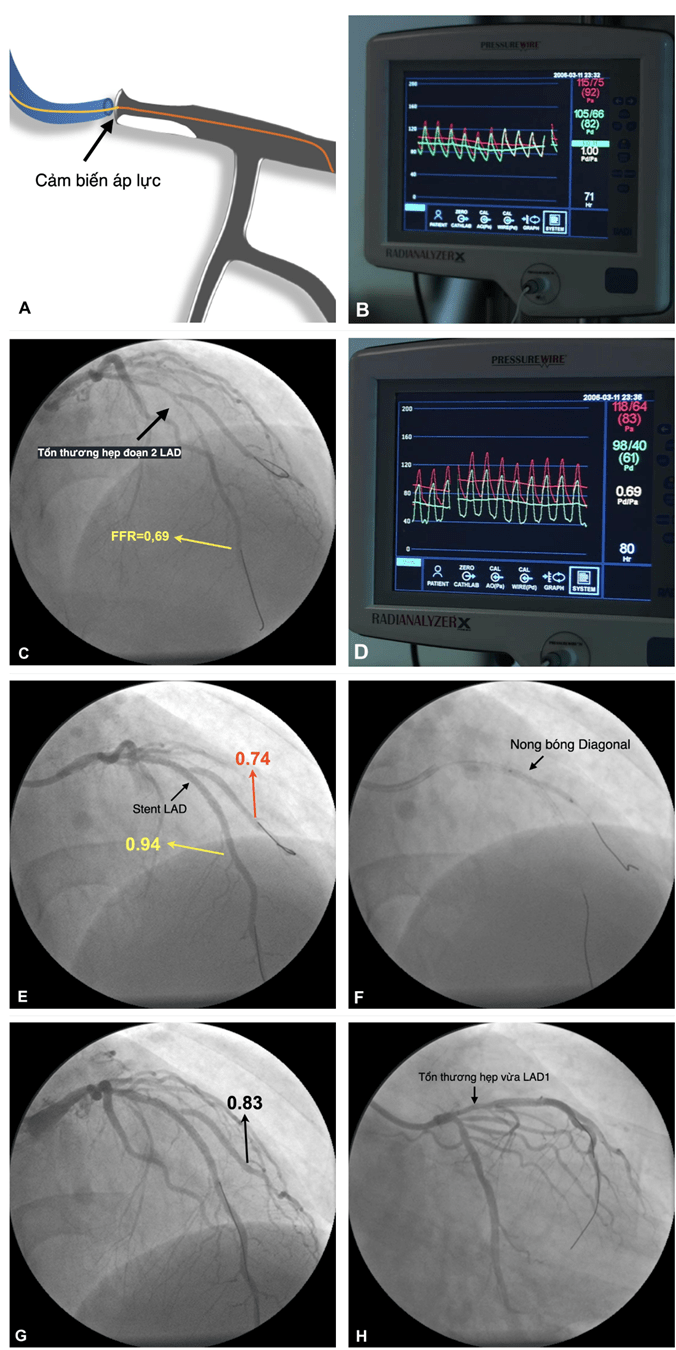 Hình 3: Quy trình khảo sát FFR bệnh nhân có hẹp động mạch liên thất trước (LAD).
Hình 3: Quy trình khảo sát FFR bệnh nhân có hẹp động mạch liên thất trước (LAD).A: Đưa dây dẫn áp lực đến đầu ống thông can thiệp.
B: Tiến hành cân bằng áp lực (Equalizer) đảm bảo áp lực đo ở cảm biến áp lực (Pd) bằng với áp lực đo ở đầu ống thông (Pa).
C: Đẩy dây dẫn áp lực đến đoạn xa LAD, đo FFR=0,69.
D: Hình ảnh FFR=0,69 trên máy đo, cho thấy tổn thương hẹp LAD có ý nghĩa về huyết động.
E: Sau khi đặt stent LAD, FFR đo ở đoạn xa LAD là 0,94 cho thấy kết quả đặt stent tốt, tuy nhiên có hẹp nhánh bên (Diagonal), đo FFR ở Diagonal là 0,74.
F: Nong bóng Diagonal.
G: Khảo sát FFR nhánh Diagonal sau nong bóng là 0,83.
H: Hình ảnh chụp động mạch vành sau khi hoàn thành thủ thuật, hẹp LAD1 mức độ vừa tuy nhiên không gây ảnh hưởng sinh lý dòng chảy mạch vành (do FFR LAD=0,94), kết thúc thủ thuật.
4. Những trường hợp cần tiến hành FFR
Theo khuyến cáo của Hiệp hội Tim mạch châu Âu (ESC), chỉ định khảo sát FFR trong các trường hợp sau:
- Đánh giá ảnh hưởng sinh lý và huyết động của tổn thương hẹp động mạch vành (ĐMV) mức độ vừa.
- Xác định nhánh ĐMV thủ phạm trong các trường hợp tổn thương nhiều thân ĐMV
- Đánh giá ảnh hưởng của chỗ hẹp đối với dòng chảy ĐMV trong trường hợp có tuần hoàn bàng hệ đoạn
- Xác định vị trí chính xác của chỗ hẹp ĐMV trong trường hợp hình ảnh phim chụp ĐMV không rõ ràng.
- Đưa ra quyết định can thiệp tái tưới máu ở bệnh nhân hội chứng động mạch vành mạn tính.
5. Các nghiên cứu về ứng dụng của FFR trong các trường hợp tổn thương động mạch vành
Rất nhiều nghiên cứu đã được tiến hành chứng minh vai trò của FFR trong can thiệp ĐMV. Kết quả nghiên cứu cho thấy dựa vào FFR để đưa ra quyết định can thiệp sẽ đem lại lợi ích lớn hơn, so với chỉ dựa vào hình ảnh chụp ĐMV đơn thuần.
Bảng 14.6. Tổng hợp một số nghiên cứu về ứng dụng của FFR trong đánh giá tổn thương động mạch vành
| THỬ NGHIỆM | THIẾT KẾ NGHIÊN CỨU | N | ĐIỀU TRỊ | KẾT QUẢ |
| DEFER | Ngẫu nhiên đa trung tâm | 325 | PCI và FFR có hướng dẫn | Không cải thiện lợi ích sống còn khi tái thông mạch với FFR ≥ 0,75. |
| FAME | Ngẫu nhiên đa trung tâm | 750 | PCI dưới hướng dẫn của FFR so với chụp mạch thông thường | Các biến cố tim mạch lớn (tử vong, nhồi máu cơ tim hoặc tái can thiệp) ít hơn ở nhóm PCI dưới hướng dẫn của FFR trong tổn thương ĐMV đa mạch. |
| FAME II | Ngẫu nhiên đa trung tâm | 1220 | PCI dưới hướng dẫn của FFR + điều trị nội khoa với điều trị nội khoa đơn thuần | Các biến cố tim mạch lớn ít hơn ở nhóm PCI dưới hướng dẫn của FFR + điều trị nội khoa. |
5.1. Tổn thương hẹp vừa động mạch vành hoặc tổn thương khó đánh giá trên phim chụp mạch
Chỉ định chính của FFR là dùng để đánh giá chính xác mức độ tổn thương trong các trường hợp hẹp ĐMV khó đánh giá trên phim chụp mạch.
Trong nghiên cứu mang tính đột phá năm 1996, Pijls, De Bruyne và cộng sự so sánh FFR với điện tâm đồ gắng sức, xạ hình tưới máu cơ tim, siêu âm tim gắng sức ở 45 bệnh nhân có hẹp ĐMV mức độ vừa trên phim chụp mạch. Chẩn đoán bệnh mạch vành khi có ít nhất một thăm dò không xâm nhập cho kết quả dương tính ở thời điểm ban đầu, đồng thời âm tính sau can thiệp tái tưới máu (đặt stent hoặc phẫu thuật). Kết quả nghiên cứu cho thấy ngưỡng FFR < 0,75 có giá trị chẩn đoán thiếu máu cục bộ cơ tim, với độ nhạy và độ đặc hiệu là 88% và 100%, giá trị chẩn đoán dương tính và âm tính lần lượt là 88% và 93%.
Sau đó, nhóm nghiên cứu đánh giá tính an toàn của trì hoãn can thiệp mạch vành dựa theo FFR. Trong nghiên cứu DEFER, bệnh nhân hẹp mạch vành mức độ vừa có FFR ≥0,75 được chia ngẫu nhiên vào hai nhóm can thiệp tái tưới máu hoặc điều trị nội khoa. Tỉ lệ biến cố tim mạch sau 2 năm là như nhau ở hai nhóm. Sau 5 năm, tỉ lệ tử vong và nhồi máu cơ tim ở nhóm điều trị nội khoa thấp hơn 50% so với nhóm được đặt stent. Mặc dù nghiên cứu DEFER sử dụng stent thường chứ không phải stent phủ thuốc, một phân tích meta tiến hành năm 2006 cho thấy tỉ lệ tử vong và NMCT sau 1 năm của bệnh nhân hẹp vừa ĐMV được đặt stent phủ thuốc tương đương tỉ lệ biến cố sau 5 năm của nhóm điều trị nội khoa trong nghiên cứu DEFER.
Trong một nghiên cứu tiến cứu tiến hành trong 4 năm, với 407 bệnh nhân hẹp vừa ĐMV (hẹp 40-60% theo QCA) được đo FFR, quyết định can thiệp mạch vành hay trì hoãn dựa trên FFR< 0,8 hay FFR ≥ 0,8. Sau 1 năm theo dõi, tỉ lệ biến cố tim mạch ở nhóm sử dụng FFR là 6%, thấp hơn hẳn nhóm không dùng FFR (15%, p=0,01).
Kết quả từ những nghiên cứu trên đã chứng minh vai trò của FFR trong đánh giá tổn thương hẹp vừa ĐMV.
5.2. FFR và tổn thương nhiều thân động mạch vành
Với bệnh nhân hẹp nhiều thân ĐMV, việc xác định động mạch thủ phạm liên quan đến triệu chứng thiếu máu cơ tim đôi khi không đơn giản. Vai trò của các thăm dò không xâm nhập rất hạn chế. Gần đây, nghiên cứu FAME đăng trên tạp chí New England Journal of Medicine đánh giá trực tiếp vai trò của FFR trong việc đưa ra quyết định can thiệp ở bệnh nhân tổn thương nhiều thân mạch vành. Đây là một nghiên cứu ngẫu nhiên, đa trung tâm, gồm 1005 bệnh nhân có hẹp trên 50% ít nhất hai ĐMV, không có hội chứng vành cấp, không hẹp thân chung, không có phẫu thuật cầu nối chủ vành trước đó. Bệnh nhân được chọn ngẫu nhiên vào hai nhóm: nhóm can thiệp (đặt stent phủ thuốc) hoặc điều trị bảo tồn dựa theo phim chụp mạch, nhóm còn lại can thiệp nếu FFR < 0,8 và điều trị nội khoa nếu FFR ≥ 0,8.
Nghiên cứu FAME đã chứng minh, FFR giảm được 30% số ca đặt stent không cần thiết, cùng với đó là giảm chi phí điều trị, giảm lượng thuốc cản quang sử dụng, trong khi thời gian làm thủ thuật không thay đổi. Sau một năm, tỉ lệ biến cố tim mạch (tử vong, NMCT, cần tái thông mạch đích) ở nhóm FFR thấp hơn nhóm dựa trên phim chụp mạch (13,2% so với 18,4%, p=0,02). Kết quả theo dõi sau hai năm cho thấy tỉ lệ tử vong và NMCT ở nhóm sử dụng FFR chỉ là 8,4%, thấp hơn có ý nghĩa thống kê so với nhóm không dùng FFR (12,7%, p=0,03).
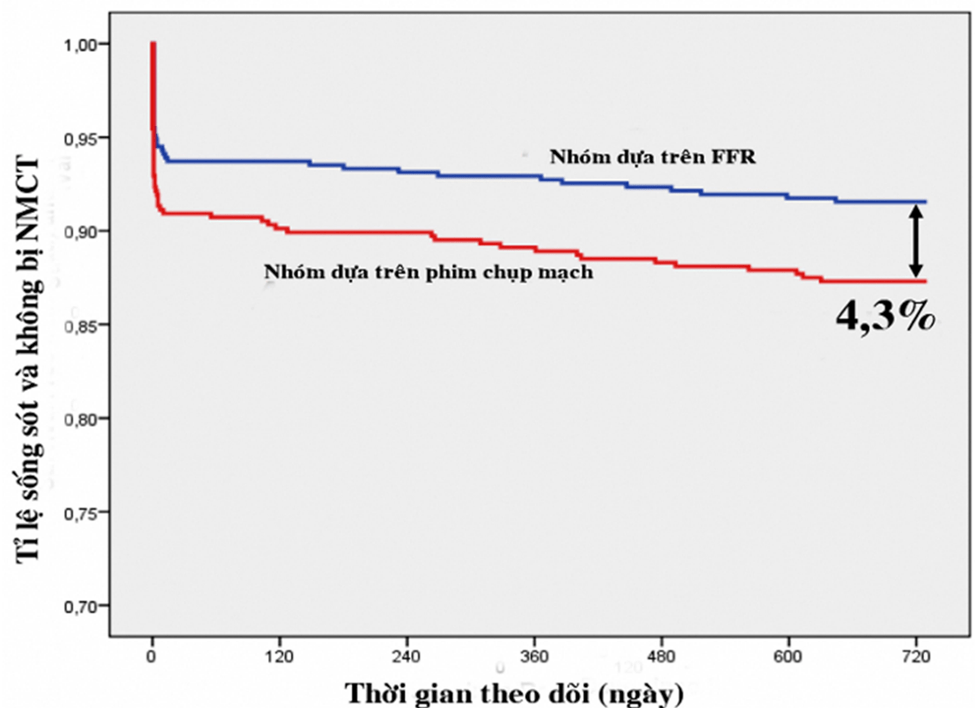 Hình 4. Kết quả 2 năm nghiên cứu FAME
Hình 4. Kết quả 2 năm nghiên cứu FAMEChú thích: NMCT: nhồi máu cơ tim
Với quy mô nhỏ hơn, Wongprapaut và cộng sự so sánh kết quả can thiệp dựa theo phim chụp mạch và dựa theo FFR ở 137 bệnh nhân tổn thương nhiều thân mạch vành (tổng cộng 312 động mạch bị hẹp). Nghiên cứu cho thấy chi phí trung bình ở nhóm sử dụng FFR thấp hơn hẳn nhóm không dùng FFR (2572 ± 934 USD, so với 3167 ± 1194 USD, p <0,001), tỉ lệ biến cố tim mạch lớn (MACEs) sau 30 tháng theo dõi cũng thấp hơn (11% so với 41%, p <0,01).
5.3. FFR và tổn thương lan tỏa động mạch vành
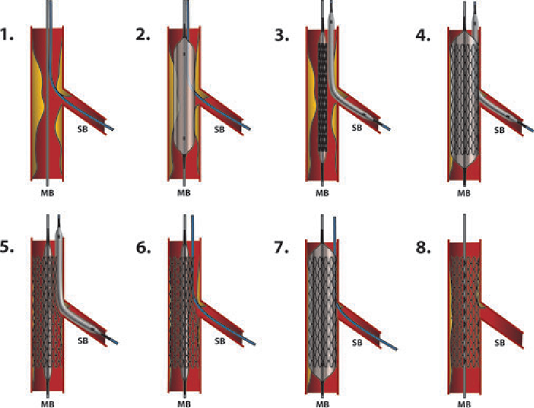
Siêu âm trong lòng mạch (IVUS) cho thấy phần lớn các trường hợp xơ vữa ĐMV là tổn thương lan tỏa, rất hiếm ĐMV chỉ hẹp một chỗ duy nhất. Trong trường hợp hẹp nhiều đoạn ĐMV, câu hỏi đặt ra là có nên can thiệp tất cả các tổn thương hay không. Bỏ sót tổn thương thì tình trạng tưới máu cơ tim ít được cải thiện, trong khi đặt quá nhiều stent đồng nghĩa với tăng nguy cơ (tái hẹp trong stent, tắc lại stent) và chi phí cho người bệnh. Đo chênh áp qua từng chỗ hẹp bằng kỹ thuật kéo ngược đầu dò áp lực, phối hợp với IVUS, sẽ giúp thầy thuốc xác định chính xác mức độ hẹp mạch máu và tối ưu hóa vị trí đặt stent.
5.4. FFR và tổn thương thân chung động mạch vành trái
Hẹp thân chung ĐMV trái có liên quan với các biến cố tim mạch nghiêm trọng. Tuy nhiên, các tổn thương thân chung lại thuộc nhóm khó đánh giá nhất trên phim chụp mạch, trong khi thăm dò không xâm nhập gần như không có giá trị. Một số nghiên cứu chứng minh FFR có thể được ứng dụng một cách an toàn trong đánh giá hẹp thân chung ĐMV trái. FFR > 0,75 cho phép trì hoãn can thiệp tái tưới máu thân chung (đặt stent hoặc phẫu thuật làm cầu nối) với tỉ lệ biến cố tim mạch không cao hơn nhóm can thiệp dựa đơn thuần theo phim chụp mạch. Mặc dù vậy, tổn thương thân chung ĐMV trái ít khi xuất hiện riêng rẽ mà thường đi kèm hẹp đoạn gần động mạch liên thất trước hoặc động mạch mũ. Trong những trường hợp đó, FFR có thể bị ảnh hưởng và khiến bác sĩ dễ đánh giá mức độ hẹp thân chung nặng hơn thực tế.
5.5. FFR và tổn thương tại chỗ phân nhánh
Các tổn thương tại chỗ chia đôi thường hay gặp hiện tượng chồng hình (overlapping) khiến việc đánh giá trên phim chụp mạch không đơn giản, trong khi can thiệp tại chỗ chia đôi lại khó khăn hơn can thiệp một vị trí hẹp đơn thuần. Koo BK và cộng sự đã tiến hành một loạt nghiên
cứu tìm hiểu vai trò của FFR trong tổn thương tại chỗ chia đôi, chứng minh vai trò của FFR khi so sánh với QCA (chụp mạch vành định lượng) trong đánh giá mức độ nặng thực sự của chỗ hẹp, mọi trường hợp hẹp lỗ vào dưới 75% (đo bằng QCA) đều có FFR ≥ 0,75. Ngoài ra, dựa trên FFR có thể đưa ra quyết định có tiếp tục can thiệp nhánh bên sau can thiệp nhánh chính hay không.
5.6. FFR trong đánh giá hiệu quả can thiệp ngay sau đặt stent
FFR đã được chứng minh có vai trò đánh giá hiệu quả đặt stent. FFR cho bác sĩ can thiệp biết chính xác những vị trí stent chưa giãn nở tối ưu. Nghiên cứu gần đây của Klauss cho thấy FFR sau can thiệp lớn hơn 0,95 là một yếu tố tiên lượng độc lập của các biến cố tim mạch (tử vong, nhồi máu cơ tim, cần tái can thiệp mạch vành). Trong 6 tháng theo dõi, nhóm FFR ≤ 0,95 có tỉ lệ biến cố cao gấp 6 lần nhóm FFR > 0,95. Pijls NH khi nghiên cứu 750 trường hợp đặt stent có kết quả tốt dựa trên phim chụp mạch cũng nhận thấy, FFR (sau can thiệp) trên 0,95 tương ứng tỉ lệ biến cố tim mạch lớn chỉ có 4,9%; FFR từ 0,90-0,95 có tỉ lệ biến cố 6,2%; FFR từ 0,80 – 0,90 có tỉ lệ biến cố 20,3%. Nếu sau đặt stent, FFR vẫn nhỏ hơn 0,8, tỉ lệ biến cố tim mạch nặng lên tới 29,5% (p <0,001).
5.7. FFR trong đánh giá cầu nối chủ vành
Aqel và cộng sự so sánh FFR với thăm dò tưới máu cơ tim ở bệnh nhân sau mổ cầu nối chủ vành có triệu chứng đau ngực đã nhận thấy, độ nhạy và độ đặc hiệu của FFR lần lượt là 50% và 75%. Đây là mức có thể chấp nhận được. Vì thế, nhiều nghiên cứu đã sử dụng FFR để đánh giá tình trạng cầu nối chủ vành, như nghiên cứu của Glineur và cộng sự so sánh đặc điểm của cầu nối dùng động mạch ngực trong và cầu nối tĩnh mạch hiển lớn.
5.8. FFR và tái hẹp trong stent
Năm 2005, Kruger và cộng sự nghiên cứu tác dụng của FFR khi đánh giá tái hẹp trong stent sau can thiệp mạch vành. Kết quả cho thấy FFR < 0,75 có tương quan với mức độ hẹp trên phim chụp mạch. Những bệnh nhân FFR ≥ 0,75 không xuất hiện triệu chứng của bệnh mạch vành trong 6 tháng theo dõi. Một nghiên cứu khác của Ramon Lopez chứng minh có thể trì hoãn can thiệp mạch vành ở bệnh nhân tái hẹp trong stent có FFR ≥ 0,75.
Tài liệu tham khảo
- Bon N, Lancee, Van Egmond FC (1972): An ultrasonic intracardiac Ultrasonic 1972;10:72-76
- Bon N, Ten Hoff, Lancee CT (1989): Early and recent intraluminal ultrasound devices. Int J Card Imaging 1989; 4:79-88
- York PG, Linker D, Saether O (1988) Intravascular two dimensional catheter ultrasound: Initial clinical stusies. Circulation 1988; 78:II-21
- Eric Topol, Paul Textbook of Interventional Cardiology. 8th ed: Elsevier; 2019.
- Guédès A, Keller PF, L’Allier PL, Lespérance J, Grégoire J, Tardif Long-term safety of intravascular ultrasound in nontransplant, nonintervened, atherosclerotic coronary arteries. J Am Coll Cardiol. 2005;45(4):559-564.
- Ramasubbu K, Schoenhagen P, Balghith MA, et Repeated intravascular ultrasound imaging in cardiac transplant recipients does not accelerate transplant coronary artery disease. J Am Coll Cardiol. 2003;41(10):1739-1743.
- MD Paul Schoenhagen, FAHA and Steven Nissen, MD, FACC (2004), “An Atlas and Manual of coronary intravascular ultrasound imaging”.
- Hand Kushner. G, Smith. C, et al (2009), “2009 focused updates: ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction (updating the 2004 guideline and 2007 focused update) and ACC/AHA/SCAI guidelines on percutaneous coronary intervention “, J Am Coll Cardiol, 54, tr. 2205-41.
- Kolh S. Windecker, F. Alfonso, J.P. Collet, J. Cremer, V. Falk, G. Filippatos, C. Hamm et al, (2014), “The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)”, Eur. Heart J, 35, tr. 2541–2619.
- 3983/QĐ-BYT (2014), “Bộ Y Tế – Hướng dẫn quy trình kỹ thuật Nội khoa, chuyên ngành Tim mạch”.
- Nissen SE, Yock Intravascular Ultrasound: Novel Pathophysiological Insights and Current Clinical Applications. Circulation. 2001;103(4):604-616. doi:10.1161/01.CIR.103.4.604.
- Kawasaki M, Sano K, Okubo M, et al. Volumetric quantitative analysis of tissue characteristics of coronary plaques after statin therapy using three-dimensional integrated backscatter intravascular ultrasound. J Am Coll Cardiol. 2005;45(12):1946-1953.
- Serruys PW, García-García HM, Buszman P, et al. Effects of the direct lipoprotein-associated phospholipase A(2) inhibitor darapladib on human coronary atherosclerotic plaque. Circulation. 2008;118(11):1172-1182.
- Kini AS, Baber U, Kovacic JC, et al. Changes in plaque lipid content after short-term intensive versus standard statin therapy: the YELLOW trial (reduction in yellow plaque by aggressive lipid-lowering therapy). J Am Coll 2013;62(1): 21-29.
- Yamada R, Tremmel JA, Tanaka S, et al. Functional Versus Anatomic Assessment of Myocardial Bridging by Intravascular Ultrasound: Impact of Arterial Compression on Proximal Atherosclerotic Plaque. J Am Heart Assoc. 2016;5(4):e001735.
- Nakamura S, Colombo A, Gaglione A, et al. Intracoronary ultrasound observations during stent implantation. Circulation. 1994;89(5):2026-2034.
- Colombo A, Hall P, Nakamura S, et al. Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance. Circulation. 1995;91(6):1676-1688.
- Lassen JF, Holm NR, Banning A, et Percutaneous coronary intervention for coronary bifurcation disease: 11th consensus document from the European Bifurcation Club. EuroIntervention. 2016;12(1):38-46.
- Rathore S, Terashima M, Suzuki Value of intravascular ultrasound in the management of coronary chronic total occlusions. Catheter Cardiovasc Interv. 2009;74(6):873-878.
- Kim BK, Shin DH, Hong MK, et Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention With Zotarolimus-Eluting Versus Biolimus-Eluting Stent Implantation: Randomized Study. Circ Cardiovasc Interv. 2015;8(7):e002592.
- Garcìa-Garcìa HM, Gogas BD, Serruys PW, Bruining IVUS-based imaging modalities for tissue characterization: similarities and differences. Int J Cardiovasc Imaging. 2011;27(2):215-224. doi:10.1007/s10554-010-9789-7.
- Matsumura M, Mintz GS, Kang SJ, et al. Intravascular ultrasound and near-infrared spectroscopic features of coronary lesions with intraplaque haemorrhage. Eur Heart J – Cardiovasc Imaging. 2017;18(11):1222-1228. doi:10.1093/ehjci/jew217.
- Kini AS, Baber U, Kovacic JC, et al. Changes in Plaque Lipid Content After Short-Term Intensive Versus Standard Statin Therapy. J Am Coll Cardiol. 2013;62(1):21-29. doi:10.1016/j.jacc.2013.03.058.
- Park SJ, Ahn JM, Kang SJ, et al. Intravascular Ultrasound-Derived Minimal Lumen Area Criteria for Functionally Significant Left Main Coronary Artery Stenosis. JACC Cardiovasc Interv. 2014;7(8):868-874. doi:10.1016/j.jcin.2014.02.015.
- Hong MK, Mintz GS, Lee CW, et Comparison of Virtual Histology to Intravascular Ultrasound of Culprit Coronary Lesions in Acute Coronary Syndrome and Target Coronary Lesions in Stable Angina Pectoris. Am J Cardiol. 2007;100(6): 953-959. doi:10.1016/j.amjcard.2007.04.03
- Matsumura M, Mintz GS, Kang SJ, et Intravascular ultrasound and near-infrared spectroscopic features of coronary lesions with intraplaque haemorrhage. Eur Heart J – Cardiovasc Imaging. 2017;18(11):1222-1228. doi:10.1093/ehjci/jew217.
- Xie Y, Mintz GS, Yang J, et al. Clinical Outcome of Nonculprit Plaque Ruptures in Patients With Acute Coronary Syndrome in the PROS- PECT Study. JACC Cardiovasc Imaging. 2014;7(4):397-405. doi:10.1016/j.jcmg.2013.10.010.
- Roleder T, Wojakowski Intravascular ultrasound, optical coherence tomography and near infrared spectroscopy. Cor Vasa. 2015;57(6):e439-e445. doi:10.1016/j.crvasa.2015.10.004.
- Yonetsu T, Suh W, Abtahian F, et al. Comparison of near-infrared spectroscopy and optical coherence tomography for detection of lipid: Comparison Between NIRS and OCT. Catheter Cardiovasc Interv. 2014;84(5):710-717. doi:10.1002/ccd.25084.
- Sathyanarayana S, Carlier S, Li W, Thomas Characterisation of atherosclerotic plaque by spectral similarity of radiofrequency intravascular ultrasound signals. EuroIntervention 5:133–139. EuroIntervention. 2009;(5):133-139.
- Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87-165. doi:10.1093/eurheartj/ehy394.
- Patel MR, Dehmer GJ, Hirshfeld JW, Smith PK, Spertus ACCF/SCAI/STS/AATS/AHA/ASNC/HFSA/SCCT 2012 Appropriate Use Criteria for Coronary Revascularization Focused Update. J Am Coll Cardiol. 2012;59(9):857-881. doi:10.1016/j. jacc.2011.12.001.