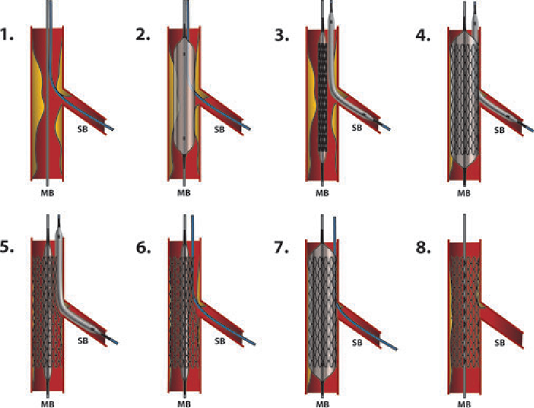
Can thiệp tổn thương chia nhánh
1. MỞ ĐẦU
Định nghĩa tổn thương chỗ chia nhánh được đưa ra bởi European Bifurcation Club (EBC) là “hẹp động mạch vành ngay sát và/hoặc kèm chỗ xuất phát của nhánh bên chính, với nhánh bên chính được định nghĩa là bất kỳ nhánh bên nào mà “bạn không muốn mất” trong bối cảnh lâm sàng chung của bệnh nhân (triệu chứng, vị trí thiếu máu, nhánh chịu trách nhiệm cho triệu chứng thiếu máu, khả năng tồn tại, tuần hoàn bàng hệ, LVEF).
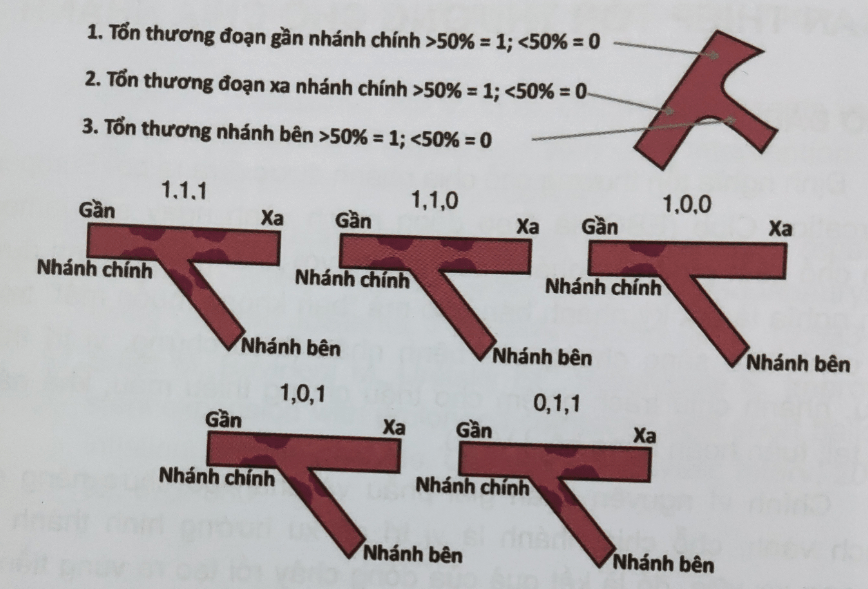
Chính vì nguyên nhân giải phẫu và phân bố chức năng của mạch vành, chỗ chia nhánh là vị trí có xu hướng hình thành tổn thương xơ vữa, đó là kết quả của dòng chảy rối tạo ra vùng tiền xơ vữa có áp lực thấp. Do nguyên nhân này, tổn thương chỗ chia nhánh chiếm khoảng 30% tổn thương ở bệnh nhân tồn thương đa nhánh động mạch. Điều trị tổn thương chỗ chia nhánh còn nhiều tranh cãi, từ chỉ định, chiến thuật can thiệp đến các kỹ thuật được sử dụng.Hiện tại, có nhiều phân loại tổn thương chỗ chia nhánh, trong đó, phân loại theo Medina là đơn giản và thông dụng nhất, với giá trị 1 là hẹp có ý nghĩa (> 50% đường kính) và giá trị 0 là không hẹp/hẹp không có ý nghĩa. Hai giá trị 0 và 1 được áp dụng cho 3 đoạn riêng biệt lần lượt là đoạn gần nhánh chính, đoạn xa nhánh chính và nhánh bên, giữa các chữ số được ngăn cách bởi dấu chấm.
Thách thức của tổn thương chỗ chia nhánh đã được đặt ra ngay trong thời gian đầu của can thiệp mạch vành với nong bỏng đơn thuần. Nhiều kỹ thuật đã được phát triển để cải thiện tỷ lệ thành công của thủ thuật và tiên lượng dài hạn. Sau 20 năm, từ khi stent phủ thuốc được phát minh, tổn thương chỗ chia nhánh đã và đang là chủ đề của nhiều cuộc thảo luận và tranh cãi, được bổ sung thêm các định nghĩa, phân loại mới, các phương pháp đo lường và hình ảnh, cũng như các thử nghiệm lâm sàng ngẫu nhiên, nghiên cứu sổ bộ và phân tích tổng hợp. Những phát hiện mới gần đây từ các thử nghiệm đặt son trong môi trường mô phỏng đã ảnh hưởng trực tiếp lên chiến lược điều trị.

Hình 8.1: Phân loại Medina (2)
Phân loại MADS (Main – Acrosg – Distal – Side) trong đặt stont chỗ chia nhánh được đưa ra bởi EBC dựa chủ yếu trên hai nguyên lý. Vị trí cuối cùng của stent trong chỗ chia nhánh và trình tự đặt stent. Hạn chế của phân loại MADS là không tích hợp các thông tin về bóng và các thủ thuật điều khiển dây dẫn, chẳng hạn như bảo vệ nhánh bên bằng dây dẫn hoặc bóng. Nhưng dù chiến lược can thiệp ban đầu là gì, thì việc sử dụng một hay hai stont nên được lên kế hoạch càng sớm càng tốt
Để hiểu được cơ sở của các chiến lược đặt stont chỗ chia nhánh khác nhau, chúng ta cần hiểu được các đặc điểm giải phẫu của chỗ chia nhánh và các quy luật của các hộ chia nhánh trong tự nhiên. Sự chia nhánh của động mạch vành tuân theo quy luật tự nhiên về tiêu thụ năng lượng tối thiếu để cung cấp cho cơ tìm với lượng máu tối ưu cần thiết. Kết quả là, ba phân đoạn trong chỗ chia nhánh có kiểu hình với đường kính riêng biệt có liên quan với nhau được xác định bởi định luật Murray cách đây hơn 90 năm (D3mẹ = D3con1 + D3con2) và gần đây đã được Finet đơn giản hóa (D = 0,67x [D1+D2]). Đoạn gần nhánh chính “mẹ” do đó luôn có đường kính lớn hơn so với đoạn xa và bằng khoảng 2/3 tổng đường kinh của hai nhánh “con”. Quy luật này cần được ghi nhớ đề chọn kích thước stent và bóng tối ưu đề có được sự áp thành của khung stent thích hợp. Ảnh hưởng của bệnh lý xơ vữa lên chỗ chia nhánh là khác nhau và không thể đoán trước được, nên có thể cần sử dụng các công cụ đánh giá hình ảnh như IVUS, OCT.
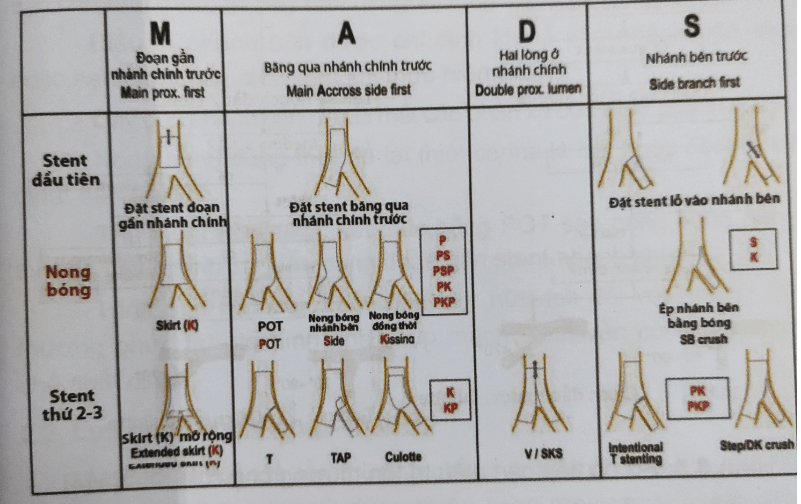
Hình 8.2: Phân loại MADS [1]
2. TIẾP CẬN ĐIỀU TRỊ TÔN THƯƠNG CHỖ CHIA NHÁNH
Tổn thương chỗ chia nhánh không chỉ là tổn thương về mặt giải phẫu (gánh nặng xơ vữa, vị trí mảng xơ vữa, góc giữa các nhánh, đường kính, vị trí giải phẫu) mà còn là thay đổi về huyết động khi điều trị (dịch chuyển mảng xơ vữa, carina, bóc tách).
Các nghiên cứu đến nay đã cho thấy xơ vữa có xu hướng xuất hiện ở vùng có lực xé thấp. Sự xuất hiện mảng xơ vữa tại vùng carina (nơi dòng chảy chia đôi) là tương đối hiếm gặp. Không có 2 tổn thương chỗ chia nhánh nào là giống nhau và cũng không có một kỹ thuật đặt stent nào là có thể áp dụng đối với tất cả chổ chia nhánh. Do vậy, điều quan trọng nhất trong can thiệp chỗ chia nhánh là lựa chọn chiến thuật thích hợp cho mỗi tổn thương và tối hưu hóa hiệu suất của kỹ thuật đó.
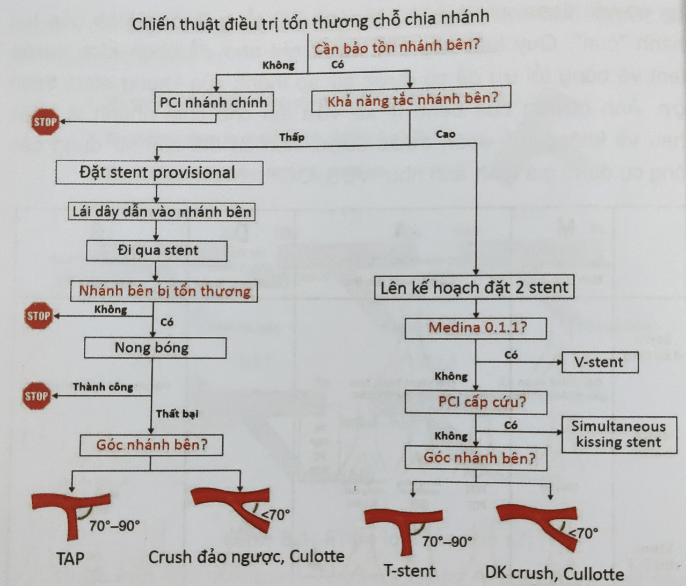
Hình 8.3: Sơ đồ tiếp cận điều trị tổn thương chỗ chia nhánh [4]
O 2.1. Tiếp cận của EBC trong đặt stent chỗ chia nhánh
– Phân loại MEDINA được dùng cho tổn thương chỗ chia nhánh (1,0) và phân loại MADS cho kỹ thuật đặt stent chỗ chia nhánh (MADS: Main, Across, Distal, Side – dựa trên vị trí đặt stent đầu tiên). – Kỹ thuật provisional stent vẫn là kỹ thuật tiêu chuẩn vàng cho hầu hết tổn thương chỗ chia nhánh. – Nhánh bên lớn với tổn thương từ lỗ vào > 5 mm kéo dài từ carina thường cần chiến thuật với 2 stent.
– Trong kỹ thuật provisional, sau khi lái dây dẫn vào cả 2 nhánh, nhánh chính nên được nong bóng chuẩn bị nếu cần thiết, trong khi nhánh bên có thể không cần nong bóng nếu nhánh bên không bị vôi hóa nhiều hoặc tổn thương ngắn.
– Dây dẫn nhánh bên nên được lưu lại khi đặt stent nhánh chính ở tổn thương chỗ chia nhánh thực sự.
– Stent nhánh chính được lựa chọn dựa trên đường kính đoạn xa nhánh chính và nong bóng sau đặt stent, nong bóng đồng thời là cần thiết để tối ưu hóa đường kính đoạn đầu.
– Kỹ thuật POT được thực hiện sau đặt stent nhánh chính bằng cách nong bóng ngắn ở đoạn gần carina. POT nên được thực hiện trước khi lái dây dẫn ra và vào lại nhánh bên để dễ dàng tiếp cận và hạn chế tình trạng lái dây dẫn đi ngoài lòng stent.
– Điều trị nhánh bên được chỉ định khi lỗ vào nhánh bên hẹp hoặc hạn chế dòng chảy sau khi thực hiện POT.
– Dây dẫn nhánh bên đi qua mắt cáo phần xa của stent nhánh chính. – Nong bóng đồng thời để tái thiết carina là bắt buộc đối với kỹ thuật đặt 2 stent.
– Thủ thuật nên được kết thúc bằng POT sau nong bóng đồng thời để điều chỉnh sự biến dạng đoạn gần stent nhánh chính
– Hình ảnh học nội mạch đặc biệt hữu ích đối với những tổn thương phức tạp do hình ảnh chụp mạch vành vẫn có những hạn chế nhất định.
2.2. Lựa chọn ống thông can thiệp
Một số lượng lớn tổn thương chỗ chia nhánh có thể được tiến hành với ống thông 6F sử dụng chiến lược provisional trong phần lớn các trường hợp. Ngoại trừ trường hợp do tổn thương giải phẫu thủ thuật viên đã quyết định ngay từ đầu là đặt 2 stent (sử dụng ống thông 7F hoặc 8F). Khi không chắc chắn về phương pháp điều trị tối ưu và thủ thuật viên chỉ có thể quyết định sau khi đã nong bóng chuẩn bị, thì nên sử dụng ống ông 7F hoặc 8F.
Các bóng hiện tại với đường kinh ban đầu nhỏ, cho phép đưa cùng một lúc 2 bóng trong ống thông 6F có lòng rộng. Nếu cần 2 stent và đang sử dụng ống thông 6 F, có một số hạn chế mà thủ thuật viên cần phải biết, đó là 2 stent chỉ có thể được đặt lần lượt theo thứ tự, kỹ thuật Crush cổ điển và V-stent hay 2 stent đồng thời không thể thực hiện được mà cần có ống thông 7 hoặc 8F.
2.3. Sơ lược một số vấn đề khi điều trị tổn thương chỗ chia nhánh
Phương pháp thường được áp dụng nhất là đặt stent provisional, được mô tả sơ lược như sau:
– Đưa 2 dây dẫn tới nhánh chính và nhánh bên.
– Nong bóng nhánh chính hoặc cả nhánh chính và nhánh bên khi cần thiết.
– Đặt stent nhánh chính.
– Tối ưu hóa stent với kỹ thuật tối ưu hóa đoạn gần (proximal optimization technique – POT).
– Lái dây dẫn ra và vào lại vào nhánh bên.
– Đưa bóng đi vào nhánh bên.
– Tiến hành nong bóng đồng thời với áp lực khoảng 8 atm ở nhánh bên, cho đến khi bóng nở hoàn toàn.
– Thực hiện POT nếu nhánh bên vẫn chưa nở đủ sau khi nong bóng đồng thời. – Đặt stent thứ hai ở nhánh bên khi kết quả vẫn không tốt (hẹp tồn lưu > 75%, bóc tách, dòng TIMI < 3 ở nhánh bên ≥ 2,5 mm hoặc FFR < 0,80, iFR < 0,89). Khía cạnh quan trọng nhất khi đặt stent chỗ chia nhánh là bảo vệ nhánh bên bằng dây dẫn cho đến khi đặt stent nhánh chính hoàn thành, bao gồm đặt stent áp lực cao hoặc nong bóng áp lực cao. Khi rút dây dẫn bị mắc kẹt, chú ý để tránh tổn thương lỗ vào do đầu ống thông.
Trong kỹ thuật provisional, nên lái dây dẫn đi qua mắt cáo ở phần xa (mắt cáo gần carina) sau khi đã đặt stent nhánh chính do tạo được khung nhánh bên tốt hơn so với đi qua mắt cáo phần gần.
Để tối ưu hóa việc tiếp cận nhánh bên qua mắt cáo ở carina, nên sử dụng kỹ thuật POT. Tối ưu hoả việc đặt stent đoạn gần của carina bằng cách sử dụng bóng ngắn đường kính lớn để lái dây dẫn vào mắt cáo phần xa dễ dàng hơn khi đổi dây dẫn. Nếu kết quả vẫn không tốt sau đặt stent nhánh chính, đặt stent nhánh bên có thể được tiến hành bằng kỹ thuật T-stent, TAP-stent, kỹ thuật Reversel Internal Crush hoặc Culotte với nong bóng đồng thời lần cuối. Do sự không đồng nhất về nguồn lực và kinh nghiệm của thủ thuật viên tại mỗi bệnh viện, những phương án trên cần được cân nhắc kết hợp với khuyến cáo chung trong điều trị tổn thương chỗ chia nhánh.

Hình 8.4 Vai trò của POT khi tiếp cận nhánh bên qua kung stent nhánh chính
2.4. Khó lái dây dẫn vào nhánh bên
Mặc dù đã sử dụng nhiều loại dây dẫn với các độ cong ở đầu dây dẫn khác nhau và cũng đã nhiều kỹ thuật khác nhau, đôi khi thủ thuật viên vẫn không thể đưa dây dẫn vào nhánh bên. Ở điểm này, có một số phương án có thể lựa chọn như: (1) Từ bỏ thủ thuật do nguy cơ làm tắc nhánh bên quá cao, do kích thước và vị trí của nhảnh bên (VD nhánh LCx có góc nhỏ); (2) Sử dụng vi ống thông để điều chỉnh hưởng dây dẫn trong trường hợp giải phẫu nhánh chính không thuận lợi hoặc sử dụng ống thông SuperCross (Vascular Solutions, Minneapolis, MN) với các độ cong định hình sẵn ở đầu ống thông khác nhau; (3) Tiến hành khoan cắt mảng xơ vữa (để loại bỏ mảng xơ vữa che lấp lỗ vào nhánh bên) ở nhánh chính; (4) Nong nhánh chính với hy vọng sự dịch chuyển mảng xơ vữa tạo thuận lợi để tiếp cận nhánh bên; (5) Sử dụng kỹ thuật “dây dẫn quặt ngược (reverse wire)”, tạo một đầu dây dẫn đặc biệt với với hai đầu cong (đầu cong đoạn gần dài hơn để tạo loop ở đoạn xa nhánh chính và một đầu cong đoạn xa ngắn để đi vào nhánh bên trong quá trình kéo ngược dây dẫn trở lại); hoặc (6) Sử dụng ống thông Venture (Vascular Solutions), một ống thông có đường kính nhỏ với đầu có thể uốn cong đến 90 độ để định hướng dây dẫn và cung cấp lực hỗ trợ tuyệt vời để lái dây dẫn. Đôi khi sử dụng dây dẫn tương đối cứng cũng có thể là một giải pháp, do tính năng dễ điều khiển và lực đâm xuyên tốt hơn. Sử dụng các dây ưa nước cũng có thể được cân nhắc; tuy nhiên, nguy cơ đi vào lớp dưới nội mạc sẽ tăng khi sử dụng dây cứng và/hoặc ưa nước. Mỗi phương pháp đều có những ưu nhược điểm của riêng nó, cần căn cứ vào cấu trúc giải phẫu, kinh nghiệm của thủ thuật viên và bối cảnh lâm sàng để lựa chọn chiến thuật cho hợp lý nhất.

Hình 8.5: Sử dụng vi ống thông SuperCross để hỗ trợ lái dây dẫn vào nhánh bên [1]
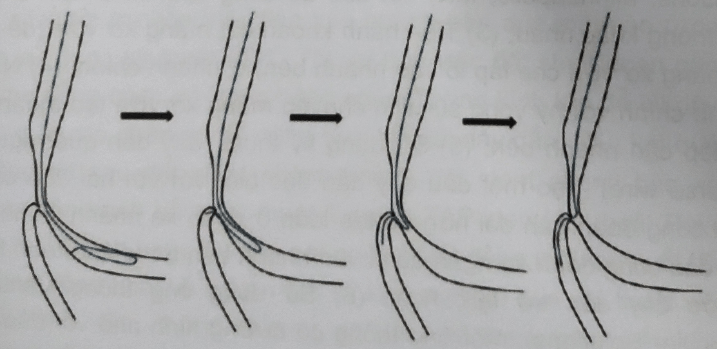
Hình 8.6: Kỹ thuật dây dẫn quặt ngược (reverse wire) [1]
2.5. Vai trò của nong bóng đồng thời lần cuối (Final Kissing Balloon Inflation – FKBI)
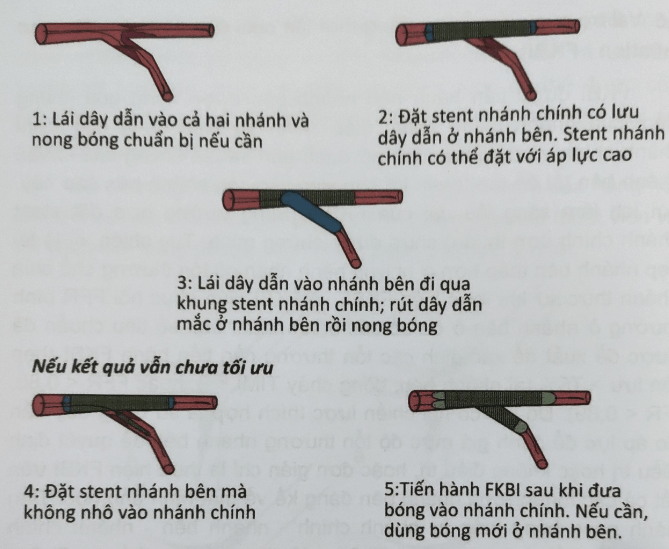
FKBI được tiến hành nếu nhánh bên được nong qua khung stent của nhánh chính nhằm điều chỉnh sự biến dạng của stent nhánh chính và đảm bảo dân nở đoạn gần và tạo khung của lỗ vào nhành bên tốt để tạo thuận lợi cho việc tiếp cận nhánh bên sau này. Lợi ích lâm sàng lâu dài của FKBIs (trong trường hợp đặt stent nhánh chính đơn thuần) chưa được chứng minh. Tuy nhiên, tỷ lệ tái hẹp nhánh bên thấp hơn ở những bệnh nhân có tồn thương chỗ chia nhánh thực sự khi thực hiện FKBI, và FKBI giúp phục hồi FFR binh thường ở nhánh bên ở đa số các bệnh nhân. Một số tiêu chuẩn đã được đề xuất để xác định các tổn thương cần tiến hành FKBI (hẹp tồn lưu > 75% tại nhánh bên, dòng chảy TIMI < 3, hoặc FFR < 0,80, iFR < 0,89). Do đó, cả hai chiến lược thích hợp là sử dụng dây dẫn đo áp lực để đánh giá mức độ tổn thương nhánh bên để quyết định điều trị hoặc không điều trị, hoặc đơn giản chỉ là thực hiện FKBI trên tất cả các tổn thương nhánh bên đáng kể về mặt hình ảnh học. Tiến hành nong bóng tuần tự nhánh chính – nhánh bên – nhánh chính được đề xuất như một giải pháp đơn giản hơn để thay thế cho FKBI.
2.6. Stent thứ hai ở nhánh bên sau đặt stent provisional
Khi không vừa lòng với kết quả sau nong bóng nhánh bên, chúng ta có thể đặt stent thứ 2 sử dụng một trong các kỹ thuật sau: T-stent, TAP-stent, Culotte, Reverse/Internal Crush. FFR, iFR và các kỹ thuật hình ảnh có thể được sử dụng để đánh giá kết quả sau nong bóng.
2.6.1. Kỹ thuật T-stent
Kỹ thuật này thường được sử dụng nhất khi chuyển từ đặt stent provisional sang đặt stent nhánh bên. Kỹ thuật T-stent cốt yếu ở chỗ đưa stent thứ hai vào nhánh bên (sau khi nong mắt cáo stent nhánh chính). Stent được đặt tại lỗ vào của nhánh bên, cố gắng để hạn chế tối thiểu khoảng trống không phủ stent, sau đó tiến hành FKBI. Thủ thuật này có nguy cơ để lại khoảng trống giữa stent nhánh chính và stent nhánh bên, khoảng trống này không được phân bố đều thuốc nên có nguy cơ tái hẹp lỗ vào nhánh bên.
Hình 8.7: Kỹ thuật T-stent [2]
2.6.2. Kỹ thuật TAP-stent
Đây là phương pháp cải tiến của T-stent với stent nhánh bên nhô một chút vào lòng nhánh chính.
Kỹ thuật này được mô tả như sau:
- Stent thứ 2 được đưa vào nhánh bên với đầu gần nhô khoảng 1-2 mm vào nhánh chính.
- Một bóng được đưa vào nhánh chính.
- Stent nhánh bên được đặt với áp lực 12 atm hoặc hơn đồng thời bóng ở nhánh chính cũng được nong với áp lực 12 atm hoặc hơn.
- Cả hai bóng được xả và rút khỏi mạch vành
2.6.3. Kỹ thuật Reverse/Internal Crush
Kỹ thuật Crush được tiến hành sau khi đặt stent nhánh chính. Mục đích của việc tiến hành kỹ thuật này là để có cơ hội đặt stent provisional nhánh bên. Kỹ thuật Reverse/Internal Crush được phát triển để hạn chế khoảng trống giữa stent nhánh chính và nhánh bên và có thể được tiến hành với ống thông 6-F theo các bước sau
- Sau khi đặt stent nhánh chính, stent thứ hai được đưa vào nhánh bên.
- Một bóng có đường kích tương đương và chiều dài ngắn hơn stent nhánh chính được đưa vào trong stent nhánh chính tại vị trị chỗ chia nhánh.
- Stent nhánh bên được rút lui khoảng 3 mm hoặc ít hơn vào nhánh chính rồi được đặt. Bóng stent nhánh bên sau đó được rút và tiến hành bơm thuốc cản quang để xác định xem có bóc tách hay tổn thương cần đặt thêm stent không. Tiếp theo, dây dẫn nhánh bên được rút và nong bóng nhánh chính với áp lực cao (12 atm hoặc hơn)
- Lái dây dẫn đi qua mắt cáo stent nhánh bên và tiếp đó là bóng (đôi khi cần dùng bóng 1,5 mm). Đường kính bóng tương ứng với đường kính nhánh bên và nong với áp lực cao (12 đến 20 atm).
- Tiến hành FKBI.
Kỹ thuật này thường được thay thế bởi kỹ thuật TAP-stent

Hình 8.8 Kỹ thuật Reverse/Internal Crush
2.6.4. Kỹ thuật Provisional Culotte
Kỹ thuật này được tiến hành trong trường hợp chỗ chia nhánh dạng chữ Y, mặc dù trình tự của kỹ thuật tiêu chuẩn là stent đầu tiên thường được đặt ở nhánh có góc lớn hơn (thường là nhánh bên), kỹ thuật này được mô tả như sau:
- Sau khi đặt stent nhánh chính, stent thứ hai được đưa tới nhánh bên, nhô vào nhánh chính và chồng với đoạn đầu của nhánh chính sau khi đã rút dây dẫn nhánh chính.
- Nhánh chính được lái dây dẫn vào lại qua mắt cáo của stent
- Tiến hành FKBI. nhánh bên và được nong bóng.
2.7. Những vấn kề cần quan tâm khi đặt hai stent
Kỹ thuật đặt 2 stent thường chỉ được tiến hành ở những tổn thương chỗ chia nhánh thực sự. Khi thủ thuật viên xác định cần tiến hành đặt hai stent tại tổn thương chỗ chia nhánh, một ở nhánh chính và một ở nhánh bên thì cần lưu ý đánh giá các thông số sau:
- Kích thước và khu vực phân bố của nhánh bên: Trong một số trường hợp, nhánh bên có vai trò quan trọng tương tự nhánh chính, chẳng hạn chỗ chia nhánh của thân chung thành LAD và LCx hoặc chỗ chia nhánh thành nhánh sau bên và nhánh sau dưới của RCA hay chỗ chia nhánh của LCx thành đoạn xa LCx và nhánh bờ… trong những trường hợp này, kích thước và vị trí phân bố của nhánh bên là yếu tố quan trọng ảnh hưởng đến quyết định đặt hai stent.
- Chiều dài tổn thương tại lỗ vào của nhánh bên: Trong khi hầu hết các tổn thương khu trú tại lỗ vào của nhánh bên chỉ đòi hỏi kỹ thuật đặt stent provisional, tổn thường nhánh bên lan tỏa, kéo dài thường cần đặt stent thứ hai.
- Góc giữa nhánh chính và nhánh bên và mức độ hẹp tại lỗ vào nhánh bên; góc này có thể nhọn, gần vuông góc hoặc tù. Góc giữa hai nhánh càng hẹp, càng có nguy cơ dịch chuyển mảng xơ vữa và đe dọa nhánh bên. Góc này cũng ảnh hưởng đến độ khó của việc lái dây dẫn vào nhánh bên. Mức độ hẹp của lỗ vào nhánh bên cũng ảnh hưởng đến quyết định đặt hai stent. Một yếu tố ảnh hưởng khác nữa là kết quả sau khi nong bóng nhánh bên. Tất cả các yếu tố này có nghĩa là việc đặt stent nhánh bên được quyết định khi đã nong bóng chuẩn bị nong bóng nhánh bên và nhánh chính. Cần lưu ý là khi quyết định sử dụng kỹ thuật một stent ở nhánh chính, luôn có khả năng cần phải đặt thêm stent thứ hai ở nhánh bên nếu kết quả chưa tối ưu.
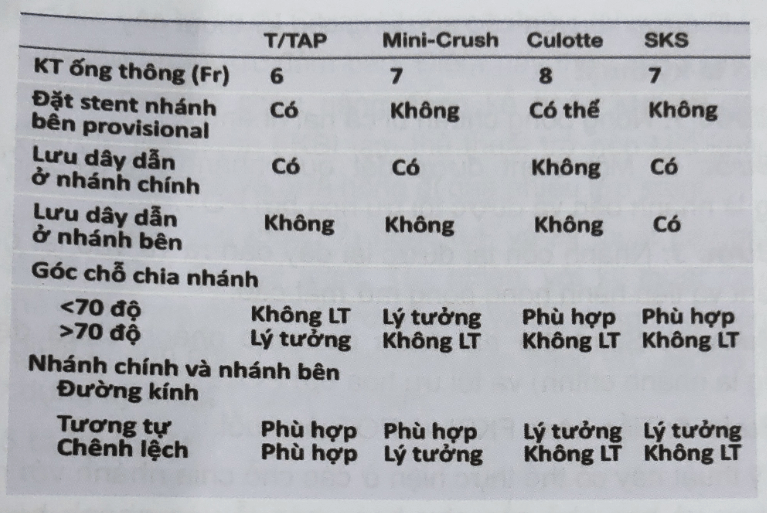
Bảng 8.1: Các đặc điểm của kỹ thuật đặt hai stent (2)
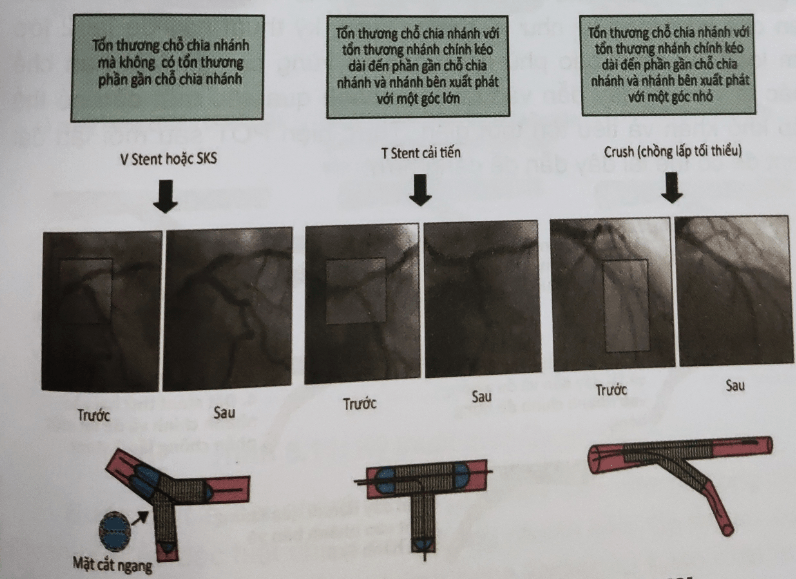
Hình 8.9: Lựa chọn kỹ thuật đặt hai stent [2]
3. KỸ THUẬT ĐẶT HAI STENT
3.1. Kỹ thuật Culotte
Kỹ thuật Culotte sử dụng hai stent bao phủ toàn bộ chỗ chia nhánh với đoạn gần có 2 lớp stent bao phủ. Kỹ thuật Culotte có lẽ là kỹ thuật phủ phần carina tốt nhất so với các kỹ thuật hai stent khác, Điều quan trọng là cần nong mắt cáo ở nhánh bên. Stent có thiết kế “open-cell” được khuyến cáo sử dụng cho kỹ thuật này.
Mô tả kỹ thuật
Bước 1: Nong bóng chuẩn bị cả hai nhánh.
Bước 2: Một stent được đặt qua nhánh có góc lớn hơn, thường là nhánh bên và được tối ưu hóa bởi POT.
Bước 3: Nhánh còn lại được lái dây dẫn ra và vào lại qua mắt cáo stent và tiến hành nong bóng mở mắt cáo.
Bước 4: Stent thứ hai được đưa vào nhánh chưa đặt stent (thường là nhánh chính) và tối ưu hóa bởi POT.
Bước 5: Tiến hành FKBI và POT lần cuối.
Kỹ thuật này có thể thực hiện ở các chỗ chia nhánh với mọi góc khác nhau và bao phủ gần như hoàn hảo lỗ vào nhánh bên. Điểm hạn chế là, tương tự như kỹ thuật Crush, kỹ thuật này để lại 2 lớp kim loại của stent bao phủ đoạn gần và vùng carina. Một hạn chế khác là việc lái dây dẫn vào lại các nhánh qua các mắt cáo có thể gặp khó khăn và tiêu tốn thời gian. Thực hiện POT sau mỗi lần đặt stent để có thể lái dây dẫn dễ dàng hơn.
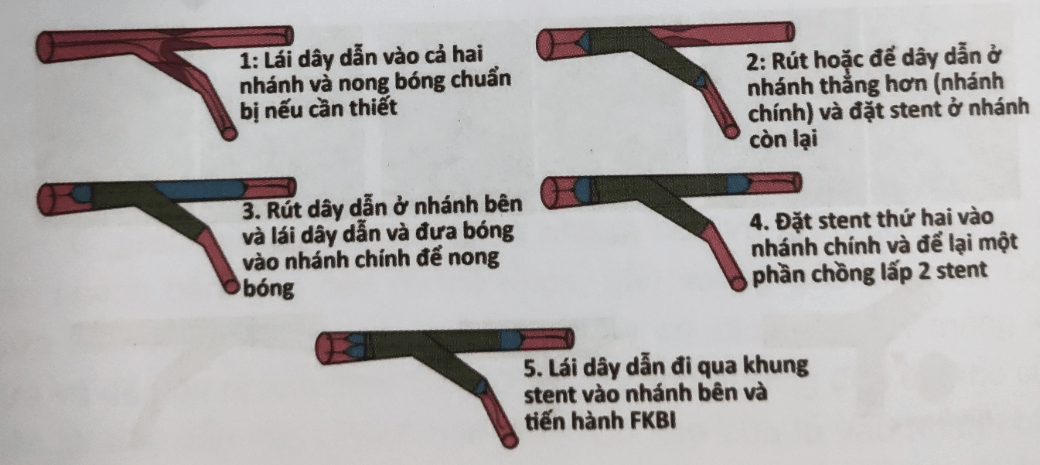
Hình 8.10: Kỹ thuật Culotte [2]
3.2. Kỹ thuật Mini-Crush
Kỹ thuật Crush xuất hiện với sự có mặt của stent phủ thuốc (DES). Từ “mini-” được thêm vào đề nhấn mạnh sự cần thiết của việc hạn chế đến mức tối thiểu lượng stent chồng lấp giữa nhánh chính và nhánh bên. Từ khi FKBI được tiến hành thường quy, tỷ lệ tái hẹp lỗ vào nhánh bên đã giảm đi đáng kể.
Ưu điểm của kỹ thuật Crush là sự mở thông lòng mạch ở cả hai nhánh ngay lập tức được đảm bảo. Điểm này thực sự quan trọng ở những nhánh bên có chức năng đáng kể hoặc khó lái dây dẫn. Nhược điểm là tiến hành FKBI làm thủ thuật trở nên khó khăn hơn, do cần phải lái dây dẫn và đưa bóng đi qua nhiều lớp stent.
Cần sử dụng ống thông 7- hoặc 8-F và kỹ thuật này bắt buộc thủ thuật viên phải đặt hai stent. Tuy nhiên, với kỹ thuật Crush cải tiến có thể cho phép đặt stent provisional và sử dụng ống thông 6-F. Khi góc giữa nhánh chính và nhánh bên gần bằng 90°, có thể chuyển sang sử dụng kỹ thuật T-stent cải tiến.
Mô tả kỹ thuật
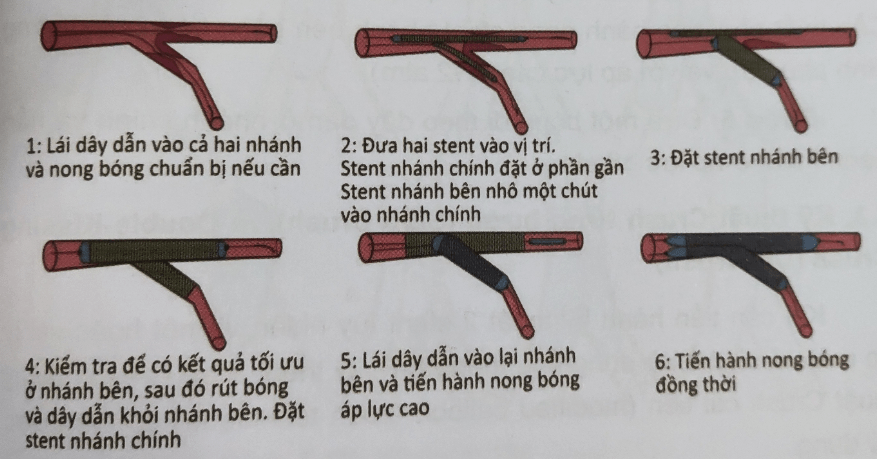
Hình 8.11: Kỹ thuật mini-Crush [2]
Bước 1: Cả hai nhánh được đưa dây dân vào và nong bóng chuẩn bị. Cần đặc biệt chú ý nong bóng nhánh bên. Có thể sử dụng bóng cắt 6 mm nếu có bằng chứng bóng không nở hoàn toàn tại lỗ vào nhánh bên.
Bước 2: Lần lượt đưa stent vào nhánh bên và sau đó là nhánh chính.
Bước 3: Kéo stent nhánh bên dần vào nhánh chính khoảng 2-3 mm. Bước này cần được xác nhạn bằng ít nhất hai góc chụp.
Bước 4: Stent nhánh bên được đặt với áp lực tối thiểu là 12 atm. Bóng stent được xả và rút khỏi ống thông, Tiến hành chụp để xác định rằng nhánh bên đã có kích cỡ lòng thích hợp, dòng chảy bình thường, không có bóc tách đoạn xa và hẹp tồn lưu. Nếu còn tồn thương nhảnh bên cần đặt stent thi cần tiến hành đặt ngay trong lúc này. Sau khi kiểm tra, rút dây dẫn khỏi nhánh bên và tiến hành đặt stent nhánh chính với áp lực cao, thưởng >12 atm và tối ưu hóa bằng POT. Tiến hành chụp kiểm tra lại sau khi rút bóng stent ở nhánh chính.
Bước 5: Dây dẫn được lái vào nhánh bên ở mắt cáo ở giữa hoặc phần gần. Kỹ thuật này có thể sẽ rất khó khăn và nên bắt đầu bằng dây dẫn mềm. Sau đó, đưa bóng có đường kính 1,5 hoặc 1,25mm vào nhánh bên. Nếu bóng nhỏ này không thể đi qua các mắt cáo stent, tiến hành lái dây dẫn đi lại qua mắt cáo ở một vị trí khác. Cần thiết phải tiến hành nong stent nhánh bên bằng bóng có đường kính phù hợp và với áp lực cao (>=12 atm).
Bước 6: Đưa một bóng đi theo dây dẫn ở nhánh chính và tiến hành FKBI ở áp lực 28 atm.
3.3. Kỹ thuật Crush từng bước (Step Crush) và Double-Kissing Crush (DK-Crush)
Khi cần tiến hành kỹ thuật 2 stent tuy nhiên vì một hoặc vài lý do mà chỉ có thể sử dụng ống thông 6-F, kỹ thuật Step Crush hay kỹ thuật Crush cải tiến (modified balloon crush technique) có thể được sử dụng.
Kết quả thu được cuối cùng tương tự như kỹ thuật Crush tiêu chuẩn, sự khác biệt duy nhất là các stent được đưa tới và đặt lần lượt. Sử dụng ống thông 6-F là lý do chính để sử dụng kỹ thuật này.
Kỹ thuật DK-Crush là một biến thể khác của kỹ thuật Crush với ưu điểm là tối ưu hóa quá trình đặt và áp thành của stent.
Mô tả kỹ thuật
Bước 1: Tương tự như kỹ thuật Crush tiêu chuẩn.
Bước 2: Một stent được đưa vào nhánh bên, nhô một vài milimet vào nhánh chính. Một bóng được đưa vào nhánh chính qua chỗ chia nhánh.
Bước 3: Tiến hành đặt stent nhánh bên, sau đó rút bóng stent và tiến hành chụp bằng cản quang. Nếu kết quả tốt, rút bỏ dây dẫn nhánh bên và tiến hành nở bóng nhánh chính (để ép phần nhô của stent nhánh bên) rồi xả và rút bóng. Nong bóng đồng thời có thể được tiến hành tại thời điểm này (không bắt buộc).
Bước 4: Stent thứ hai được đưa vào nhánh chính và đặt tại vị trí tổn thương (thường với áp lực >= 12 atm). Các bước tiếp theo tương tự như kỹ thuật Crush, bao gồm lái dây dẫn lại vào nhánh bên, nong nhánh bên và tiến hành FKBI.
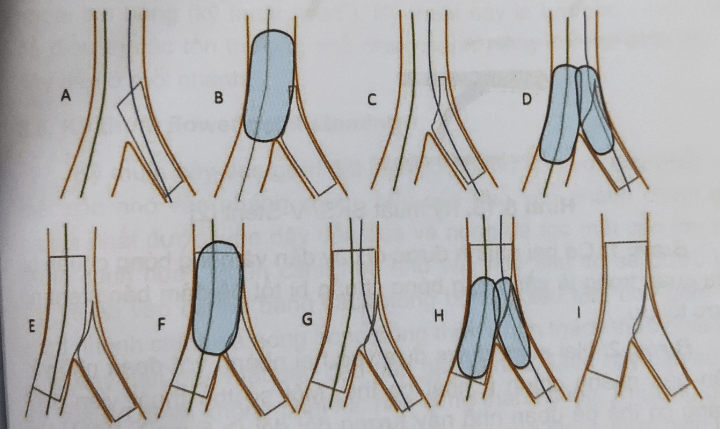
Hình 8.12: Kỹ thuật DK Crush [1]
3.4. Kỹ thuật V- stent và kỹ thuật SKS (Simultaneous Kissing Stent)
Kỹ thuật V- stent và kỹ thuật SKS (Simultaneous Kissing Stent) được thực hiện bằng cách đưa và đặt hai stent đồng thời. Một stent được đưa tới nhánh bên và stent còn lại được đưa tới nhánh chính. Cả hai stent được rút lui dần để tạo được một carina mới càng gần với carina cũ càng tốt. Ưu điểm chính của kỹ thuật V-stent là sẽ không bao giờ mất nhánh nào trong hai nhánh. Thêm vào đó, không cần thiết phải lái dây dẫn qua stent lại khi tiến hành FKBI. Khi hai stent nhô vào nhánh chính tạo ra hình ảnh hai lòng và carina ở rất gần thì kỹ thuật này được gọi là kỹ thuật SKS. Nên thực hiện kỹ thuật V-stent ở tổn thương ở phần xa chỗ chia nhánh với Medina 0,1,1. Khi có tổn thương phần gần, nên sử dụng các kỹ thuật hai stent khác hơn là thực hiện kỹ thuật SKS.
Mô tả kỹ thuật
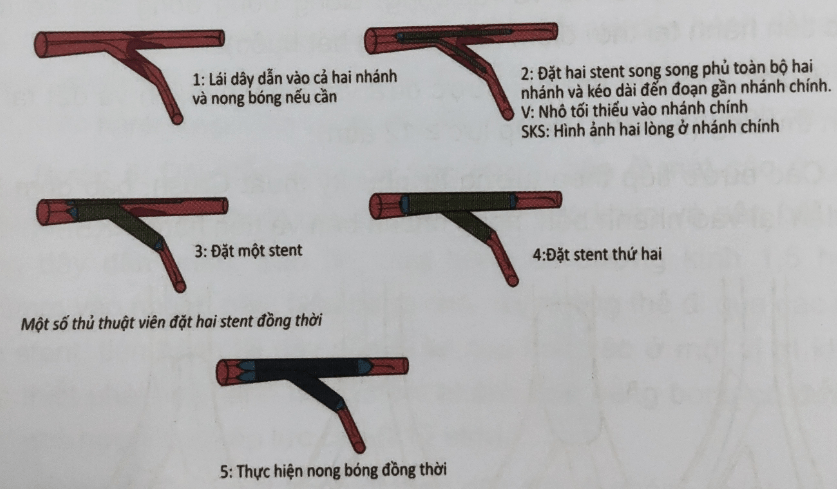
Hình 8.13. Kỹ thuật SKS/ V-Stent (2)
Bước 1: Cả hai nhánh được đi dây dẫn và nong bóng chuẩn bị. điều quan trọng là cần nong bóng chuẩn bị tốt để đảm bảo stent nở được tối ưu.
Bước 2: Hai stent được đưa vào hai nhánh với đoạn nhỏ vào phần gần nhánh chính ít nhất có thể. Một số thủ thuật viên thỉnh thoảng có thể để đoạn nhô này tương đối dài (≥ 5 mm). Đôi khi có thể cần đưa stent thứ nhất tới đoạn xa của mạch máu để tạo thuận lợi để đưa stent thứ hai. Thủ thuật này là cần thiết trong trường hợp đặt stent chỗ chia ba (3 stent nở đồng thời, sử dụng ống thông 9-F). sau khi đưa stent tới đúng vị trí, cần kiểm tra trên ít nhất là hai góc chụp để đảm bảo chắc chắn rằng stent ở vị trí chính xác trước khi tiến hành đặt stent. Mỗi bóng có thể nở lần lượt với áp lực cao ≥ 12 atm hoặc có thể nở bóng đồng thời.
Bước 3: Tiến hành nong bóng đồng thời. Kích thước của bóng hoặc stent được lựa chọn dựa trên đường kinh mạch máu được đặt stent. Trong trường hợp kích thược mạch máu ở đoạn gần tương đối nhỏ mà có nguy cơ quá cỡ khi nong bóng đồng thời, tiến hành nong bỏng đồng thời với áp lực thấp (4 atm).
Việc đặt thêm một stent đoạn gần đối với stent hai lòng trong kỹ thuật SKS thường có vấn đề vì sẽ có sự di lệch về một trong hai nhánh và dễ để lại khoảng trống.
3.5. Kỹ thuật “Y” và kỹ thuật “Skirt”
Kỹ thuật “Y” có giá trị lịnh sử đặc biệt vì đây là kỹ thuật đặt stent chỗ chia nhánh đầu tiên được thực thiện trong một buổi live case. Kỹ thuật này bao gồm nong bóng chuẩn bị sau đó đặt stent ở mỗi nhánh. Nếu kết quả không như ý, stent thứ 3 được đặt thêm ở nhánh chính. Để điều chỉnh kích thước stent cho phù hợp với các stent đã đặt, cần thiết phải điều chỉnh hệ thống đặt stent với một stent phủ ngoài hai bóng (kỹ thuật “skirt”). Kỹ thuật này là lựa chọn cuối cùng để điều trị các tổn thương chỗ chia nhánh nặng đòi hỏi phải giữ lại dây dẫn ở mỗi nhánh.
3.6. Kỹ thuật flower petal stenting
Kỹ thuật này bao gồm đặt stent ở nhánh bên với duy nhất một mắt cáo nhô vào nhánh chính. Mắt cáo nhô vào nhánh chính gần carina nhất được luồn dây dẫn qua và nong để tạo mắt cáo lớn hay “hình cảnh hoa”. Phần cánh hoa nhô vào này sau đó sẽ được làm dẹt và ép vào carina bằng cách nong bóng nhiều lần, bao gồm đặt stent nhánh chính và nong bóng đồng thời. Phần thách thức nhất này là lái dây dẫn qua mắt cáo đầu tiên gần carina. Điều này cần sự hỗ trợ của IVUS và không phải lúc nào cũng thành công. Phương pháp tiếp cận khác là nong bóng một phần ở đầu gần stent, thực hiện luồn dây dẫn qua mắt cáo đầu tiên trước khi đưa stent vào ống thông. Kỹ thuật này chủ yếu áp dụng cho tồn thương chỗ chia nhánh của thân chung động mạch vành trái.
4. CHỖ CHIA NHÁNH THÂN CHUNG ĐỘNG MẠCH VÀNH TRÁI
(Xem bài “Can thiệp chỗ chia nhánh thân chung động mạch vành trái”)
5. TỔN THƯƠNG LỖ VÀO CỦA LAD HOẶC LCX
Tồn thường chỗ chia nhánh LM 0,1,0 (lỗ vào LAD) thường được cho là không phù hợp để can thiệp qua da, bởi vì kỹ thuật khó và nguy cơ xuất hiện nhiều biến chứng nghiêm trọng. Hai chiến thuật thường được sử dụng là đặt stent chính xác tại lỗ vào LAD hoặc đặt stent từ LM tới LAD. Nên sử dụng IVUS để đánh giá sự phân bố của các mảng xơ vữa trước khi quyết định sử dụng kỹ thuật nào trong từng trường hợp. Đặt stent ngay tại lỗ vào LAD phù hợp trong trường hợp chỗ chia nhánh có góc lớn và IVUS cho thấy không có tổn thương ở phần xa LM. Kỹ thuật này cần đặt stent vùng đối diện carina và nhô một chút ở lỗ vào LCx. Phần gần của stent được đặt ngay tại phần gần của carina trên hình CMV (Có thể dùng đầu dò IVUS đề làm mốc đối chiếu). Nhược điểm của kỹ thuật này bao gồm (a) Nếu stent đặt quá gần, nhô vào LM, nó có thể ảnh hưởng đến LCx là gây khó khăn cho lần can thiệp sau; (b) Nếu lỗ vào của LAD không được phủ stent hoàn toàn, tỷ lệ tái hẹp sẽ tăng. Do vậy, việc xác định vị trí đặt stent tối ưu là điểm mấu chốt trong kỹ thuật này. Hơn nữa, nhánh có tồn thương lỗ vào thường kèm theo tổn thương phần xa LM, do vậy, kỹ thuật này có thể sẽ có nguy cơ không bao phủ hết toàn bộ tổn thương. Trong trường hợp này, tổn thương lỗ vào nhánh chính sẽ tương tự như tổn thương chỗ chia nhánh và nhiều ý kiến cho rằng, đối với tổn thương lỗ vào LAD và LCx nên được đặt stent từ LM vào nhánh chính và đặt stent provisional nhánh bên.
Tổn thương lỗ vào nhánh bên (0,0,1): tổn thương tại lỗ vào nhánh chéo/nhánh bờ nhánh sau bên. Tổn thương này đặc biệt quan trọng do đây có thể là nguồn gốc gây tổn thương nhánh chính. Tổn thương nhánh bên đơn độc (0,0,1), mặc dù không thường gặp. nhưng là tổn thương rất khó khăn để điều trị (đặc biệt là chỗ chia nhánh góc hẹp, dạng chữ Y). Thủ thuật viên cần nhớ rằng can thiệp quá nhiều đối với tổn thương này không phải lúc nào cũng là phương thức điều trị tốt nhất, và nó có thể gây tổn thương và hẹp nhảnh chính. Đôi khi, nong bóng cắt (cutting balloon) nên được cân nhắc là phương pháp điều trị tối thiểu đối với tổn thương này.
Brunel và cộng sự đã phát triển một phương pháp tiếp cận điều trị đối với nhóm tổn thương này, bao gồm đặt stent từ đoạn gần nhánh chính vào nhánh bên, sau đó mở mắt cáo vào đoạn xa nhánh chính và tiến hành FKBI.
Một phương pháp khác là sử dụng một stent ngắn nhánh bên (tuy nhiên khó đặt đúng vị trí/ khó bao phủ toàn bộ tổn thương/đôi khi không thể thực hiện được), hoặc sử dụng stent chuyên dụng cho chỗ chia nhánh. Cần đánh giá tổn thương chức năng của nhánh bên bằng FFR và cần nhớ rằng, điều trị nội khoa tối ưu cũng là một phương án tiếp cận hợp lý.
6. STENT CHUYÊN DỤNG CHO TÔN THƯƠNG CHỖ CHIA NHÁNH
Các phương pháp can thiệp ĐMV qua da thông thưởng vẫn có những hạn chế nhất định như cần duy trì đường vào nhánh bên trong suốt thủ thuật; khung stent nhánh chính che lấp lỗ vào nhánh bên làm việc lái dây dẫn vào lại hoặc đưa bóng/stent tới tổn thương nhánh bên khó khăn hơn; biến dạng stent nhánh chính khi nong nhánh bên; không phủ hoàn toàn tổn thương tại lỗ vào nhánh bên; cấu trúc khung stent không đủ vững để nong bóng nhánh bên dẫn đến biến dạng; và cuối cùng là kỹ năng và kinh nhiệm của người tiến hành thủ thuật.
Stent chuyên dụng cho chỗ chia nhánh đã được thiết kế và chế tạo để khắc phục những hạn chế trên. Ưu điểm của hầu hết các loại stent này là có thể thực hiện đặt stent chỗ chia nhánh mà không cần lái dây dẫn trở lại vào nhánh bên.
Phân loại stent chuyên dụng cho chỗ chia nhánh bao gồm:
(1) Stent dùng cho kỹ thuật provisional stenting: loại stent này tạo thuận lợi cho việc duy trì đường vào nhánh bên sau khi đặt stent nhánh chính mà không cần lái dây dẫn lại qua khung stent nhánh chính và cho phép đặt stent nhánh bên khi cần thiết (Ví dụ: Petal, former AST stent, [Boston Scientific, Natick, MA]; Multi-link Frontier/ Pathfinder/SBA [Abbott Vascular Devices]: Invatec Twin-Rail [Medtronic/Invatec, Brescia, Italy]: Nile Croco/Pax [Minvasys, Genevilliers, France]; Antares [Trireme Medical, CA]; Y-Med SideKick [YMed, San Diego, CA]; Stentys [Stentys SAS, Clichy, France]).
(2) Stent cần đặt thêm stent khác tại chỗ chía nhánh (VD: Axxess Plus [Devax, Irvine, CA]; Sideguard [Cappella, MA]; Tryton [Tryton Medical, MA)). Stent Tryton và Sideguard được thiết kế để đặt stent nhánh bên trước và cần lái dây dẫn vào lại nhánh bên sau khi đặt stent nhánh chính để tiến hành FKBI. Stent Axxess, trong khi đó, lại được đặt đầu tiên ở đoạn gần nhánh chính tới ngang mức carina và không cần lái dây dẫn lại vào nhánh bên. Tuy nhiên, có thể cần đặt thêm hai stent ở đoạn xa nhánh chính và nhánh bên để phủ hoàn toàn tổn thương.
Stent chuyên dụng cho tổn thương chỗ chia nhánh mặc dù khắc phục được nhiều hạn chế về mặt kỹ thuật so với các kỹ thuật đặt stent chỗ chia nhánh thông thường, tuy nhiên các dữ liệu hiện tại cho thấy chưa có sự khác biệt rõ ràng về tiên lượng so với kỹ thuật provisional T stent trong phần lớn các tổn thương chỗ chia nhánh. Cần có thêm dữ liệu từ các thử nghiệm lâm sàng để đó thể biết rõ được giá trị của stent chuyên dụng trong điều trị tổn thương chỗ chia nhánh.
7. VAI TRÒ CỦA NHỮNG THỦ THUẬT HỖ TRỢ
7.1. Siêu âm nội mạch vành (IVUS)
Năm 2018, EBC đã đưa ra đồng thuận về việc sử dụng IVUS trong đánh giá và điều trị tổn thương LM, với những điểm chính như sau:
– Mảng xơ vữa ở tổn thương LM thường lan tỏa và khó có thể đánh giá chính xác chỉ bằng hình ảnh chụp mạch vành.
– Mảng xơ vữa đơn độc tại lỗ vào LAD được nhìn thấy trên hình ảnh chụp mạch chỉ ở 9% trường hợp, trong đó, với việc sử dụng các thủ thuật hình ảnh nội mạch, >90% trường hợp có mảng xơ vữa kéo dài từ LAD tới LM.
– Trong trường hợp diện tích lòng mạch tối thiểu (MLA) không đồng nhất khi kéo đầu dò IVUS từ cả LAD và LCx, MLA nhỏ nhất là chính xác nhất.
– Dữ liệu của IVUS có thể được sử dụng nhằm:
– Đánh giá nguy cơ tổn thương đoạn gần nhánh bên cũng như lỗ vào nhánh bên, đánh giá khả năng dịch chuyển carina về phía nhánh bên (thường là LCx).
– Xác định chính xác chiều dài và đường kính stent.
– Biết trước đường kính khi tối ưu hóa đoạn gần – đường kính tham chiếu và chiều dài từ carina đến rìa đầu gần của stent.
Sau khi đặt stent nhánh chính, có thể sử dụng IVUS để tối ưu hóa kết quả cuối cùng:
– Xác định hẹp rìa stent/bóc tách.
– Xác định mức độ áp thành của stent và mức độ dãn nở ở nhánh chính, bao gồm đoạn gốc LM.
– Kiểm soát việc lái dây dẫn lại vào nhánh bên.
– Đánh giá khả năng nở và áp thành của stent nhánh bên, đặc biệt ở vị trí lỗ vào nhánh bên trong trường hợp đặt stent thứ hai.
– Loại trừ tình trạng biến dạng stent.
7.2. Khoan cắt mảng xơ vữa (Rotational Atherectomy)
Khoan cắt mảng xơ vữa có vai trò quan trọng cho phép tối ưu hóa sự nở stent trong trường hợp vôi hóa nặng, giúp stent nở tối ưu và cân xứng.
Vấn đề cần được cân nhắc là mức độ vôi hóa nào thì nên sử dụng khoan cắt mảng xơ vữa và ngược lại, khi nào thì chỉ cần sử dụng sử dụng bóng áp lực cao là đủ. Ngoại trừ những thông tin có được từ IVUS hoặc những trường hợp không thể đưa bóng qua tổn thương, thì những trường hợp còn lại, việc chỉ định khoan cắt mảng xơ vữa còn nhiều tranh cãi, tùy thuộc nhiều vào quyết định của bác sĩ can thiệp. Kích thước của mũi khoan (Burr) thường nhỏ để điều trị mảng xơ vữa và hạn chế nguy cơ tắc mạch. Nhiều trường hợp đặt stent bên không tối ưu, chủ yếu do không điều trị chuẩn bị tốt. Đây là một trong những nguyên nhân chính gây tái hẹp lỗ vào nhánh bên.
7.3. Bóng cắt mảng xơ vữa (Cutting balloon)
Như đã nhắc đến ở trên, một thiết bị khó có thể điều trị tối ưu cho mọi tổn thương. Có thể sử dụng bóng cắt để điều trị những tổn thương vôi hóa và xơ hóa mức độ vừa, đặc biệt tại vị trí lỗ vào của nhánh bên.
7.4. Điều trị thuốc phối hợp
Khi tiến hành đặt stent chỗ chia nhánh với một hoặc hai stent, chúng ta thường không cần thay đổi liều lượng heparin trong thủ thuật (100 U/kg khi không sử dụng ức chế glycoprotein Ilb/Illa và 70 U/kg khi sử dụng ức chế glycoprotein Ilb/llla. Ức chế glycoprotein Ilb/lla được dùng cho những tổn thương có huyết khối và những trường hợp hội chứng vành cấp.
Điều trị liều tải với 600 mg clopidogrel trong phòng thông tim, hoặc sử dụng liều tải ticagrelor hoặc prasugrel. Duy trì DAPT (thienopyridine kết hợp aspirin) trong tối thiểu 6 tháng và thường kéo dài đến 1 năm.
8. KẾT LUẬN
Tổn thương chỗ chia nhánh là tổn thương thường gặp đối với các bác sĩ tim mạch can thiệp, đặc biệt là ở những bác sĩ thường xuyên điều trị bệnh nhân tổn thương đa nhánh mạch vành. Các phương pháp tiếp cận điều trị loại tổn thương này đều dựa trên một nguyên lý đơn giản: Nhánh chính là nhánh ưu tiên, nhánh bên là nhánh phụ. Cần lựa chọn đường kính stent dựa vào đường kinh đoạn xa để hạn chế tình trạng dịch chuyển carina và dùng kỹ thuật POT đề có đường kính stent tối ưu ở đoạn gần nhánh chính. Kỹ thuật can thiệp chỗ chia nhánh vẫn còn nhiều thách thức và cần được tiếp tục phát triển để tối ưu hóa kết quả điều trị.
TÀI LIỆU THAM KHẢO
- Thierry Lefèvre, Thomas Hovasse. Bifurcation lesions. The PCR-EAPCI textbook of Percutaneous Interventional Cardiovascular Medicine. 2020.
- Antonio Colombo, Goran Stankovic. Bifurcation and Branch Vessel Stenting. Textbook of Interventional Cardiology, 8ed.2020: 400-418e2.
- Yves Louvard, Thierry Lefèvre. Treatment of Coronary Artery Bifurcation Lesions. Catheter-base Cardiovascular Interventions. 2013: 555-574.
- Emmanouil Brilakis. Bifurcations. Manual of Percutaneous Coronary Interventions. 2021: 267-301.
- Chen SL, Zhang JJ, Han Y, et al. Double kissing crush versus provisional stenting for left main distal bifurcation lesions: DKCRUSH V randomized trial. J Am Coll Cardiol. 2017; 70: 2605-2617.
- Stankovic G, Lefevre T, Chieffo A, et al. Consensus from the 7th European bifurcation club meeting. EuroIntervention. 2013; 9: 36-45.
- Lassen JF, Burzotta F, Banning AP, et al. Percutaneous coronary intervention for the left main stem and other bifurcation lesions: 12th consensus document from the European bifurcation club. Eurolntervention. 2018; 13:1540-1553.
- Lassen JF, Holm NR, Banning A, et al. Percutaneous coronary intervention for coronary bifurcation disease: 11th consensus document from the European bifurcation club. Eurolntervention. 2016; 12: 38-46.
- Hildick-Smith D, Lassen JF, Albiero R, et al. Consensus from the 5th European bifurcation club meeting. EuroIntervention. 2010; 6; 34-38.
- Kervinen K, Niemela M, Romppanen H, et al. Clinical outcome after crush versus culotte stenting of coronary artery bifurcation lesions: the Nordic stent technique study 36-month follow-up results. JACC Cardiovasc Interv. 2013;6: 1160-1165.
11.Koo BK, Waseda K, Kang HJ, et al. Anatomic and functional evaluation of bifurcation lesions undergoing percutaneous coronary intervention. Circ Cardiovasc Interv. 2010; 3: 113-119.
- Pan M, Medina A, Suarez de Lezo J, et al. Coronary bifurcation lesions treated with simple approach (from the Cordoba & Las Palmas [CORPAL] Kiss Trial). Am J Cardiol. 2011; 107: 1460-1465.
- Gwon HC, Hahn JY, Koo BK, et al. Final kissing ballooning and long-term clinical outcomes in coronary bifurcation lesions treated with 1-stent technique: results from the COBIS registry. Heart. 2012; 98: 225-231.
- Chen SL, Ye F, Zhang JJ, et al. Randomized comparison of FFR-guided and angiography-guided provisional stenting of true coronary bifurcation lesions: the DKCRUSH-VI trial (Double Kissing Crush Versus Provisional Stenting Technique for Treatment of Coronary Bifurcation Lesions VI). JACC Cardiovasc Interv. 2015; 8: 536-546.
- Derimay F, Finet G, Souteyrand G, et al. Benefit of a new provisional stenting strategy, the re-proximal optimizing technique: the rePOT clinical study. EuroIntervention. 2018; 14: e325-e332.
- Burzotta F, Sgueglia GA, Trani C, et al. Provisional TAP stenting strategy to treat bifurcated lesions with drug-eluting stents: one-year clinical results of a prospective registry. J Invasive Cardiol.2009; 21:532-537.
- Galassi AR, Colombo A, Buchbinder M, et al. Long-term outcomes of bifurcation lesions after implantation of drug eluting stents with the “mini-crush technique”. Catheter Cardiovasc Interv. 2007; 69: 976-983.
- Collins N, Dzavik V. A modified balloon crush approach improves side branch access and side branch stent apposition during crush stenting of coronary bifurcation lesions. Catheter Cardiovasc Interv. 2006; 68: 365-371.
- Chen S, Zhang J, Ye F, et al. DK crush (double-kissing and double crush) technique for treatment of true coronary bifurcation lesions: illustration and comparison with classic crush. J Invasive Cardiol. 2007; 19: 189-193.
- Jim MH, Ho HH, Chan AO, et al. Stenting of coronary bifurcation lesions by using modified crush technique with double kissing balloon inflation (sleeve technique): immediate procedure result and short-term clinical outcomes. Catheter Cardiovasc Interv. 2007; 69:969-975.
- Schampaert E, Fort S, Adelman AG, Schwartz L. The V-stent: a novel technique for coronary bifurcation stenting. Cathet Cardiovasc Diagn. 1996; 39: 320-326.
- Sharma SK. Simultaneous kissing drug-eluting stent technique for percutaneous treatment of bifurcation lesions in large-size vessels. Catheter Cardiovasc Interv. 2005; 65: 10-16.
- Kinoshita Y, Katoh O, Matsubara T, et al. First clinical experience of “flower petal stenting”: a novel technique for the treatment of coronary bifurcation lesions. JACC Cardiovasc Interv. 2010; 3: 58-65.
- Brunel P, Martin G, Bressollette E, et al. “Inverted” provisional T stenting, a new technique for Medina 0,0,1 coronary bifurcation lesions: feasibility and follow-up. Eurolntervention. 2010; 5: 814-820.
- Grundeken MJ, Magro M, Gil R, et al. Dedicated stents for distal left main stenting. Eurolntervention. 2015; 11(suppl V): V129-V134.
- Genereux P, Kumsars I, Lesiak M, et al. A randomized trial of a dedicated bifurcation stent versus provisional stenting in the treatment of coronary bifurcation lesions. J Am Coll Cardiol. 2015; 65: 533-543.
- Genereux P, Kumsars 1, Schneider JE, et al. Dedicated bifurcation stent for the treatment of bifurcation lesions involving large side branches: outcomes from the Tryton confirmatory study. JACC Cardiovasc Interv. 2016; 9: 1338-1346.
- de la Torre Hernandez JM, Baz Alonso JA, Gomez Hospital JA, et al. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease: pooled analysis at the patient level of 4 registries. JACC Cardiovasc Interv. 2014; 7: 244-254.
- Ye Y, Yang M, Zhang S, Zeng Y. Percutaneous coronary intervention in left main coronary artery disease with or without intravascular ultrasound: a meta-analysis. PLoS One. 2017; 12: e0179756.
- Mintz GS, Lefevre T, Lassen J, et al. Intravascular ultrasound in the evaluation and treatment of left main coronary artery disease: a consensus statement from the European bifurcation club (EBC). EuroIntervention. 2018; 14: e467-e474.
- Costa RA, Mintz GS, Carlier SG, et al. Bifurcation coronary lesions treated with the “crush” technique: an intravascular ultrasound analysis. J Am Coll Cardiol. 2005; 46: 599-605.
32. Weisz G, Metzger DC, Liberman HA, et al. A provisional strategy for treating true bifurcation lesions employing a scoring balloon for the side branch: final results of the AGILITY trial. Catheter Cardiovasc Interv. 2013; 82: 352-359.