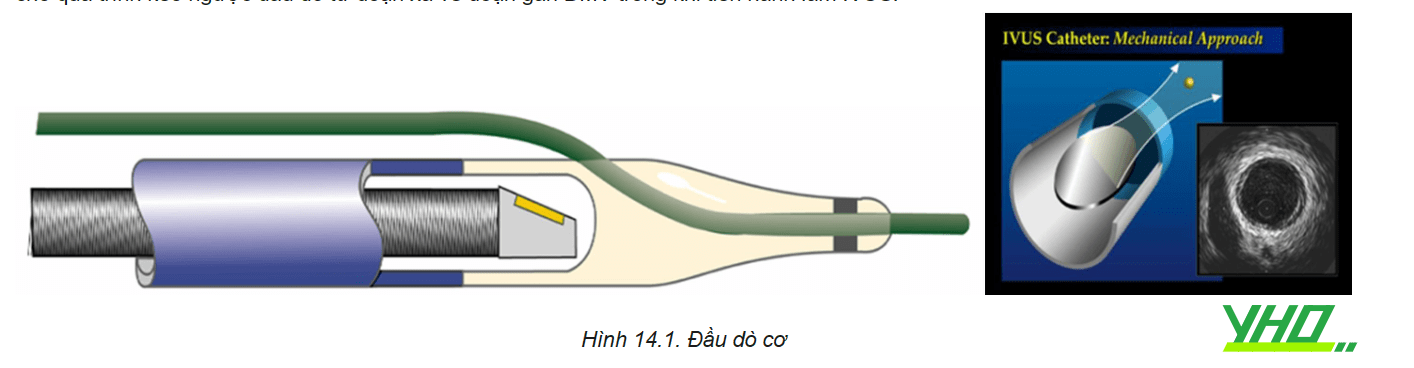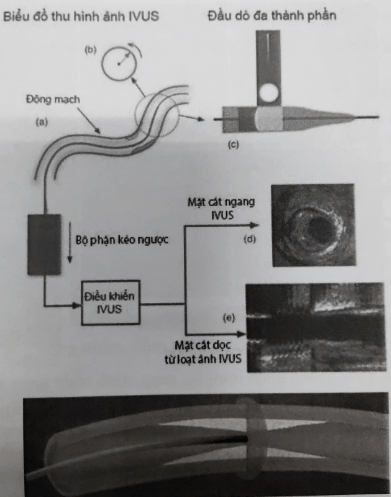
Phân tích hình ảnh cơ bản trên siêu âm trong lòng mạch
Nguyễn Đức Chinh, Nguyễn Xuân Vinh, Trần Hoà, Vũ Hoàng Vũ
MỤC TIÊU
1. Đánh giả được hình thái học của mảng xơ vữa
2. Nhận biết được hình ảnh học trong hội chứng vành cấp
1. ĐÁNH GIÁ ĐỊNH LƯỢNG
A. Hình thái mảng xơ vữa
Hình ảnh siêu âm khác với mô học. IVUS không thể phát hiện và định lượng nội dung mô học cụ thể.
Các mảng mềm: Thuật ngữ “mềm” không phải đặc điểm cấu trúc của mảng xơ vữa, mà là để chỉ tín hiệu âm thanh phát sinh từ chỗ hồi âm thấp. Điều này là do hàm lượng lipid cao trong một tổn thương tế bào. Tuy nhiên, giảm phản âm cũng có thể là do hoại tử lõi, xuất huyết trong thành hoặc huyết khối. Hầu hết các mảng mềm đều chứa ít và elastin.
Mảng xơ: Những mảng xơ có độ hồi âm trung gian giữa mảng mềm và mảng với hóa có độ hồi âm cao. Các mảng xơ đại diện cho phần lớn các tổn thương xơ vữa động mạch. Nói chung, hàm lượng mô sợi càng lớn thì độ hồi âm càng lớn. Các mảng nhiều xơ có thể tạo bóng, dẫn đến bị phân loại nhầm là vôi hóa.
Canxi: Xem phần phép đo canxi,
Hỗn hợp: Các mảng thường chứa nhiều hơn thành phần phụ. Thuật ngữ thích hợp cho các mảng này bao gồm một số mô tả như “fibrocalcific” xơ canxi, “fibrofatty” xo mỡ, v.v…

Hình 1: Hình ảnh đại diện của mảng bám mềm (lipid), xơ và hỗn hợp(từ trái sang phải)
a. Mảng xơ vừa mềm (lipid) có độ hồi âm thấp tương phản với lớp ngoài tham chiếu.
b. Mảng xơ có độ hồi âm trung gian giữa mỏng mềm (giảm âm) và màng với hóa có độ hồi âm cao.
c. Mảng hỗn hợp chứa nhiều hơn một loại thành
Huyết khối: Bằng phương pháp IVUS, huyết khối thường được nhận biết là một khối thường có hình dạng xếp lớp, dạng thủy hoặc hình thành từng mảng. Huyết khối có thể xuất hiện tương đối mờ hoặc có thang màu xám thay đổi hơn với lốm đốm hoặc điểm sáng lấp lánh. Lưu lượng máu trong “vi mạch” cũng rõ ràng trong một số huyết khối. Dòng máu ứ đọng mô phỏng một cục huyết khối với sự tích tụ màu trắng xám của các phản xạ dạng hạt trong lòng mạch. Tiêm thuốc cản quang hoặc nước muối có thể làm phân tán dòng chảy ử động, làm thông lòng mạch và cho phép phân biệt tình trạng ử máu với huyết khối. Tuy nhiên, không có đặc điểm nào trong số này là bệnh sinh của huyết khối, và việc chẩn đoán huyết khối bằng IVUS nên luôn được coi là giả định.

Hình 2: a. Huyết khối, b. Nứt vỡ mảng xơ vữa, c. Loét mảng xơ vữa (a,b,c theo thứ tự từ trái qua phải)
Tăng sinh nội mạc: Đặc điểm tăng sinh nội mạc trong stent sớm thường xuất hiện là mô có độ hồi âm rất thấp, đôi khi ít hồi âm hơn máu trong lòng mạch. Cài đặt hệ thống thích hợp để tránh bỏ qua hình ảnh này. Tình trạng tăng sinh nội mạc trong stent muộn thường mật độ hồi âm cao hơn.
B. Tổn thương không ổn định và vỡ mảng xơ vữa
IVUS không có tính năng xác định chính xác mảng xơ vữa nào là dễ bị tổn thương. Tuy nhiên, các nghiên cứu về tử thiết đã chứng minh rằng tổn thương mạch vành không ổn định thường chứa nhiều lipid với một vỏ bao mỏng. Theo đó, các mảng giảm âm không có nắp xơ dày được đánh giá là đại diện cho các tổn thương xơ vữa động mạch dễ bị tổn thương. Các mảng vỡ có hình dạng rất thay đổi trong IVUS. Ở những bệnh nhân được nghiên cứu sau hội chứng mạch vành cấp, hình ảnh siêu âm có thể cho thấy một vết loét, thường có dấu vết của bao xơ vỡ ở rìa của vết loét. Một loạt các biểu hiện khác phổ biến, bao gồm nứt hoặc xói mòn bề mặt mảng xơ vữa. Các định nghĩa sau được khuyến nghị:
Loét mảng xơ vữa: Một chỗ lõm trong mảng xơ vữa bắt đầu ở đường viền sáng lớp trong, thưởng không có sự mở rộng của EEM so với đoạn tham chiếu. Nứt vỡ mảng xơ vữa: Tình trạng viêm loét mảng xơ vữa với vết rách trong bao xơ. Thuốc tiêm phản quang có thể được sử dụng để chứng minh và xác định điểm nút
Sự hiện diện của huyết khối có thể khiến IVUS khó phát hiện ra vết nứt hoặc loét mảng xơ vữa.
C. Hình thái tổn thương bất thường (phỉnh mạch, giả phình mạch, lòng mạch thật và giả)
Phình mạch: là tổn thương bao gồm tất cả các lớp của thành mạch với diện tích EEM và lỏng mạch >50% so với phân đoạn tham chiếu gần.
Giả phình mạch: Sự gián đoạn của EEM, thường được quan sát thấy sau khi can thiệp.
Lòng mạch thật và giả: Một lòng mạch thật được bao quanh bởi cả ba lớp lớp trong, giữa và ngoài. Lòng mạch giả là một kênh, thường song song với lòng mạch thật, không giao tiếp với lòng mạch thật trên một phần chiều dài của nó.

Hình 3. Ví dụ về các phép đo định tỉnh. a. Mảng xơ vữa giảm âm kèm theo giảm tín hiệu ngược mà không có nhiều canxi (cung tròn). b. Huyết khối thường được thấy như một khối trong lòng mạch, thường có hình dạng xếp lớp, dạng thủy, hoặc từng mảng (mũi tên). c. Bóc tách có nắp di động (đầu mũi tên). d. Mô lồi được phát hiện khi mô bị đùn ra từ stent hoặc khung (dấu “). e. Lòng mạch thật (“V” trong hình ảnh) được bao quanh bởi cả ba lớp của thành mạch, trong khi lòng mạch giả (“C” trong hình ảnh) thì không.
E. Tổn thương không rõ ràng
Các tổn thương mơ hồ về hình ảnh học có thể bao gồm: 1) tổn thương trung gian có mật độ mô học không rõ ràng; 2) tồn thương phình động mạch; 3) hợp lỗ; 4) tồn thương phân nhánh; 5) mạch máu xoắn vặn; 6) tổn thương thân chung mạch vành trái 7) các vị trí bị co thắt; 8) các vị trí bị vỡ mảng xơ vữa; 9) bóc tách sau nong mạch vành; 10) tổn thương tắc hoàn toàn động mạch; 11) các tổn thương mơ hồ về mặt chụp mạch vành; và 12) tổn thương với rối loạn dòng chảy.
Siêu âm nội mạch thường được sử dụng để kiểm tra tổn thương với các đặc điểm trên, trong một số trường hợp, cung cấp thêm bằng chứng cho việc xác định xem hẹp có ý nghĩa lâm sàng hay không (VD: đánh giá hẹp thân chung hoặc hẹp trung bình có triệu chủng). Tuy nhiên, cần phải nhấn mạnh rằng IVUS không cung cấp thông tin sinh lý học mạch vành.
F. Một số trường hợp đặc biệt
1. Đánh giá bệnh lý mạch vành sau ghép tim.
Bệnh mạch vành là nguyên nhân chính gây tử vong sau năm đầu tiên sau khi ghép tim và thường thầm lặng về mặt lâm sàng do tim bị suy giảm chức năng. Xét nghiệm về chức năng trong thiếu máu cục bộ thường không được thực hiện cho đến khi bệnh chuyển sang giai đoạn nặng. Thông thường, chụp mạch được thực hiện hàng năm để giám sát, nhưng tính chất lan tỏa của sang thương làm giảm khả năng phát hiện bệnh. Theo đó, IVUS đã nổi lên như một phương pháp tối ưu để phát hiện sớm.
Định nghĩa về độ dày nội mạc bất thường còn gây tranh cãi vì việc phân loại thay đổi liên tục, độ dày nội mạc bình thường hoặc bất thường chưa được quy định rõ ràng. Hầu hết các nghiên cứu siêu âm đều xác định ngưỡng cho bệnh mạch vành sau ghép tim với độ dày lớp nội mạc > 0,5 mm.
Quy trình IVUS sử dụng nhiều cách tiếp cận khác nhau trong việc thu nhận hình ảnh hệ mạch vành để phát hiện bệnh lý mạch máu ghép. Một số trung tâm kiểm tra ngẫu nhiên ba hoặc bốn vị trí cách nhau ít nhất 1 em, nhưng phương pháp này bị hạn chế bởi sai số thu nhận hình ảnh, sai lệch lựa chọn và không thích hợp cho phân tích ở những lần khảo sát sau. Cách tiếp cận khác lựa chọn vị trí bằng cách sử dụng các tiêu chỉ định trước để có đại diện đồng đều từ mỗi đoạn mạch vành. Điều này giúp nắm bắt được tình trạng dày nội mạc nghiêm trọng nhất, nhưng nó cũng bị hạn chế bởi sự lựa chọn chủ quan. Cách tiếp cận tốt nhất là sử dụng kéo ngược tự động để xác định toàn bộ thể tích EEM, lòng mạch và nội mạc. Việc này tuy tốn nhiều công sức nhưng nếu được thực hiện cẩn thận là chính xác nhất.
Tất cả các phương pháp trên đã được sử dụng để so sánh hình ảnh IVUS khi theo dõi sau ghép tim với hình ảnh IVUS ban đầu sau ghép tim. Các hình ảnh kể nhau thưởng được so sánh cạnh nhau, các mốc về hình ảnh mạch máu và IVUS (các nhánh bên, màng ngoài tim và tĩnh mạch tim) được sử dụng để giúp tạo sự tương đồng giữa các vị trí. Ngoài ra, có thể so sánh trình tự kéo ngược có động cơ, một số so sánh vị trí thường được yêu cầu vì các điểm đánh dấu thường hơi khác nhau về trình tự tại thời điểm khác nhau.
2. Kiểm tra thoải triển tiến triển.
Các nghiên cứu động mạch học về sự thoái triển/tiến triển của xơ vữa động mạch thưởng cho thấy những thay đổi tối thiểu về kích thước mạch sau khi điều trị. Siêu âm nội mạch có khả năng mô tả thành mạch, nên có thể phù hợp cho các nghiên cứu tiến triển/thoái triển xơ vữa động mạch. Siêu âm nội mạch thường phát hiện mức độ bệnh tốt hơn nhiều so với chụp mạch, thường cho thấy xơ vữa động mạch ở hầu như tất cả các lát cắt trong lúc kéo ngược được thực hiện ở những bệnh nhân chỉ có một số chỗ hẹp.
Một số nghiên cứu lớn về thoái triển/tiến triển bằng IVUS hiện đang được tiến hành. Gần như tất cả đều sử dụng phương pháp luận giống nhau. Một đoạn mạch đích được xác định, và ống thông siêu âm được đặt ở xa một điểm đánh dấu (như nhánh mạch vành). Kéo ngược đầu dò, thường ở tốc độ 0,5 mm/s. Sử dụng nhánh bên đánh dấu làm điểm bắt đầu, một đoạn mạch dài (25 đến 50 mm) được phân tích, đo diện tích EEM, lòng mạch và mảng bám cộng với lớp giữa. Bởi vì kéo ngược dài sẽ chứa ít nhất 1.000 khung hình, phân tích thường là các tập hợp con ở các khoảng thời gian được định trước, thưởng là cứ 1 mm. Các nghiên cứu cho thấy thể tích mảng xơ vữa cộng với lớp giữa được tính toán theo cách này có khả năng tái tạo cao và các nghiên cứu nối tiếp có thể phát hiện những thay đổi rất nhỏ về thể tích mảng xơ vữa.
3. Bệnh động mạch chủ, động mạch cảnh và ngoại biên.
Chụp mạch cản quang có một số hạn chế trong việc xác định giải phẫu của các mạch ngoại biên. Thông thường, chụp mạch có thể không nhìn thấy ở góc cạnh hoặc trực diện, tổn thương không rõ ràng và vôi hóa nặng ở các động mạch sâu trong lồng ngực, bụng, xương chậu và đùi. IVUS có thể giúp phát hiện ra các tổn thương bị cho lấp. Thường có sự chênh lệch lớn về kích thước giữa các mạch ngoại vi lớn và các ống thông, điều này làm tăng các sai số trong việc hiệu chuẩn các phép đo.
Phân tích IVUS ở các mạch ngoại biên cũng tương tự mạch vành. Việc lựa chọn kích thước, tần số và loại ống thông dựa trên kích thước và vị trí của mạch máu cần kiểm tra và kích thước sheath hoặc ống thông can thiệp. Động mạch vành thì độ phân giải trường gần là quan trọng nhất, còn ở mạch ngoại vi kích thước lớn hơn và thay đổi hơn thì độ phân giải trường xa cũng quan trọng ngang bằng. Trên thực tế, các vị trí tồn thương và tham chiếu được xác định, đánh giá và đo lường trước và sau can thiệp tương tự như trong ứng dụng mạch vành. Thông tin được sử dụng để chọn thiết bị thích hợp và xác nhận kết quả. Xơ vữa lan tỏa, đặc biệt phổ biến ở hệ mạch ngoại vi, có thể ngăn cản việc xác định vị trí tham chiếu “bình thường”.
Một số xảo ảnh hoặc hạn chế của IVUS thể hiện rõ hơn trong khảo sát mạch ngoại vi, đặc biệt là độ nghiêng của ống thông. Các vấn đề quan trọng khác, bao gồm độ phân giải không gian hạn chế trong các mạch rất lớn và bóng lưng ở mảng xơ với hóa.
4. Tổn thương tái hợp.
Tổn thương tái phát là chỗ hẹp nằm trong vùng điều trị với diện tích lòng mạch nhỏ nhất khi theo dõi. Vị trí cắt ngang của tổn thương tái hẹp thường khác với vị trí cắt ngang nhỏ nhất trước hoặc sau can thiệp. Do đó, lát cắt có kích thước lòng mạch nhỏ nhất của tổn thương tái phát không thể so sánh trực tiếp với lát hình ảnh trước hoặc sau can thiệp. Các tổn thương tái hẹp trong stent cần được xem xét cẩn thận. Phải đo lòng mạch nhỏ nhất và diện tích đặt stent nhỏ nhất, nhưng có thể không cùng một vị trí cắt ngang trong đoạn stent; và trên thực tế, diện tích lòng mạch tối thiểu có thể nằm bên ngoài stent.
Để đánh giá quá trình tái hẹp, lát cắt có diện tích lòng mạch nhỏ nhất tại thời điểm theo dõi được xác định và so sánh với lát cắt tương tự trên các khảo sát trước và sau can thiệp trước đó, sử dụng các phép đo từ điểm đánh dấu hoặc bằng cách xác định đánh dấu mạch hoặc quanh mạch. Phân tích chiều dài đoạn mạch bao gồm cả 3 vị trí (trước, sau và tái can thiệp) có thể hữu ích trong một số trường hợp. Ba phép đo cơ bản ở các tổn thương không đặt stent thường được ghi nhận là giá trị tuyệt đối và sự thay đổi của diện tích và thể tích EEM, lòng mạch và mảng xơ vữa. Trong các tổn thương đã đặt stent, ít nhất hai phép đo được sử dụng là giá trị tuyệt đối và sự thay đổi của kích thước stent và lòng mạch. (Đặt stent thường có thể hạn chế đo các diện tích EEM trong đoạn stent.) Có thể có thay đổi về kích thước đoạn tham chiếu. Các lát cắt trong đoạn tham chiếu có cùng vị trí cắt ngang trên các khảo sát tiếp nối phải được xác định để phân tích so sánh. (Xem đoạn trước đó để biết định nghĩa về đoạn tham chiếu).
5. Cầu nối tĩnh mạch
Trong cầu nối tĩnh mạch, thành mạch và các đặc điểm mảng xơ vữa khác với ở động mạch vành nơi ghép. Thành cầu nổi không có mô xung quanh và không có nhánh bên. Các tĩnh mạch tại chỗ không có EEM. Tuy nhiên, cầu nối tĩnh mạch thường trái qua “động mạch hóa” với những thay đổi về hình thái bao gồm bao xơ dày lên, phì đại lớp giữa và lắng đọng lipid. Diện tích EEM được đo bằng cách lần theo đường viền bên ngoài của tĩnh mạch. Tất cả các phép đo khác bao gồm diện tích mảng mảng xơ vữa cộng lớp giữa và gánh nặng mảng xơ vữa, được tính toán tương tự như bệnh mạch vành.
6. Các nghiên cứu sau can thiệp
Các nghiên cứu sau can thiệp có thể đánh giá cơ chế tái định dạng trong stent, bao gồm cả tăng sinh nội mạc và hiện tượng recoil stent. Sử dụng phương pháp kéo ngược tự động, đo toàn bộ thể tích stent, lòng mạch và tăng sinh nội mạc (stent trừ lòng mạch) được tính toán sau can thiệp và khi theo dõi. Sự phân bố của nội mạc có thể được phân tích bằng cách vẽ biểu đồ vùng tăng sinh nội mạc trên chiều dài của stent.
Sử dụng phân tích hai chiều để đo sự mất lòng muộn muộn bằng cách so sánh giữa CSA lòng mạch tối thiểu sau can thiệp và khi theo dõi. Độ recoil của stent có thể được đo bằng cách so sánh CSA tối thiểu sau đặt stent với thông số theo dõi. Có thể có những thay đổi về kích thước đoạn tham chiếu. Các lát cắt phân đoạn tham chiếu có cùng vị trí trục trên các lần đo phải được xác định để phân tích so sánh. Sự phân bố thay đổi của đoạn tham chiếu (diện tích EEM, mảng xơ vữa và lòng mạch) có thể được phân tích bằng cách vẽ biểu đồ các thông số này trên chiều dài của đoạn tham chiếu tiếp giáp với cạnh stent.
7. Xạ trị trong lòng mạch:
IVUS có thể được sử dụng để nghiên cứu cơ chế và kết quả của chiến lược giảm tái hẹp, bao gồm cả liệu pháp xạ trị trong lòng mạch. Trong các tổn thương không đặt stent, các lần đo nối tiếp (sau xạ trị và theo dõi sau đó) vị trí tổn thương và đoạn tham chiếu EEM, lòng mạch và mảng xơ vữa là cách tiếp cận chính xác nhất. Trong các tổn thương đã đặt stent, các phép đo nên bao gồm phân tích (sau xạ trị với theo dõi sau đó) thể tích của stent, lòng mạch và tăng sinh nội mạc và nếu có thể, đo cả thể tích EEM.
Ngoài ra, phải phân tích EEM, lòng mạch và mảng xơ vữa của đoạn tham chiếu vì xạ trị có thể ảnh hưởng đến các đoạn “không được xử lý” này. Sự phân bố của tăng sinh lớp nội mạc có thể được phân tích bằng cách vẽ biểu đồ CSA tăng sinh nội mạc trên chiều dài của stent. Hiệu ứng cạnh có thể được đánh giá bằng cách vẽ biểu đồ những thay đổi về CSA trong stent, lòng mạch và tăng sản nội mạc trong stent và những thay đổi về EEM tham chiếu, lòng mạch và mảng xơ vữa so với chiều dài. Hình thái học định tính (tức là thành phần, phân tách, v.vỏ) cũng phải được báo cáo. Vai trò tiềm năng của IVUS đối với phép đo liều xạ trị chưa được xác định và có thể phụ thuộc vào nguồn bức xạ.
2. KỸ THUẬT PHÂN TÍCH CHUYÊN SÂU
2.1. Tần số vô tuyến – Phân tán ngược
Phân tích dữ liệu thô tần số vô tuyến (RF) là một kỹ thuật để đánh giá các đặc tỉnh của mô. Trong số các tham số phân tích khác nhau, đường bao của tín hiệu RF được sử dụng phổ biến nhất để trình chiếu hình ảnh thông thường. Khi tín hiệu phản xạ siêu âm được phân tích các thành phần tần số sẽ cho kết quả một phổ công suất. Phổ này đại diện cho độ lớn của tất cả các tần số trong tín hiệu trả về. Các nghiên cứu in vitro gợi ý rằng phân tích chi tiết dữ liệu RF tán xạ ngược có thể cung cấp một phương pháp khách quan và có thể tái tạo để phân loại hình thái thành mạch và các thành phần mảng xơ vữa. Phân tích quang phổ dữ liệu chưa xử lý thì vẫn chưa chắn chắn có đáng tin cậy và liệu có không bị ảnh hưởng bởi các nguồn lỗi khác nhau trong quá trình chụp ảnh in vivo hay không (phụ thuộc góc, nhiễu máu), và nó nên được coi là một công cụ nghiên cứu. 2.2. Tự động phát hiện cạnh
Mục tiêu chính của phát hiện cạnh tự động trong hình ảnh IVUS là trích xuất thông tin bề mặt cấu trúc có liên quan như đường viền mạch nội mạc và/hoặc đường viền trung mạc-ngoại mạc. Quá trình này bao gồm nâng cao chất lượng hình ảnh và phân đoạn (tách hình ảnh thành các phần cấu thành của nó). Mức độ xám của một điểm ảnh không có đủ thông tin để gán điểm ảnh đỏ cho một cấu trúc. Do đó, cần phải phân tích sự phân bố không gian của nhiều mức xám (nhiều điểm ảnh và ảnh con) để phát hiện cạnh, nhưng không có phương pháp nào được chấp nhận rộng rãi. Phát hiện cạnh và phân tích kết cấu nên được coi là công cụ nghiên cứu và cần xác nhận trực quan.
TÀI LIỆU THAM KHẢO
1. Bom N. Lancee CT, Van Egmond FC. An ultrasonic intracardiac scanner. Ultrasonics 1972;10:72-6.
2. Yock PG, Linker DT, Angelsen BA. Two-dimensional intravascular ultrasound: technical development and initial clinical experience. J Am Soc Echocardiogr 1989:2:296-304.
3. Hodgson JM, Graham SP, Savakus AD, et al. Clinical percutaneous imaging of coronary anatomy using an over-the-wire ultrasound catheter system. Int J Card Imaging 1989,4:187-93
4. TobisJM,MalleryJ,MahonD,etal. Intravascularultrasoundimaging of human coronary arteries in vivo. Analysis of tissue characterizations with comparison to in vitro histological specimens. Circulation 1991; 83:913-26.
5. Nissen SE, Gurley JC, Grines CL, et al. Intravascular ultrasound assessment of lumen size and wall morphology in normal subjects and patients with coronary artery disease. Circulation 1991;84:1087-99.
6. Di Mario C, Gorge G, Peters R, et al. Clinical application and image interpretation in intracoronary ultrasound. Study Group on Intracoro- nary Imaging of the Working Group of Coronary Circulation and of the Subgroup on Intravascular Ultrasound of the Working Group of Echocardiography of the European Society of Cardiology. Eur Heart J 1998;19:207-29.
7. ten Hoff H, Korbijn A, Smith TH, Klinkhamer JF, Bom N. Imaging artifacts in mechanically driven ultrasound catheters. Int J Card Imaging 1989:4:195-9.
8. Di Mario C, Madretsma S, Linker D, et al. The angle of incidence of the ultrasonic beam: a critical factor for the image quality in intravas- cular ultrasonography. Am Heart J 1993;125:442-8.
9. Gil R, von Birgelen C, Prati F, Di Mario C, Ligthart J, Serruys PW. Usefulness of three dimensional reconstruction for interpretation and quantitative analysis of intracoronary ultrasound during stent deploy- ment. Am J Cardiol 1996;77:761-4.
10. Bruining N, von Birgelen C, Di Mario C, et al. Dynamic Three- Dimensional Reconstruction of ICUS Images Based on an ECG- Gated Pull-Back Device. In: Computers in Cardiology. Los Alamitos, CA: Institute of Electrical and Electronics Engineers Computer Society, 2000:633-6.
11. Dhawale PJ, Griffin N, Wilson DL, Hodgson JM. Calibrated 3-D Reconstruction of Intracoronary Ultrasound Images With Cardiac Gating and Catheter Motion Compensation. In: Computers in Car- diology. Washington, DC: Institute of Electrical and Electronics Engineers Computer Society, 1992:31-4.
12. Evans JL, Ng KH, Wiet SG, et al. Accurate three-dimensional reconstruction of intravascular ultrasound data. Spatially correct three- dimensional reconstructions. Circulation 1996;93:567-76.
13. Rosenfield K, Losordo DW, Ramaswamy K, et al. Three-dimensional reconstruction of human coronary and peripheral arteries from images recorded during two-dimensional intravascular ultrasound examination (see comments). Circulation 1991;84:1938-56.
14. St Goar FG, Pinto FJ, Alderman EL, Fitzgerald PJ, Stadius ML, Popp RL. Intravascular ultrasound imaging of angiographically normal coronary arteries: an in vivo comparison with quantitative angiography. J Am Coll Cardiol 1991;18:952-8.
15. Maheswaran B, Leung CY, Gutfinger DE, et al. Intravascular ultrasound appearance of normal and mildly diseased coronary arteries: correlation with histologic specimens. Am Heart J 1995;130:976-86. 16. Hermiller JB, Buller CE, Tenaglia AN, et al. Unrecognized left main coronary artery disease in patients undergoing interventional procedures. Am J Cardiol 1993;71:173-6.