ECMO là gì? Chỉ định ECMO như thế nào?
Oxy hóa máu qua màng ngoài cơ thể (Extracorporeal membrane oxygenation – ECMO) là hệ thống hỗ trợ tim phổi cơ học kéo dài, một cải tiến của hệ thống tim phổi nhân tạo trong phẫu thuật tim hở. Sự khác biệt cơ bản giữa ECMO với các thiết bị khác là không cần thiết phải có chức năng phổi đầy đủ để hỗ trợ tuần hoàn hiệu quả, với khả năng hỗ trợ sự sống ngoài cơ thể (ECLS)
OXY HÓA MÁU MÀNG NGOÀI CƠ THỂ (ECMO)
1. Giới thiệu thiết bị
Oxy hóa máu qua màng ngoài cơ thể (Extracorporeal membrane oxygenation – ECMO) là hệ thống hỗ trợ tim phổi cơ học kéo dài, một cải tiến của hệ thống tim phổi nhân tạo trong phẫu thuật tim hở. Sự khác biệt cơ bản giữa ECMO với các thiết bị khác là không cần thiết phải có chức năng phổi đầy đủ để hỗ trợ tuần hoàn hiệu quả, với khả năng hỗ trợ sự sống ngoài cơ thể (ECLS), ECMO thường được sử dụng trong các trường hợp suy tim – phổi trơ, nhằm mục đích điều trị căn nguyên bằng các biện pháp khác. Bên cạnh giá trị của nó trong điều trị suy hô hấp cấp hoặc suy tim cấp đe dọa sinh mạng, vai trò của ECMO trong tim mạch can thiệp ngày càng được được mở rộng với can thiệp động mạch vành qua da (PCI) nguy cơ cao, đặc biệt khi liên quan đến biến chứng sốc tim cấp tính. Trong phần này, chúng tôi tập trung phân tích ảnh hưởng của ECMO lên sinh lý tim mạch, vai trò của nó trong hồi sức tim mạch, từ đó thấy được ý nghĩa của ECMO trong tim mạch can thiệp.
2. Mô tả về thiết bị
a. Cấu tạo và nguyên lý hoạt động
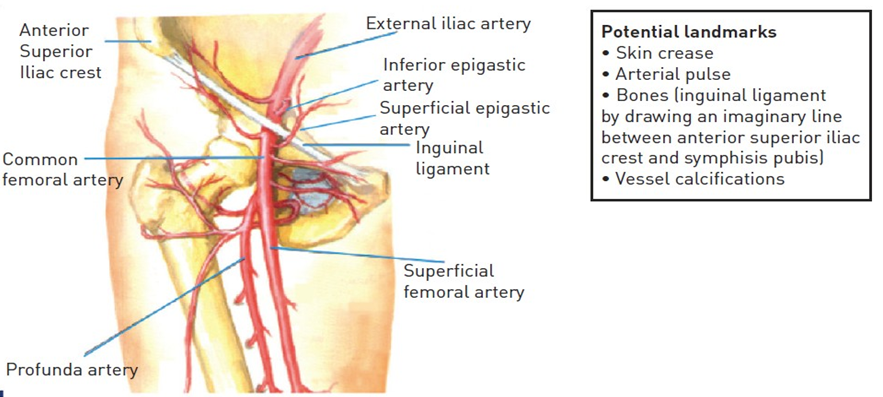
Hệ thống tuần hoàn ECMO về cơ bản bao gồm: Các ống thông đường vào mạch máu, màng trao đổi oxy, hệ thống bơm máu và bộ trao đổi nhiệt (Hình 64.8).

Hình 64.8. Mô tả đơn giản hệ thống oxy hóa máu màng ngoài cơ thể với cấu hình ECMO tĩnh – động mạch.
Chú thích: ĐM: Động mạch; TM: Tĩnh mạch.
Khi chạy ECMO, máu được rút ra khỏi cơ thể, bơm qua một màng gọi là màng trao đổi oxy, sau đó trở về tuần hoàn cơ thể. Máu được tiếp xúc với khí lưu thông có một nồng độ phân suất oxy đặt sẵn. Điều này đã tạo ra sự chênh lệch áp suất riêng phần giữa khí lưu thông và máu, làm cho O2 đi vào và CO2 đi ra, màng trao đổi oxy hiện đại được cấu tạo bởi hàng ngàn các sợi rỗng cho phép hồng cầu đi vào để tiếp xúc gần với khí lưu thông (Hình 64.9)

Hình 64.9. Màng trao đổi oxy (Oxygenator)
Cho thấy sự di chuyển của khí lưu thông và máu theo hai hướng ngược nhau. Cấu trúc sợi rỗng tinh xảo cho phép hồng cầu tiếp xúc gần với khí lưu thông.
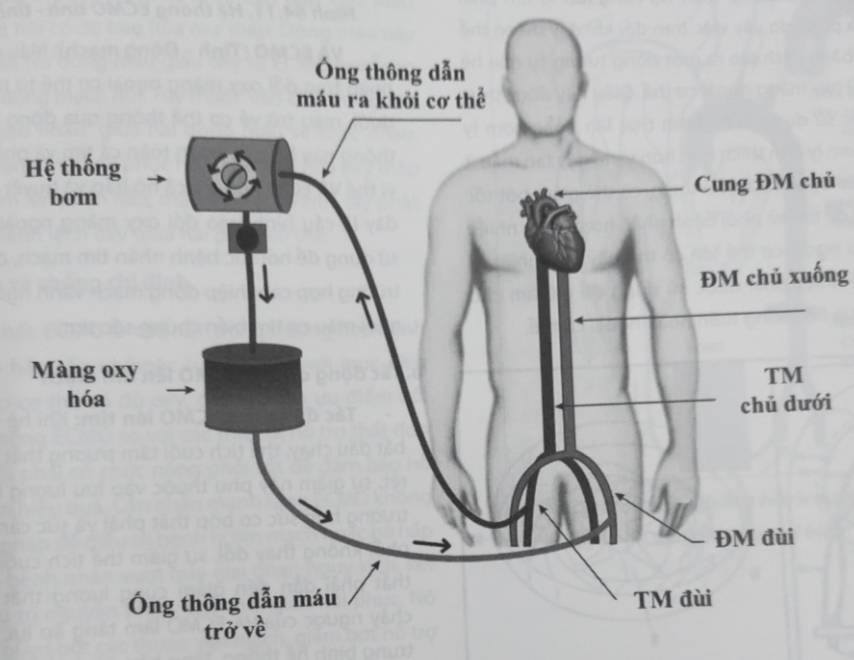
Trong cơ thể bình thường, toàn bộ cung lượng tim phải được đẩy qua phổi, do vậy việc trao đổi khí đầy đủ có thể đạt được chỉ bằng cách tạo ra một dòng tương tự qua hệ thống trao đổi oxy màng ngoài cơ thể. Điều này được thực hiện bằng việc sử dụng hoặc bơm trục lăn hoặc bơm ly tâm, mặc dù bơm ly tâm thích hợp hơn vì nó gây tan máu ít (Hình 64.10). Khi bệnh nhân cải thiện, có thể giảm bớt tốc độ dòng ECMO để tim và phổi bệnh nhân hoạt động nhiều hơn. Dòng máu ngoài cơ thể lớn có thể gây mất nhiệt, vì vậy bộ trao đổi nhiệt phải được sử dụng để giữ ấm cho máu khi nó đi qua hệ thống tuần hoàn ngoài cơ thể.
Hình 64.10. Hệ thống bơm ly tâm và bơm trục lăn
ECMO bao gồm 2 loại chính là V-V ECMO (Tĩnh – Tĩnh mạch) và V-A ECMO (Tĩnh – Động mạch):
- VV ECMO (Tĩnh – Tĩnh mạch): Máu thường đi vào hệ tuần hoàn trao đổi oxy màng ngoài cơ thể qua một ống thông lớn được đặt qua da vào tĩnh mạch đùi và đi lên tĩnh mạch chủ dưới. Máu trở về tĩnh mạch chủ trên qua một ống thông luồn vào tĩnh mạch cảnh trong phải. Như vậy trong VV ECMO, hệ thống trao đổi khí ở phổi đã bị bỏ qua, do vậy đây là hệ thống được sử dụng trong trường hợp suy hô hấp nặng đơn thuần (ARDS…)
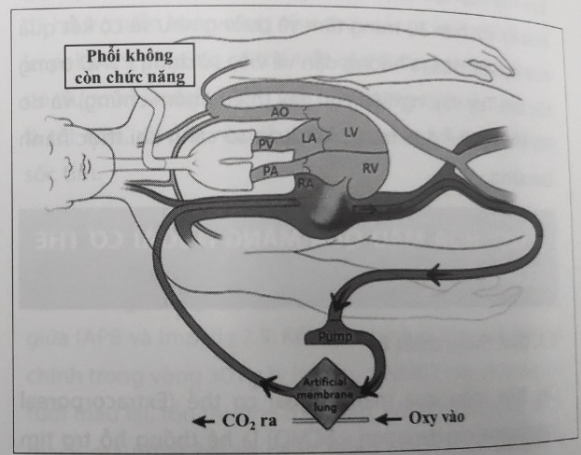
Hình 64.11. Hệ thống ECMO tĩnh – tĩnh mạch.
- VA ECMO (Tĩnh – Động mạch): Máu đi vào hệ tuần hoàn trao đổi oxy màng ngoài cơ thể từ tĩnh mạch chủ dưới, máu trở về cơ thể thông qua động mạch đùi. Hệ thống này bỏ qua hoàn toàn cả tim và phổi bệnh nhân, vì thế VA ECMO hỗ trợ cả hô hấp và huyết động. Do vậy đây là cấu hình trao đổi oxy màng ngoài cơ thể được sử dụng để hồi sức bệnh nhân tim mạch, đặc biệt trong trường hợp can thiệp động mạch vành nguy cơ cao như nhồi máu cơ tim biến chứng sốc tim.
b. Tác động của VA ECMO lên tim mạch
- Tác động của ECMO lên tim: Khi hệ thống ECMO bắt đầu chạy, thể tích cuối tâm trương thất phải giảm rõ rệt, sự giảm này phụ thuộc vào lưu lượng ECMO, trong trường hợp sức co bóp thất phải và sức cản động mạch phổi không thay đổi, sự giảm thể tích cuối tâm trương thất phải dẫn đến giảm cung lượng thất phải. Dòng chảy ngược của VA ECMO làm tăng áp lực động mạch trung bình hệ thống, tăng hậu gánh thất trái; trong khi tiền gánh thất trái giảm đi, bởi vậy, cung lượng tim trái giảm đi.
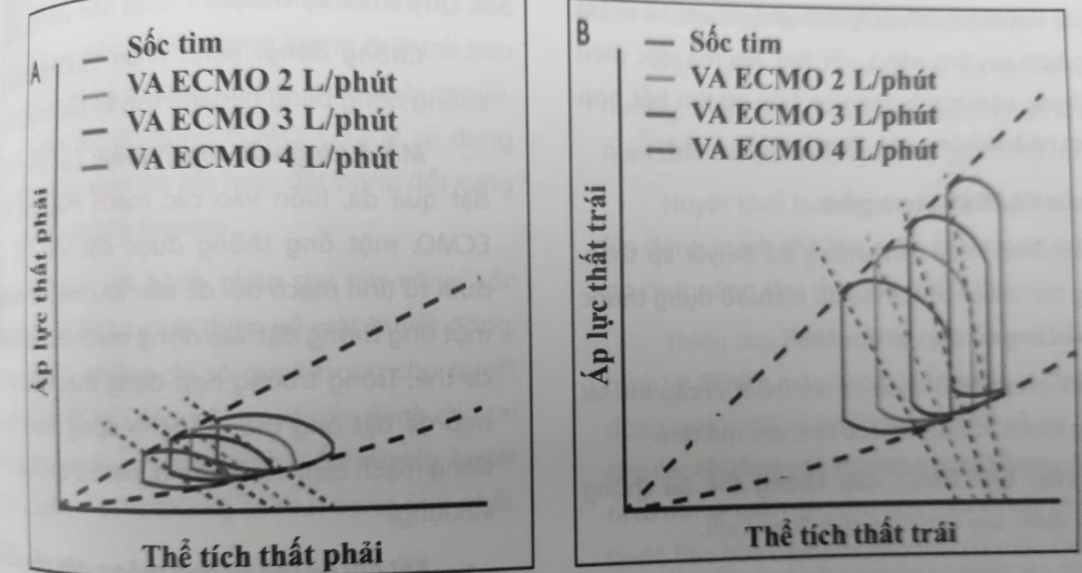
Hình 64.12. Đường cong Thể tích – Áp lực mô tả huyết động hai thất khi được hỗ trợ ECMO.
Hình A: Tác động VA ECMO lên thất phải, với sự giảm thể tích cuối tâm trương và giảm thể tích nhát bóp phụ thuộc vào lưu lượng ECMO, với sức co bóp thất phải và áp lực ĐM phổi không thay đổi. Hình B: Tác động VA ECMO lên thất trái, với thể tích nhát bóp giảm khi lưu lượng ECMO tăng lên.
- Hội chứng Harlequin: Là sự chênh lệch bão hòa oxy giữa phần trên (mạch vành, não, tay phải) và phần dưới cơ thể khi thực hiện VA ECMO ngoại biên. Điều này xảy ra khi chức năng tim phục hồi trong khi khả năng oxy hóa máu ở phổi vẫn còn kém, dẫn đến việc máu bơm từ thất trái có độ bão hòa oxy thấp. Dòng máu này sẽ gây ra cản trở dòng máu giàu oxy từ ECMO bơm vào cơ thể qua động mạch đùi. Tùy thuộc vào chức năng tim mà vị trí “giao nhau” giữa hai dòng máu sẽ khác nhau. Nếu chức năng thất trái phục hồi, máu bão hòa oxy thấp sẽ được bơm lên phần đầu, mặt cổ, mạch vành, tay phải; tạo ra sự chênh lệch oxy giữa hai phần cơ thể.
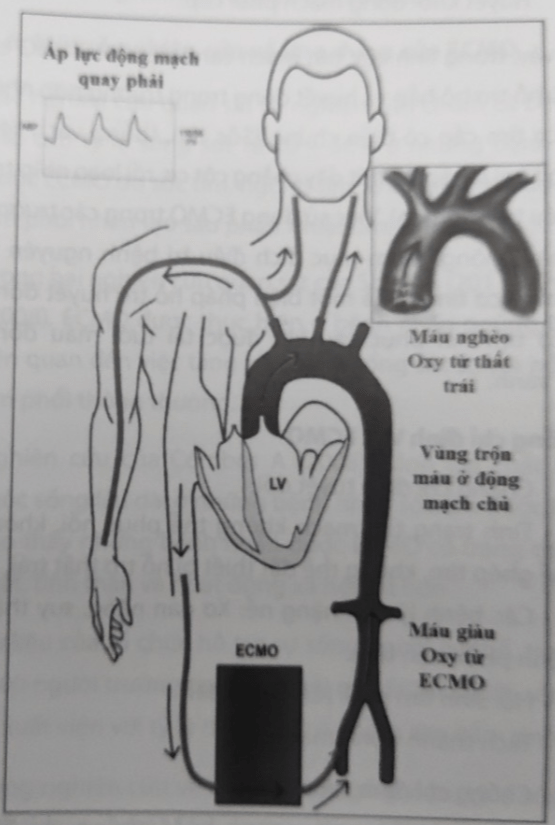
Hình 64.13. Mô tả hội chứng Harlequin trong quá trình VA ECMO ngoại biên
3. Chỉ định và chống chỉ định
Về mặt bản chất, ECMO là “cầu nối” trong trường hợp bệnh nhân suy hô hấp cấp và/hoặc suy tim cấp với mục đích đảm bảo cho cơ thể có đủ oxy, đây cũng là ưu điểm nổi bật của hệ thống ECMO so với các thiết bị hỗ trợ thất đơn thuần đòi hỏi phải có chức năng phổi tốt để đảm bảo hỗ trợ tuần hoàn hiệu quả. Cần nhấn mạnh rằng ECMO không phải là biện pháp để điều trị bệnh lý tim mạch hoặc hô hấp mà chỉ giúp bệnh nhân vượt qua giai đoạn nguy kịch, kết hợp với điều trị nguyên nhân, chờ thời gian hồi phục. Nó có thể giúp giảm bớt các thuốc vận mạch, giảm bớt hỗ trợ máy thở, giảm nguy cơ tổn thương phổi do thở máy.
Trong cấp cứu tim mạch, VA ECMO thường được sử dụng trong trường hợp suy tim nặng, sốc tim, khi mà việc điều trị sử dụng thuốc vận mạch, tăng co bóp cơ tim hết hợp thông khí xâm nhập không còn đem lại hiệu quả.
a. Chỉ định của VA ECMO bao gồm
- Sốc tim: Tưới máu mô không đủ (huyết áp thấp, cung lượng tim thấp) dù đã bù đủ dịch, sử dụng thuốc vận mạch và tăng co bóp cơ tim,
- Chờ hồi phục: Nhồi máu cơ tim (NMCT) cấp sau tái thông động mạch vành, viêm cơ tim, sau mổ tim.
- Chờ ghép tim: NMCT cấp không thể tái thông động mạch vành, suy tim mạn giai đoạn cuối.
- Chờ đặt các thiết bị hỗ trợ tuần hoàn lâu dài.
- Ngưng tuần hoàn thất bại với điều trị chuẩn (CPR) sau 5 – 30 phút.
- Sốc nhiễm trùng có giảm sức co bóp cơ nặng.
- Huyết khối động mạch phổi cấp.
Như vậy, trong lĩnh vực tim mạch can thiệp, VA ECMO có vai trò hỗ trợ hô hấp và huyết động trong trường hợp nhồi máu cơ tim cấp có biến chứng (Sốc tim, thủng vách liên thất, hở hai lá cấp do đứt dây chằng cột cơ, rối loạn nhịp trơ với điều trị nội khoa). Việc sử dụng ECMO trong các trường hợp này không nhằm mục đích điều trị bệnh nguyên là nhồi máu cơ tim mà là một biện pháp hỗ trợ huyết động cho cơ tim hồi phục sau khi được tái tưới máu động mạch vành.
b. Chống chỉ định V-A ECMO
- Chống chỉ định tuyệt đối:
- Tình trạng tim mạch không thể phục hồi, không thể ghép tim, không thể đặt thiết bị hỗ trợ thất trái.
- Các bệnh lý nền nặng nề: Xơ gan nặng, suy thận, bệnh phổi mạn tính.
- Hồi sinh tim phổi (CPR) kéo dài.
- Tách thành động mạch chủ.
- Chống chỉ định tương đối:
- Rối loạn đông máu nặng hoặc chống chỉ định dùng chống đông.
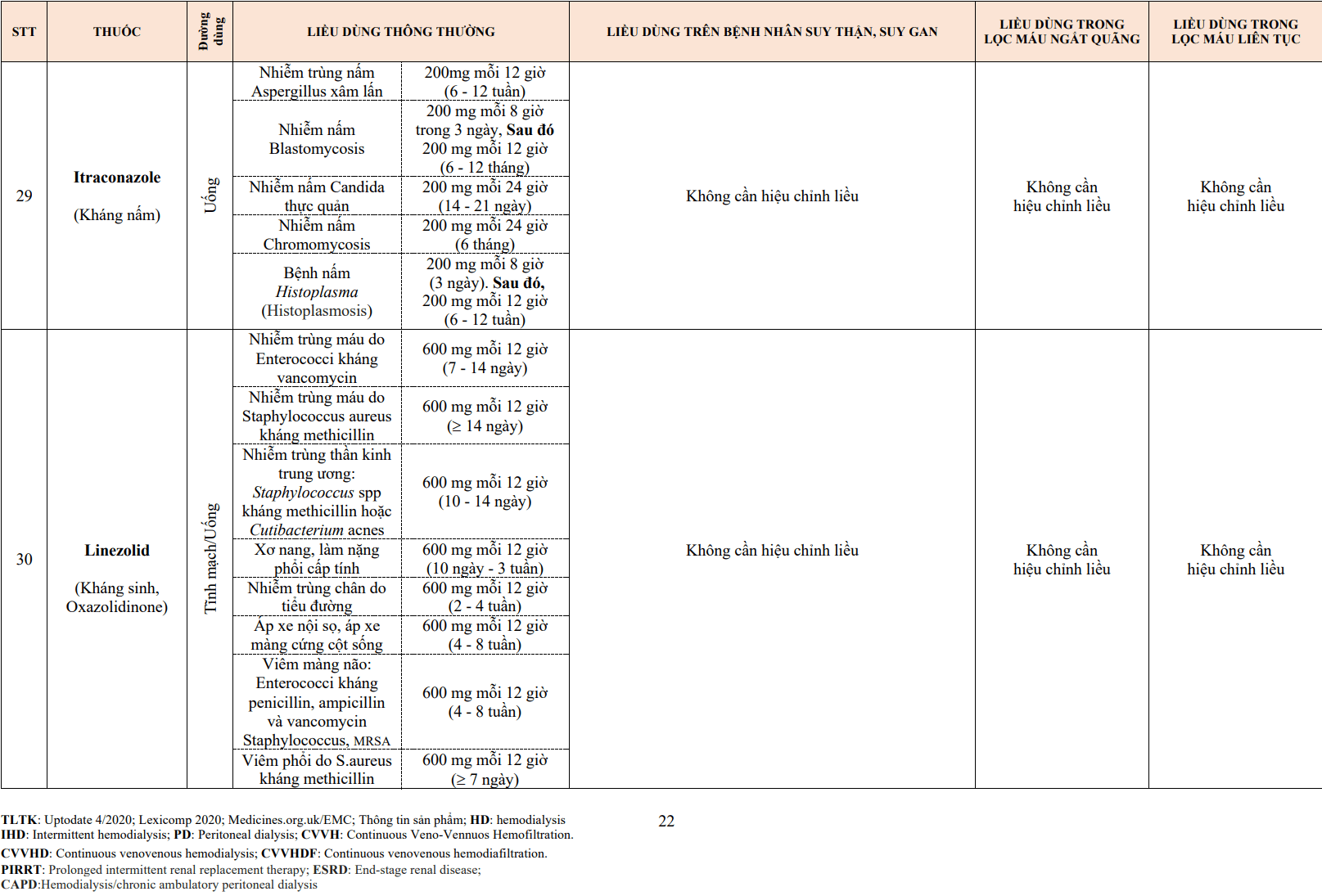
- Đường vào mạch máu khó khăn: Bệnh động mạch ngoại biên, cắt cụt chi dưới.
4. Quy trình kỹ thuật
- Chống đông: Bệnh nhân thường được sử dụng chống đông bằng heparin truyền tĩnh mạch liên tục.
- Mở đường vào mạch máu: Các ống thông được đặt qua da, luồn vào các mạch máu lớn. Đối với VA ECMO, một ống thông được đặt vào tĩnh mạch chủ dưới từ tĩnh mạch đùi để dẫn lưu máu ra khỏi cơ thể và một ống thông đặt vào động mạch đùi để đưa máu vào cơ thể. Trong trường hợp động mạch đùi không thích hợp để đặt ống thông (bệnh động mạch ngoại biên), động mạch cảnh hoặc động mạch dưới đòn có thể được sử dụng.
- Kết nối hệ thống ống thông, dây dẫn với hệ thống máy ECMO: Sau khi mở đường vào mạch máu thành công, bệnh nhân được kết nối thông qua hệ thống dây dẫn với máy ECMO, tốc độ dòng tăng lên cho đến khi các thông số về hô hấp và huyết động đạt yêu cầu:
- Độ bão hòa oxy máu động mạch > 90%.
- Sự tưới máu mô đầy đủ: Độ bão hòa oxy tĩnh mạch, mức lactat máu.
- Theo dõi: Theo dõi các thông số về hô hấp và huyết động để điều chỉnh kịp thời, bên cạnh đó cần chú ý đông máu được đảm bảo trong thời gian ECMO bằng cách truyền liên tục heparin không phân đoạn, tiểu cầu duy trì lớn hơn 50 G/L. Hệ thống ECMO là nguồn cung cấp oxy duy nhất, phụ thuộc vào nồng độ Hemoglobin và tốc độ dòng, do đó Hb được duy trì trên 12 g/dL ở bệnh nhân Máy thở nên được giảm bớt mức hộ hỗ trợ trong thời gian ECMO để tránh chấn thương phổi do áp lực và ngộ độc oxy, áp lực đường thở nên dưới 20 mmHg và FiO2 dưới 50%, giảm hỗ trợ máy thở làm tăng lượng máu trở về, cải thiện cung lượng tim.
- Một số lưu ý đặc biệt
- Tốc độ dòng: Trong VA ECMO, tốc độ dòng đủ cao để cung cấp đủ áp lực tưới máu và độ bão hòa oxy, nhưng cũng đủ thấp để tránh giảm tiền gánh, làm suy giảm cung lượng thất trái.
- Bài niệu: Đa số bệnh nhân quá tải dịch lúc bắt đầu ECMO, bài niệu tích cực nên được sử dụng sau khi bệnh nhân ổn định với Siêu lọc có thể sử dụng nếu mức độ bài niệu của bệnh nhân không đủ.
- Cung lượng thất trái: Cung lượng thất trái phải được theo dõi sát trong quá trình ECMO vì nó có thể xấu đi. Có nhiều yếu tố ảnh hưởng đến cung lượng thất trái: Suy chức năng tâm thu thất trái do nhồi máu cơ tim, viêm cơ tim; tiền gánh thất trái không đầy đủ. Các biện pháp hỗ trợ để cải thiện cung lượng thất trái bao gồm các thuốc tăng co bóp cơ tim như Dobutamin, Milrinone; giảm tốc độ dòng ECMO. Có thể sử dụng một số biện pháp xâm lấn kết hợp: đặt bóng đối xung động mạch chủ (IABP); Impella…
- Cai ECMO: Đối với bệnh nhân suy tim nặng, sốc tim sử dụng VA ECMO, sự cải thiện về mặt huyết động, cung lượng tim là những chỉ số quan trọng cho quyết định dừng hỗ trợ ECMO. Một số tiêu chuẩn dành cho cai VA ECMO gồm: Huyết áp trung bình > 70 mmHg, lactat < 2 mmol/L, SpO2 > 95%, không có tình trạng phù phổi, EF > 25%.
5. Biến chứng
- Thiếu máu chi: 20 – 30% các trường hợp. Yếu tố thuận lợi: Sử dụng ống thông lớn, bệnh nhân có bệnh động mạch ngoại biên, huyết động giảm, vận mạch liều cao, tổn thương mạch máu do đặt ống thông.
- Rối loạn đông máu: Giảm tiểu cầu, giảm tiểu cầu liên quan heparin, đông máu nội mạc rải rác.
- Chảy máu: Gặp 30 – 50% bệnh nhân ECMO và có thể đe dọa tính mạng, do duy trì chống đông, rối loạn chức năng tiểu cầu.
- Tan máu: 5 – 18%, tan máu nặng 9%. Yếu tố tạo thuận: cấp cứu ngừng tuần hoàn, tăng đông, nhiễm khuẩn, tốc độ dòng ECMO.
- Biến chứng thần kinh trung ương: 13,3% bệnh nhân, bao gồm thiếu máu và xuất huyết. Yếu tố tạo thuận: Thời gian chạy ECMO kéo dài, suy thận, mất cân bằng đông máu, huyết khối trong ống thông, oxy liều cao kéo dài.
- Nhiễm trùng vị trí đặt ống thông: nhiễm khuẩn huyết 3 – 18%. Thường gặp ở bệnh nhân thời gian hỗ trợ ECMO kéo dài, VA ECMO trung tâm, tuổi cao, bệnh tự miễn…
- Tắc mạch khí: ECMO có thể có biến chứng tắc mạch khí, nó có thể là hậu quả của việc mồi hệ thống tuần hoàn ngoài cơ thể không đúng, hình thành các bong bóng nhỏ trong hệ thống tuần hoàn ngoài cơ thể.
Một số biến chứng riêng của VA ECMO:
- Phù phổi cấp: Xảy ra khi áp lực nhĩ trái trên 25 mmHg, thường gặp ở những bệnh nhân khả năng tống máu thất trái giảm nặng trong quá trình hỗ trợ ECMO.
- Huyết khối buồng tim: Do dòng máu phụt ngược lên động mạch chủ lên, máu ứ lại trong buồng thất trái do chức năng tâm thu thất trái giảm.
- Thiếu oxy mạch vành hoặc mạch não: Trong quá trình VA ECMO, máu bão hòa hoàn toàn được truyền vào động mạch đùi từ hệ thống ECMO sẽ ưu tiên tưới máu cho các chi dưới và các tạng trong ổ bụng. Máu được đẩy ra từ tim sẽ tưới máu cho tim, não và các chi trên. Kết quả là, độ bão hòa oxyhemoglobin của máu chi dưới và tạng ổ bụng có thể cao hơn đáng kể so với máu tưới cho tim, não và chi trên. Tình trạng thiếu oxy ở tim và não có thể tồn tại và không được phát hiện nếu chỉ theo dõi ở chi dưới. Để tránh biến chứng này, cần theo dõi độ bão hòa oxyhemoglobin động mạch ở tay phải.
6. Một số nghiên cứu về ứng dụng của ECMO
Các nghiên cứu quan sát và nghiên cứu chùm ca bệnh đã báo cáo tỷ lệ sống sót từ 20 – 50% ở những bệnh nhân được ECMO do sốc tim, ngừng tim, không dừng được máy tim phổi nhân tạo sau phẫu thuật tim.
Trong hai nghiên cứu quan sát của Shin TG (2011), Chen YS (2008), ECMO được thực hiện ở bệnh nhân ngừng tim có liên quan đến việc tăng khả năng sống sót so với hồi sinh tim phổi thông thường.
Nghiên cứu của Combes A (2008) đánh giá chất lượng cuộc sống lâu dài ở những bệnh nhân sốc tim được ECMO cho thấy những bệnh nhân được ECMO có trạng thái thể chất, tinh thần và hoạt động xã hội tốt hơn.
Dữ liệu của tổ chức hỗ trợ sự sống ngoài cơ thể, trong số 9000 người trưởng thành đã trải qua ECMO, 41% sống sót và xuất viện với tỷ lệ thấp nhất ở nhóm tim bẩm sinh.
Trong nghiên cứu về ngừng tim ngoại viện, tỷ lệ sống sót là 22% trong số 833 bệnh nhân được ECMO, một nửa trong số này có chức năng thần kinh tốt.
TÀI LIỆU THAM KHẢO
- Baim DS, Grossman Cardiac catheterization, angiography and intervention. Baltimore: Williams and Wilkins; 2000.
- Antman EM, Anbe DT, Armstrong PW, et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction—executive A report of the American College of Cardiology/American Heart Association Task Force on Practice Guide- lines. J Am Coll Cardiol. 2004;44:671.
- Ferguson JJ, Cohen M, Freedman RJ, et al. The current practice of intra-aortic balloon counterpulsation: results from the Benchmark registry. J Am Coll Cardiol. 2001;38:1456
- Thiele H, Smalling RW, Schuler GC. Percutaneous left ventricular assist devices in acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 2007;28(17):2057-2063. doi:10.1093/ eurheartj/ehm191
- Naidu SS. Novel Percutaneous Cardiac Assist Devices. Circulation. 2011;123(5):533-543. doi:10.1161/CIRCULATIONAHA.110.945055
- 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in CardiovascularCare: Endorsed by the American Heart Association, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention – Accessed July 11, 2021.
- Percutaneous left ventricular assist device with TandemHeart for high‐risk percutaneous coronary intervention: The Mayo Clinic experience – Alli – 2012 -Catheterization and Cardiovascular Interventions – Wiley Online Library. Accessed July 11,
- Vranckx P, Meliga E, De Jaegere PPT, Van den Ent M, Regar ES, Serruys The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. EuroIntervention. 2008;4(3):331-337. doi:10.4244/ eijv4i3a60
- Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock | European Heart Journal | Oxford Academic. Accessed July 11, 2021. https:// academic.oup.com/eurheartj/article /26/13/1276/565581.
- Burkhoff D, Cohen H, Brunckhorst C, O’Neill A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 2006;152(3):469.e1-469.e8. doi:10.1016/j.ahj. 2006.05.031
- Seyfarth M, Sibbing D, Bauer I, et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 2008;52(19):1584-1588. doi:10.1016/j.jacc.2008.05.065
- Cheng JM, den Uil CA, Hoeks SE, et al. Percutaneous left ventricular assist devices vs. intra-aortic balloon pump counterpulsation for treatment of cardiogenic shock: a meta-analysis of controlled trials. European Heart Journal. 2009;30(17):2102-2108. doi:10.1093/ eurheartj/ehp292
- The Impella 2.5 and 5.0 devices for ST-elevation myocardial… : Critical CareMedicine. Accessed July 12, 2021. https://journals.lww.com/ ccmjournal/Abstract/2011/09000/The_Impella_2_5_and_5_0_devices_for_ST_elevation. aspx
- Lemaire A, Anderson MB, Lee LY, et al. The Impella Device for Acute Mechanical Circulatory Support in Patients in Cardiogenic Shock. The Annals of Thoracic 2014;97(1):133-138. doi:10.1016/ j.athoracsur.2013.07. 053
- Real‐world use of the Impella 2.5 circulatory support system in complex high risk percutaneous coronary intervention: The USpella Registry – Maini – 2012 -Catheterization and Cardiovascular Interventions – Wiley Online Library. Accessed July 12, 2021. https://onlinelibrary.wiley.com/doi/10.1002/ccd.23403
- Vetrovec GW, Anderson M, Schreiber T, et al. The cVAD registry for percutaneous temporary hemodynamic support: A prospective registry of Impella mechanical circulatory support use in high-risk PCI, cardiogenic shock, and decompensated heart failure. American Heart Journal. 2018;199:115-121. doi:10.1016/j.ahj.2017.09.007
- Percutaneous Left-Ventricular Support With the Impella-2.5–Assist Device in Acute Cardiogenic Shock | Circulation: Heart Failure. Accessed July 12, 2021. https://www.ahajournals.org/doi/10.1161/CIRCHEARTFAILURE.112.967224 url_ver=Z39.882003&rfr_ id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
- Ouweneel DM, Schotborgh JV, Limpens J, et al. Extracorporeal life support during cardiac arrest and cardiogenic shock: a systematic review and meta-analysis. Intensive Care Med. 2016;42(12):1922-1934. doi:10.1007/s00134-016-4536-8
- Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of Use of an Intravascular Microaxial Left Ventricular Assist Device vs Intra-aortic Balloon Pump With In-Hospital Mortality and Major Bleeding Among Patients With Acute Myocardial Infarction Complicated by Cardiogenic Shock. JAMA. 2020;323(8):734. doi:10.1001/jama.2020.0254
- Sidebotham D, Mc George A, McGuinness S, et al. Extracorporeal membrane oxygenation for treating severe cardiac and respiratory disease in adults. Part 1: Overview of extracorporeal membrane oxygenation. J Cardiothorac Vasc Anesth 2009; 23:886-892
- Sidebotham D, Mc George A, McGuinness S, et al. Extracorporeal membrane oxygenation for treating severe cardiac and respiratory disease in Part 2: Technical considerations. J Cardiothorac Vasc Anesth 2009; 23:886-892
- Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure. Lancet 2009; 374: 1351-1363
- Shin TG, Choi JH, Jo IJ, et Extracorporeal cardiopulmonary resuscitation in patients with inhospital cardiac arrest: A comparison with conventional cardiopulmonary resuscitation. Crit Care Med 2011; 39:1.
- Chen YS, Lin JW, Yu HY, et al. Cardiopulmonary resuscitation with assisted extracorporeal life-support versus conventional cardiopulmonary resuscitation in adults with in-hospital cardiac arrest: an observational study and propensity analysis. Lancet 2008; 372:554.
- Ortega-Deballon I, Hornby L, Shemie SD, et al. Extracorporeal resuscitation for refractory out-of-hospital cardiac arrest in adults: A systematic review of international practices and outcomes. Resuscitation 2016; 101:12.
- Combes A, Leprince P, Luyt CE, et al. Outcomes and long-term quality-of-life of patients supported by extracorporeal membrane oxygenation for refractory cardiogenic shock. Crit Care Med 2008; 36:1404.
- Thiagarajan RR, Barbaro RP, Rycus PT, et al. Extracorporeal Life Support Organization Registry International Report 2016. ASAIO J 2017; 63:60.
- Divaka P, Rodney S, Tim L, et al. Long-term mortality data from the balloon pump-assisted coronary intervention study (BCIS-1): a randomized, controlled trial of elective balloon counterpulsation during high-risk percutaneous coronary intervention. Circulation. 2013 Jan 15;127(2):207-12.
- Divaka P, Rodney S, Martyn T, et al. Elective Intra-aortic Balloon Counterpulsation During High-Risk Percutaneous Coronary Intervention A Randomized Controlled Trial. JAMA. 2010;304(8):867-874.
- Holger T, Uwe Z, et Intraaortic Balloon Support for Myocardial Infarction with Cardiogenic Shock. N Engl J Med 2012; 367:1287-1296
- Manesh R, Richard W, Holder T, et al. Intra-aortic Balloon Counterpulsation and Infarct Size in Patients With Acute Anterior Myocardial Infarction Without ShockThe CRISP AMI Randomized JAMA. 2011;306(12):1329-1337.
- Santa-Cruz RA, Cohen MG, Ohman EM. Aortic counterpulsation: a review of the hemodynamic effects and indications for use. Catheter Cardiovasc Interv 2006; 67:68.
- Barnett MG, Swartz MT, Peterson GJ, et Vascular complications from intraaortic balloons: risk analysis. J Vasc Surg 1994; 19:81.
- Patrick TO, Frederick GK, Deborah DA, et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. Journal of the American College of Vol. 61, No.4, 2013