Can thiệp động mạch chủ ngực
1. TỔNG QUAN
Can thiệp nội mạch động mạch chủ ngực (Thoracic Endovascular Aortic Repair – viết tắt TEVAR) là một phương pháp ít xâm lấn gồm đặt hệ thống Stent có màng bọc (Stent graft) lót bên trong lòng động mạch chủ (ĐMC) ngực để điều trị nhiều loại bệnh lý tổn thương động mạch chủ ngực như phình ĐMC ngực đoạn xuống, tách thành ĐMC type B, chấn thương ĐMC, tụ máu trong thành ĐMC, loét xuyên thành ĐMC… TEVAR là kỹ thuật ít xâm lấn ít biến chứng, nguy cơ tử vong thấp so với phẫu thuật ĐMC ngực.
2. GIẢI PHẪU VÀ BỆNH LÝ ĐỘNG MẠCH CHỦ
Đường kính ĐMC ngực “bình thường” thay đổi tùy theo các đoạn và phụ thuộc theo tuổi, giới tính, thể trạng.
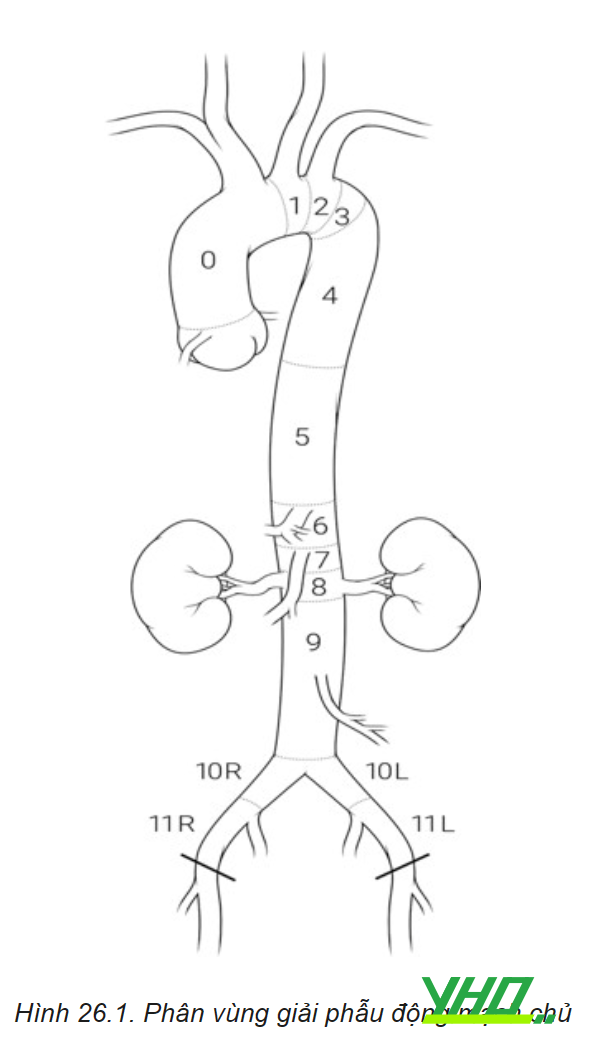
ĐMC bắt đầu từ ngay trên van ĐMC và đi lên trên, sau đó uốn cong tạo thành cung động mạch chủ và đi xuống dọc theo cột sống. ĐMC chia ra các nhánh cấp máu cho động mạch vành, thân cánh tay đầu (nhánh chia ra động mạch cảnh chung bên phải và động mạch dưới đòn phải), động mạch cảnh chung trái và động mạch dưới đòn trái. ĐMC ngực đi xuống cung cấp các nhánh động mạch gian sườn (T1-T12) và tiếp tục đi qua lỗ của cơ hoành để trở thành ĐMC bụng, nằm sau phúc mạc tiếp đến chỗ chia đôi thành động mạch chậu chung 2 bên ở ngang mức đốt sống thắt lưng thứ 4. Động mạch chủ ngực được chia thành 3 phần: ĐMC lên, Quai ĐMC, ĐMC xuống tuy nhiên ngày nay với sự phát triển của kỹ thuật can thiệp nội mạch người ta quan tâm đến vị trí che phủ có ảnh hưởng đến các nhánh bên của động mạch chủ do vậy giải phẫu ĐMC được chia ra thành các phân vùng giải phẫu cụ thể hơn.
Phân vùng giải phẫu (zone) – Hệ thống động mạch chủ được chia thành 11 vùng nhằm mục đích mô tả liên quan với các nhánh bên của hệ thống ĐMC:
- Vùng 0: Từ bắt đầu ĐMC lên đến sau động mạch thân cánh tay đầu.
- Vùng 1: Từ sau ĐM thân cánh tay đầu đến sau động mạch cảnh chung trái.
- Vùng 2: Từ sau ĐM cảnh chung trái đến sau động mạch dưới đòn trái.
- Vùng 3: 2 cm từ sau động mạch dưới đòn trái.
- Vùng 4: Từ 2cm sau động mạch dưới đòn trái nhưng nằm trong nửa gần của động mạch chủ ngực đi xuống (T6).
- Vùng 5: Bắt đầu ở nửa xa của động mạch chủ ngực đi xuống đến chỗ xuất phát động mạch thân tạng.
- Vùng 6: Từ bắt đầu động mạch thân tạng đến trước động mạch mạc treo tràng trên.
- Vùng 7: Từ động mạch mạc treo tràng trên đến trên động mạch thận trên.
- Vùng 8: Bao phủ ít nhất một động mạch thận.
- Vùng 9: Động mạch chủ đoạn dưới thận.
- Vùng 10: Động mạch chậu
- Vùng 11: Động mạch chậu ngoài.

Tưới máu tủy sống – Tủy sống được cung cấp bởi ba mạch chính bắt nguồn từ các động mạch đốt sống ở cổ, 1 động mạch cột sống trước và một cặp động mạch cột sống sau, nối liền nhau ở xa nón tủy. Động mạch tủy sống trước cung cấp cho 2/3 phía trước của tủy sống. Tủy sống ngực đặc biệt phụ thuộc vào sự đóng góp của nhánh xuyên của động mạch cột sống trước. Động mạch Adamkiewicz là động mạch có thể được tìm thấy giữa mức đốt sống ngực T9 đến T12 ở đa số người bình thường nhưng cũng có thể nằm trên hoặc dưới mức này.
3. CHỈ ĐỊNH VÀ CHỐNG CHỈ ĐỊNH CAN THIỆP ĐỘNG MẠCH CHỦ NGỰC
3.1. Chỉ định can thiệp ĐMC ngực
TEVAR ban đầu được sử dụng để điều trị cho những bệnh nhân bị phình ĐMC ngực không phù hợp với phẫu thuật mở. Các thử nghiệm quan trọng về việc đặt Stent graft để điều trị phình ĐMC ngực đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận vào năm 2005.
Can thiệp nội mạch động mạch chủ ngực ngày càng được sử dụng rộng rãi cho các bệnh lý ĐMC khác, bao gồm các tổn thương khác nhau như: tách thành ĐMC, loét xuyên thành ĐMC, tụ máu trong thành ĐMC, chấn thương ĐMC… Mặc dù không có thử nghiệm ngẫu nhiên nào so sánh trực tiếp giữa phẫu thuật với can thiệp nội mạch ĐMC ngực, các nghiên cứu quan sát cho thấy kết quả tương đương hoặc tốt hơn đối với bệnh nhân ở nhóm được tiến hành can thiệp nội mạch ĐMC ngực. Lợi ích của can thiệp nội mạch so với phẫu thuật mở bao gồm tránh được phẫu thuật mở lồng ngực, không cần kẹp ĐMC, ít mất máu hơn, giảm tỷ lệ thiếu máu tạng, phục hồi nhanh hơn.

a. Phình động mạch chủ ngực
Phình ĐMC đoạn xuống chỉ định can thiệp khi có triệu chứng như: vỡ, doạ vỡ, chèn ép tạng xung quanh, rò vào khí phế quản gây ho máu, rò vào thực quản gây xuất huyết tiêu hoá cao; hoặc những trường hợp phình ĐMC không có triệu chứng nhưng đường kính lớn > 55 mm hoặc tăng kích thước > 5 mm sau 6 tháng theo dõi.
b. Tách thành ĐMC
Điều trị tách thành ĐMC Stanford B có biến chứng: vỡ, doạ vỡ, thiếu máu tạng, đau tái phát, đau dai dẳng, tăng huyết áp khó khống chế; hoặc tách thành ĐMC Stanford B không có biến chứng nhưng có hình ảnh giải phẫu nguy cơ cao như: huyết khối bán phần ĐMC, ĐMC xuống đường kính > 40 mm, đường kính lòng giả > 22 mm, kích thước vết rách nguyên uỷ > 10 Cơ chế can thiệp nội mạch điều trị tách thành ĐMC là che phủ đường vào vết rách nguyên uỷ và làm mở rộng lòng thật động mạch chủ, tái tưới máu cho các tạng bị thiếu máu, giảm kích thước và huyết khối lòng giả từ đó giảm nguy cơ vỡ.
Trong nghiên cứu điều trị đa trung tâm can thiệp Stentgraft ở bệnh nhân tách thành ĐMC Standford B không biến chứng (thử nghiệm INSTEAD), điều trị nội khoa tối ưu được so sánh với việc can thiệp nội mạch đặt Stent graft. Tại thời điểm theo dõi sau một năm, không tìm thấy sự khác biệt đáng kể về tử vong do mọi nguyên nhân giữa hai nhóm. Tại thời điểm 5 năm, TEVAR giúp cải thiện tỷ lệ sống còn liên quan tới động mạch chủ và làm tăng quá trình tái cấu trúc ĐMC, vì vậy, làm chậm sự tiến triển của bệnh so với điều trị nội khoa đơn thuần. Nghiên cứu ADSORB, một thử nghiệm đang theo dõi ở châu Âu, sẽ so sánh điều trị nội khoa tối ưu với việc can thiệp đặt Stentgraft cho bệnh nhân bị tách thành ĐMC type B không biến chứng. Vì vậy, tách thành ĐMC type B không có biến chứng được chỉ định can thiệp ở nhóm có giải phẫu nguy cơ cao như: vết rách nguyên uỷ ĐMC >10 mm, đường kính lòng giả > 22 mm, đường kính ĐMC > 40 mm, huyết khối một phần lòng giả.
c. Tụ máu trong thành động mạch chủ/loét xuyên thành động mạch chủ
Những tổn thương này nằm trong bối cảnh hội chứng ĐMC cấp và điều trị can thiệp nội mạch tương tự như tách thành ĐMC Stanford B, bao gồm việc che phủ lót bên trong động mạch chủ đoạn tổn thương. Chỉ định can thiệp nội mạch khi tụ máu trong thành ĐMC/loét thành ĐMC có biến chứng vỡ, doạ vỡ, thiếu máu tạng.
d. Rò động mạch chủ – thực quản
Rò động mạch chủ – thực quản là tổn thương đe dọa tính mạng do xuất huyết tiêu hóa cao, có thể do nhiều nguyên nhân gây ra (bệnh lý ác tính, phình ĐMC ngực, dị vật bao gồm Stent graft động mạch chủ). TEVAR có thể được sử dụng như một biện pháp tạm thời để ngăn chặn vỡ động mạch chủ và cho phép hồi sức. Bệnh nhân có nguy cơ bị nhiễm trùng mảnh ghép Stent graft nếu không thực hiện điều trị dứt điểm tổn thương thực quản.
e. Chấn thương ĐMC
Thực hiện can thiệp nội mạch khi có tổn thương động mạch chủ từ độ II, III, IV mà có giải phẫu động mạch chủ phù hợp can thiệp nội mạch.
3.2. Chống chỉ định
- Việc can thiệp nội mạch của động mạch chủ ngực có chống chỉ định ở những bệnh nhân không đáp ứng các tiêu chuẩn giải phẫu cần thiết để đặt bất kỳ loại Stent graft nào như kích thước vùng kết nối quá lớn, ĐMC quá xoắn vặn gập góc .
- Bệnh nhân dị ứng thuốc cản quang.
- Trường hợp hẹp tắc xoắn vặn vôi hoá đường vào động mạch chậu, đùi 2 bên.
4. DỤNG CỤ CAN THIỆP NỘI MẠCH ĐỘNG MẠCH CHỦ NGỰC
4.1. Cấu tạo thiết bị can thiệp nội mạch
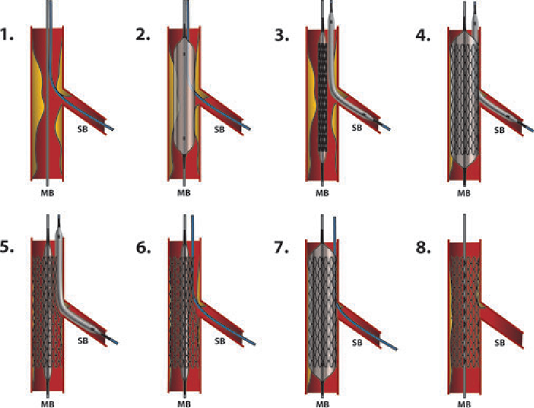
Can thiệp nội mạch điều trị bệnh lý ĐMC ngực được thực hiện bằng cách sử dụng một Stent có màng bọc được gọi là Stent graft. Mặc dù có các thiết kế khác nhau từ thiết bị này sang thiết bị khác nhưng hệ thống can thiệp nội mạch thường gồm ba thành phần chính (hệ thống dẫn đường, phần thân chính, phần mở rộng) là chung cho tất cả các hệ thống thiết bị Stent graft. Các dụng cụ can thiệp ĐMC ngực hiện đang được chấp thuận để điều trị bệnh lý: phình động mạch ngực phần xuống, loét xuyên thành động mạch chủ, tụ máu trong thành động mạch chủ, tách thành động mạch chủ ngực xuống (Type B).
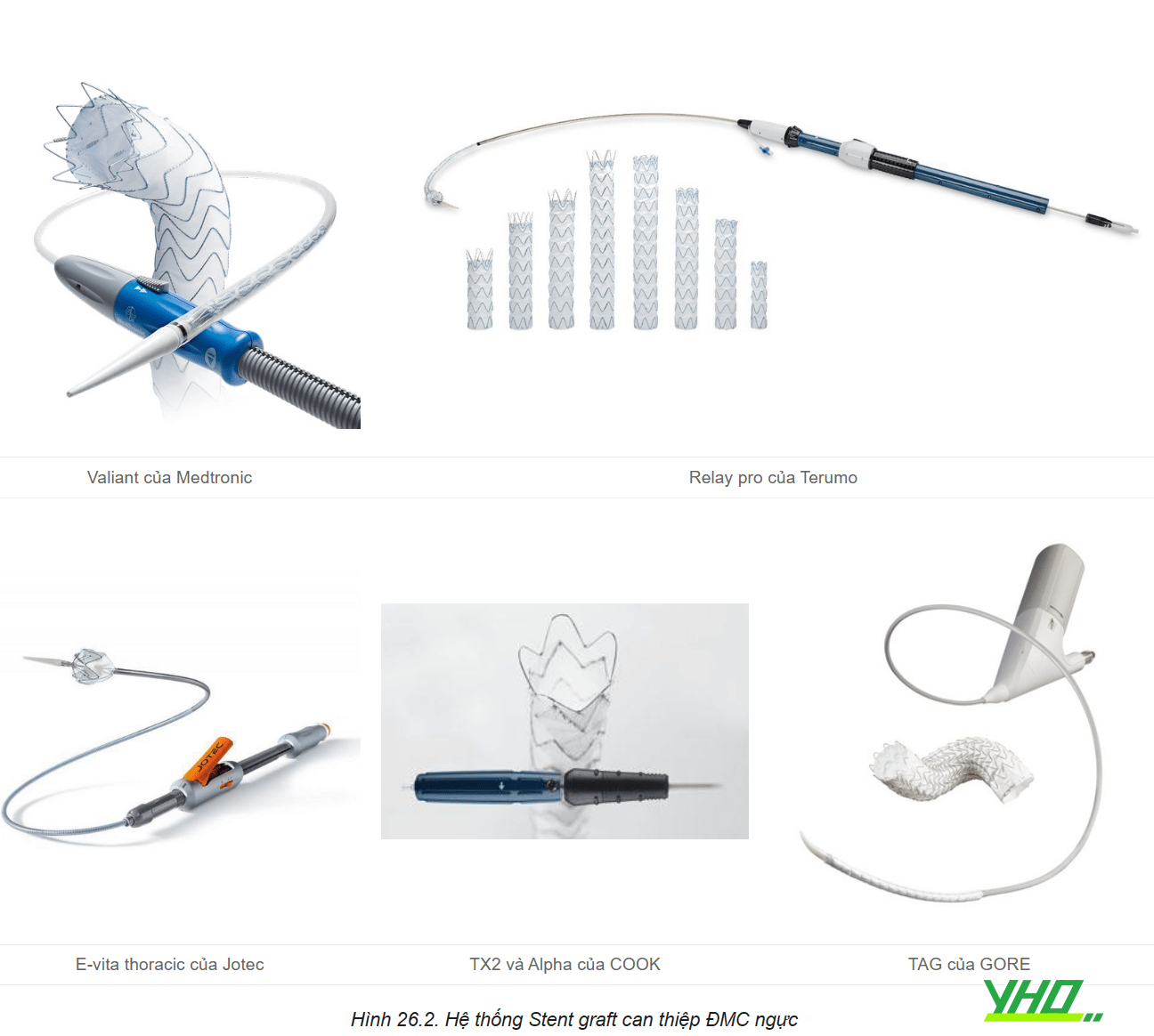
Phần Stent graft được cấu tạo bởi một khung kim loại nhớ hình và bên ngoài được bọc bởi màng bọc polymer: Khung kim loại nhớ hình cấu trúc khác nhau giữa các hãng thiết bị. Một số thiết kế có cấu trúc hỗ trợ ít kim loại hơn có khả năng thích ứng tốt hơn với những thay đổi về cấu trúc túi phình theo thời gian. Đường cong của động mạch chủ ngực đầu gần tạo thành một thách thức để đạt được một thiết kế với sự cố định và gắn kết tối đa. Mức độ tự nở với lực hướng tâm cho phép Stent graft chịu được áp lực nén bên ngoài đồng thời giúp Stent graft áp thành ĐMC tốt hơn hạn chế nguy cơ rò (endoleak) khe giữa ĐMC và Stent graft.
Các thiết kế thế hệ Stent graft mới liên tục được thử nghiệm để nâng cao hiệu quả. Các cải tiến tập trung vào cấu hình thiết bị và hệ thống đưa dẫn dụng cụ vào vị trí với thiết kế nhỏ hơn, hỗ trợ triển khai đặt chính xác hơn, cải thiện khả năng cố định và có lẽ quan trọng nhất là tính linh hoạt trong việc điều trị các tổn thương giải phẫu phức tạp. Những cải tiến này, cùng với việc nâng cao kinh nghiệm của bác sĩ điều trị, đã mang đến những cải thiện về kết quả ngắn hạn và dài hạn của việc điều trị bệnh lý ĐMC bằng can thiệp nội mạch và đã mở rộng ứng dụng can thiệp nội mạch cho nhiều bệnh nhân mà giải phẫu động mạch chủ trước đây được coi là không phù hợp.
4.2. Đo kích thước động mạch chủ, lựa chọn dụng cụ, lập kế hoạch trong can thiệp nội mạch
a. Đo kích thước động mạch chủ
Các phương pháp chẩn đoán hình ảnh đánh giá động mạch chủ
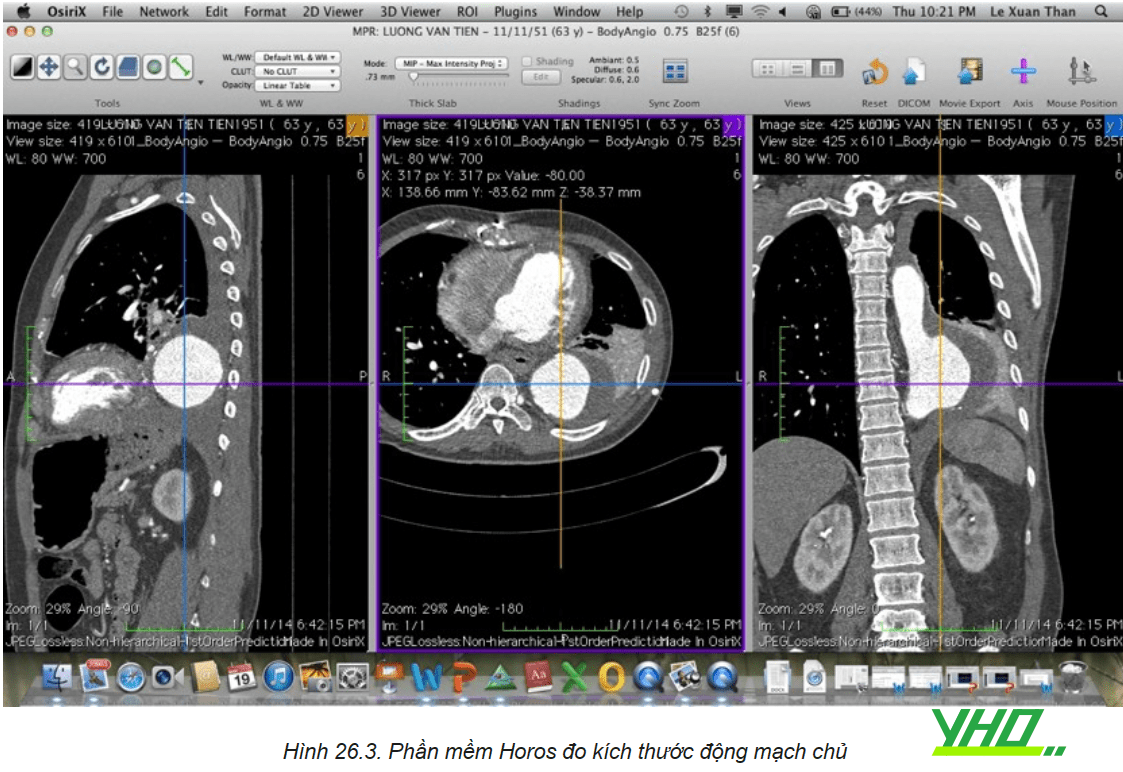
Chụp cắt lớp vi tính động mạch chủ chậu có thuốc cản quang là phương pháp phổ biến nhất dùng đánh giá ĐMC. Chụp hệ thống ĐM chủ chậu bao gồm từ nền cổ đánh giá các nhánh của quai ĐMC, ĐM chủ ngực, ĐM chủ bụng, ĐM chậu đùi. Dựa trên các hình ảnh chụp với các phần mềm định dạng ba chiều giúp đo các kích thước ĐMC như đường kính, chiều dài tổn thương cũng như toàn bộ động mạch chủ từ đó giúp lựa chọn Stent graft có kích thước phù hợp.
Chụp mạch cộng hưởng từ mạch máu (MRA) cũng có thể được sử dụng, nhưng MRA không đánh giá được sự vôi hóa thành mạch, thời gian chụp kéo dài không thích hợp với các trường hợp bệnh nhân nặng. Siêu âm trong lòng mạch giúp đo đạc kích thước ĐMC trong thủ thuật.
Các thành phần giải phẫu cần đánh giá
Đánh giá hệ thống động mạch chủ – chậu: Đánh giá hình ảnh của động mạch chủ cần thực hiện một cách đầy đủ tổn thương bệnh lý ĐMC đặc biệt (landing zone) đầu gần và đầu xa, xác định độ dài bao phủ động mạch chủ cần thiết. Xác định các nhánh bên quan trọng, cũng như đánh giá các đặc điểm của lòng mạch và thành động mạch chủ, bao gồm gánh nặng huyết khối và vôi hóa. Nên thực hiện các phép đo dựa trên phương pháp dựng hình đường trung tâm.
Các vùng gắn kết: Để loại bỏ dòng máu đi vào túi phình động mạch chủ ngực, dụng cụ can thiệp nội mạch phải cần một vùng hàn gắn đủ thích hợp để dụng cụ can thiệp nội mạch áp thành với thành động mạch ở cổ gần và cổ xa, còn được gọi là vùng gắn kết.
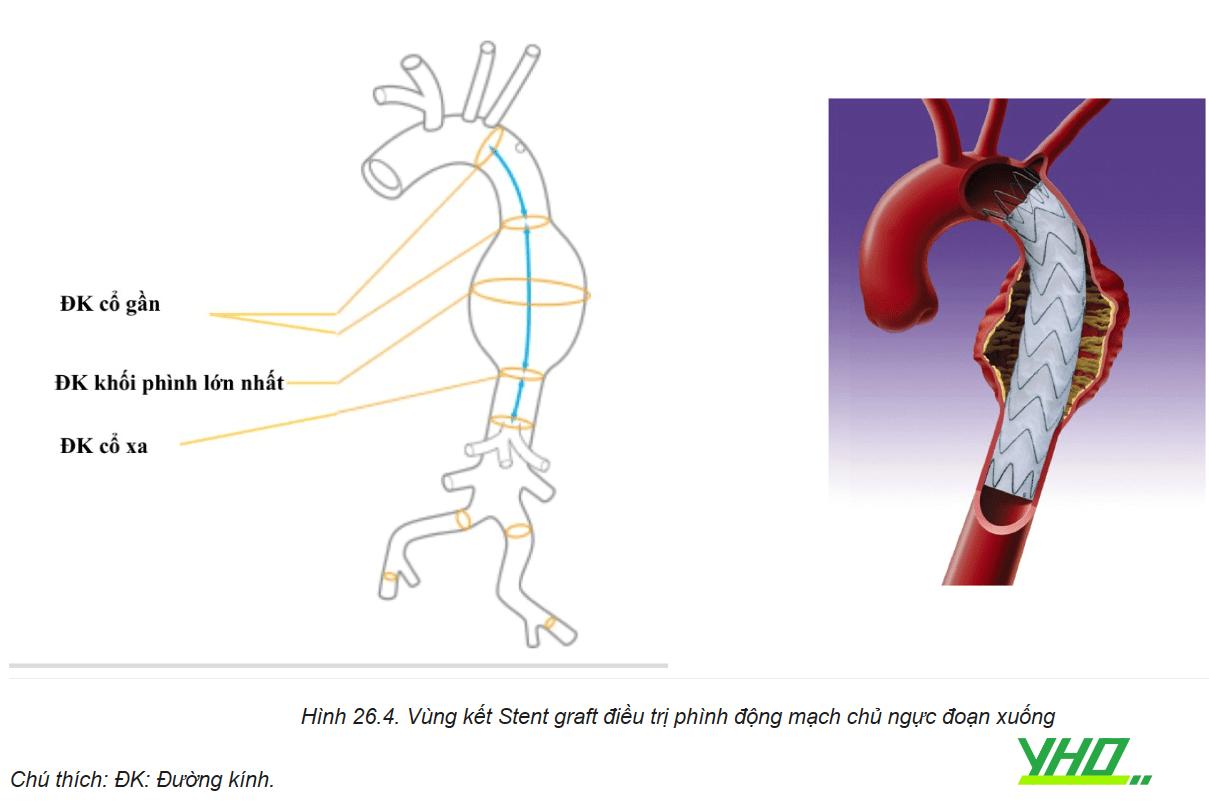
Vùng gắn kết đầu gần (cổ gần): là phần động mạch “lành” ở phía trước khối phình giúp cho Stent graft kết nối và áp thành nhằm ngăn dòng máu không đi vào khối phình. Nếu đầu gần của Stent graft không được áp thành dẫn đến hình thành phần “mỏ chim” nơi mảnh ghép không được áp vào thành động mạch chủ, làm tăng nguy cơ sự di lệch và có thể gây rò do phần hàn gắn không đủ dẫn đến dòng máu đi giữa thành mạch và bên ngoài của stent graft vào khối phình gây rò mạch (endoleak type 1).
Một số trường hợp vùng gắn kết đầu gần liên quan đến các mạch nhánh vì vậy để đạt được phần gắn kết đầu gần tốt cần tạo thêm vùng hàn gắn đầu gần bằng phẫu thuật cầu nối hoặc chuyển vị các nhánh mạch vùng quai ĐMC giúp cấp máu cho các nhánh vùng quai trước khi phủ Stent graft qua gốc các nhánh bên để đạt được phần gắn kết đầu gần 20 mm cần thiết và đảm bảo cho Stent graft sẽ áp sát thành mạch với đường cong bên trong của cung ĐMC.
Phần gắn kết đầu xa (cổ xa): là phần ĐMC mạch “lành” phía xa giúp gắn kết Stent graft với thành ĐMC. Vùng hàn gắn ở đầu xa cũng phải có chiều dài ít nhất là 20 mm.
Đường vào động mạch: Động mạch chậu đùi phải có kích thước đủ lớn, không bị vôi và xoắn vặn quá nhiều hình thái thích hợp để dụng cụ can thiệp có thể đi qua. Nói chung, động mạch chậu đùi có đường kính ít nhất 7 mm đến 8 mm đủ để hệ thống Stent graft đi qua.
b. Lựa chọn dụng cụ
Stent graft cần có đường kính lớn hơn so với đường kính phần gắn kết đầu gần và đầu xa của khối phình ĐMC ngực. Theo khuyến cáo, kích thước của Stent graft lớn hơn (Overside) đường kính động mạch chủ từ 10% đến 20% đối với can thiệp khối phình ĐMC ngực, mức độ lớn hơn của Stent graft dưới 10% đối với bệnh nhân tách thành ĐMC cấp tính và bán cấp. Kích thước quá lớn có thể gây Endoleak Type I do Stent graft bị gấp nếp không nở hoàn toàn. Kích thước lớn làm tăng lực tác động của Stent graft vào thành mạch nguy cơ có thể dẫn đến bóc tách động mạch chủ ngược dòng type A, một biến chứng có thể tử vong của can thiêp nội mạch.
c. Chiến lược can thiệp và các biện pháp can thiệp liên quan đến nhánh bên ĐMC
Các thủ thuật chuyển vị gốc động mạch
Để đạt được phần hàn gắn đầu gần hoặc đầu xa của Stent graft có thể yêu cầu phải che các nhánh bên của động mạch chủ do đó cần thực hiện phẫu thuật chuyển vị hoặc bắc cầu mạch máu đến các mạch quan trọng trước khi đặt Stent graft ĐMC ngực.
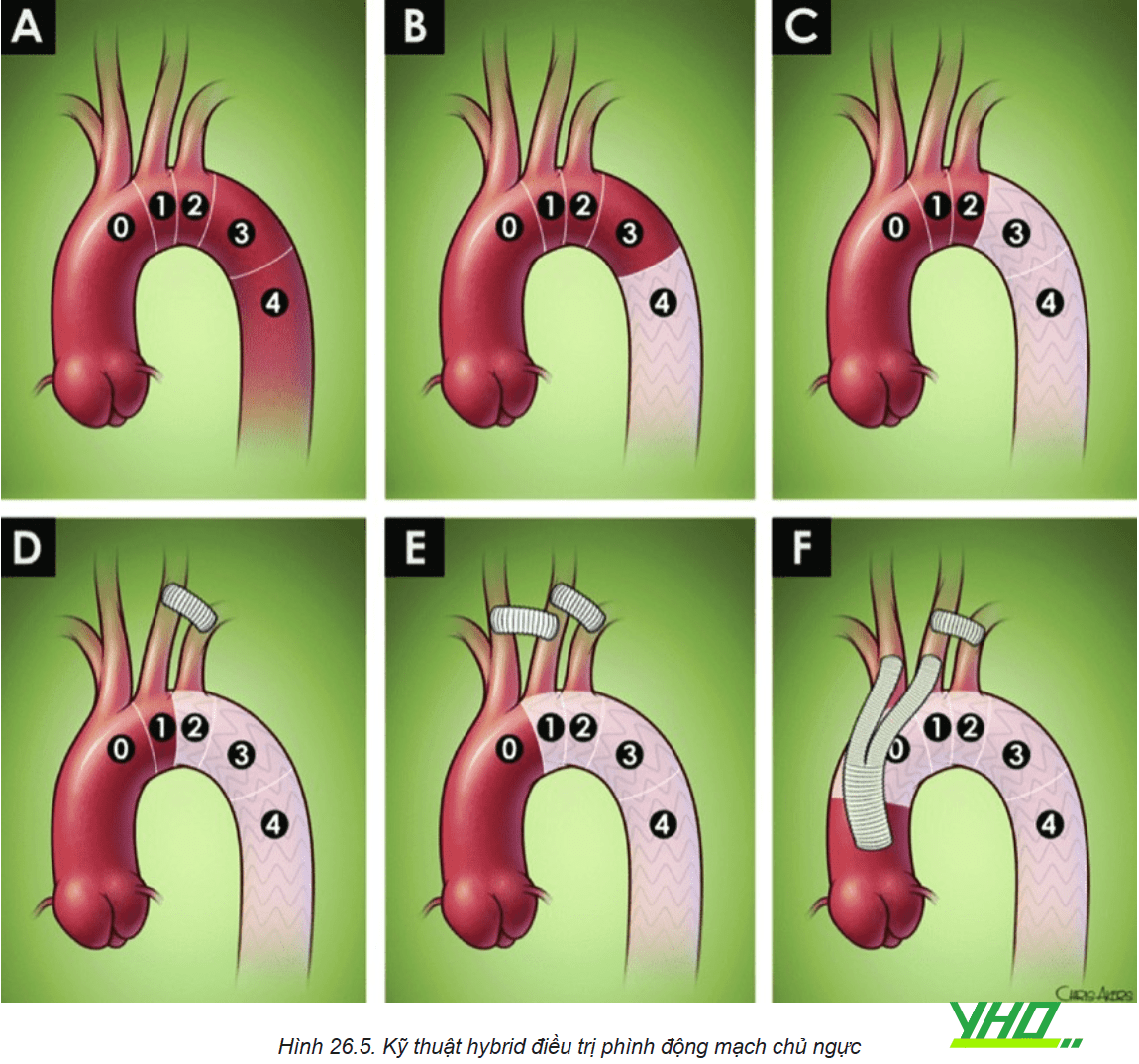
Kết hợp can thiệp nội mạch ĐMC sử dụng Stent graft có lỗ bên hoặc có nhánh, hoặc các Stent khác cấp máu cho nhánh bên đi bên cạnh Stent graft trong kỹ thuật Chimney/Snorkel.
Phẫu thuật cầu nối các nhánh phần quai ĐMC
Nếu phần hàn gắn đầu gần liên quan đến bất kỳ các nhánh động mạch phần quai nào, thì phẫu thuật cầu nối (ví dụ: động mạch cảnh chung phải – trái, động mạch cảnh chung trái – động mạch dưới đòn trái) cần được xem xét.
Có thể cần đến sự bao phủ của động mạch dưới đòn trái (LSA) để đạt phần hàn gắn đầu gần ở 40% bệnh nhân được điều trị bằng phương pháp can thiệp nội mạch ĐMC ngực. Liệu có nên tái thông động mạch dưới đòn trái trước thủ thuật can thiệp thường quy vẫn còn tranh cãi. Một đánh giá hệ thống đã xác định trong đó động mạch dưới đòn trái được thực hiện trong 1161 can thiệp ĐMC ngực, với 444 bệnh nhân được tái thông mạch. Tỷ lệ đột quỵ không giảm đáng kể ở bệnh nhân tái thông động mạch dưới đòn trái so với không tái thông mạch (tỷ số chênh OR 0,70 khoảng tin cậy 95% 0,43-1,14). Cũng không có sự khác biệt đáng kể về tỷ lệ thiếu máu cục bộ tủy sống với tái thông mạch máu dưới đòn trái (OR 0,56; khoảng tin cậy 95% 0,28- 1,10) hoặc tử vong (OR 0,87; khoảng tin cậy 95% 0,55-1,39).
Hiếm khi bệnh nhân xuất hiện các triệu chứng đau cách hồi ở cánh tay sau đó, lúc đó có thể thực hiện thủ thuật tái thông mạch máu có chọn lọc. Một nghiên cứu chỉ ra 4% bệnh nhân xuất hiện các triệu chứng của thiếu máu cục bộ ở chi trên cần tái thông mạch sau đó. Do đó, nhiều người ủng hộ việc tái thông động mạch dưới đòn trái có chọn lọc. Những bệnh nhân cần được xem xét tái thông động mạch dưới đòn trái trước khi thủ thuật bao gồm những bệnh nhân có cầu nối động mạch vú trong vào động mạch vành trái, động mạch đốt sống trái ưu năng hoặc đơn độc hoặc cầu nối động mạch quay lọc máu vĩnh viễn. Khi cần phủ qua động mạch dưới đòn trái, nên thực hiện siêu âm Doppler động mạch đốt sống và động mạch cảnh để xác định quy trình tối ưu để khôi phục dòng chảy dưới đòn trái.
Các nghiên cứu quan sát cho thấy rằng trong hầu hết các trường hợp, tái thông động mạch dưới đòn trái trước khi đặt stent graft làm thay đổi đáng kể kết quả khi việc che phủ động mạch dưới đòn trái được cho là cần thiết. Đối với những bệnh nhân có động mạch đốt sống bên trái ưu năng, động mạch đốt sống bên phải thiểu sản hoặc đa giác Willis không hoàn chỉnh, việc bao phủ có kế hoạch của vùng dưới đòn trái phải được chuẩn bị trước bằng phẫu thuật bắc cầu động mạch cảnh trái, vì sự gián đoạn lưu lượng máu trong những trường hợp này có liên quan đến việc tăng tỷ lệ đột quỵ và liệt nửa người. Dòng chảy xuống dưới đòn trái cũng nên được xem xét ở những bệnh nhân có bao phủ động mạch chủ ngực dài và những bệnh nhân đã được sửa chữa phình động mạch chủ bụng trước đó.
Khi cần tái thông mạch máu dưới đòn trái, so sánh giữa bắc cầu động mạch cảnh – dưới đòn trái và chuyển vị động mạch cảnh – dưới đòn không tìm thấy sự khác biệt đáng kể về đột quỵ, thiếu máu cục bộ tủy sống hoặc tử vong.
Tái thông động mạch cảnh – Đối với vùng hàn gắn đầu gần bao phủ động mạch cảnh chung bên trái hoặc thân động mạch cánh tay đầu, có thể thực hiện bắc cầu hoặc từ động mạch chủ lên hoặc chuyển vị động mạch cảnh, có thể thực hiện bắc cầu ngoài giải phẫu như bắc cầu động mạch cảnh – cảnh để tránh phẫu thuật mở xương ức.
Bắc cầu động mạch tạng – Thiếu máu cục bộ các tạng có thể xảy ra với sự bao phủ qua động mạch thân tạng. Tuy nhiên, một số báo cáo đã cho thấy bằng hệ thống bàng hệ qua một vùng tụy tá tràng bàng hệ đến mức của động mạch mạc treo tràng trên mà không gây hậu quả thiếu máu. Trong một nghiên cứu tổng quan, sự che phủ của động mạch thân tạng trong TEVAR đối với phình ĐMC ngực mà không kèm theo thuyên tắc động mạch thân tạng dẫn đến chỉ có ba trường hợp có endoleak type II trong số 72 bệnh nhân và những bệnh nhân này đã được điều trị thành công bằng phương pháp bít coil.
Đặt Stent graft xuống dưới mức SMA (Superior Mesenteric Artery – Động mạch mạc treo tràng trên) hoặc mức động mạch thận đòi hỏi tái thông mạch máu của các nhánh mạch này thông qua phẫu thuật chuyển vị hoặc bằng cách sử dụng Stent graft có nhánh hoặc kỹ thuật ống khói (chimney/snorkel), hoặc ghép nhánh bên hoặc nhánh bên chuyên dụng. Phẫu thuật cầu nối cung cấp lưu lượng máu đến các động mạch nội tạng thông qua các mạch nhân tạo để cho phép Stent graft bao phủ qua gốc các nhánh nội tạng của động mạch chủ.
Đối với bắc cầu các nhánh nội tạng, quy trình được thực hiện trước khi can thiệp nội mạch với việc bắc cầu dòng máu thường xuất phát từ động mạch chậu. Việc can thiệp nội mạch sau đó có thể tiến hành cùng một lúc hoặc bị trì hoãn trong vài ngày hoặc vài tuần sau phẫu thuật bắc cầu ban đầu, tùy thuộc vào tình trạng lâm sàng của bệnh nhân. Nhìn chung nên tiến hành cầu nối các nhánh mạch tạng có kế hoạch trước khi can thiệp nội mạch. Tương tự như vậy, khi làm cầu nối nhánh động mạch dưới đòn được chỉ định, nên thực hiện quy trình từ một đến ba ngày trước khi can thiệp nội mạch.
5. CÁC BƯỚC CAN THIỆP ĐỘNG MẠCH CHỦ NGỰC
5.1. Đánh giá nguy cơ phẫu thuật trước TEVAR
Mặc dù việc can thiệp nội mạch của ĐMC ngực có liên quan đến tỷ lệ biến chứng và tử vong sau thủ thuật thấp hơn so với sửa chữa bằng phẫu thuật mở, nhưng có nguy cơ cần phải chuyển sang phẫu thuật hở do đó bệnh nhân nên được đánh giá và chuẩn bị như thể đang trải qua phẫu thuật mở. Bệnh nhân phải được đánh giá toàn diện các bệnh đi kèm trước khi thực hiện thủ thuật điều trị bệnh lý ĐMC bao gồm đánh giá tim, phổi và thận, tình trạng tăng huyết áp và tuổi bệnh nhân là các yếu tố nguy cơ liên quan đến biến cố và nguy cơ tử vong.
5.2. Chuẩn bị trước can thiệp
- Dự phòng bằng kháng sinh: Nên dùng kháng sinh dự phòng trong vòng 30 phút trước khi thủ thuật. Thuốc kháng sinh được ngừng sử dụng trong vòng 24 giờ do không có lợi ích bổ sung ngoài khung thời gian đó.
- Các biện pháp ngăn ngừa tổn thương thận cấp: Tỷ lệ tổn thương thận cấp sau can thiệp động mạch chủ ngực tăng lên 10 đến 15%. Tỷ lệ rối loạn chức năng thận cao hơn có thể xảy ra ở những bệnh nhân bị tách thành ĐMC type B, vì những bệnh nhân này thường chỉ được điều trị sau khi xảy ra tình trạng suy giảm chức năng. Các yếu tố nguy cơ quan trọng của rối loạn chức năng thận sau thủ thuật bao gồm suy chức năng thận trước phẫu thuật, bệnh nhân mất máu cần truyền máu và mức độ của bệnh động mạch chủ ngực. Với điều kiện có đủ vùng hàn gắn, việc can thiệp nội mạch ĐMC ngực có thể được thực hiện với ít nhất là 60 đến 80 mL thuốc cản quang.
- Giảm thiểu thiếu máu tủy sống: Dẫn lưu dịch não tủy nên được sử dụng trong các trường hợp che phủ ĐMC ngực đoạn dài, tiền sử mổ hoặc sửa chữa phình động mạch chủ bụng trước đó, hoặc có tắc động mạch chậu trong đi kèm là những yếu tố làm tăng nguy cơ thiếu máu cục bộ tủy sống (SCI) với liệt 2 chi dưới. Trong một nghiên cứu trên 72 bệnh nhân, tỷ lệ thiếu máu cục bộ tủy sống là 12,5% đối với những bệnh nhân đã từng sửa chữa chứng phình động mạch chủ bụng so với 1,7% ở những người không có tiền sử (nguy cơ 7,2% khoảng tin cậy 95%: 2,6-19,6). Một nghiên cứu thuần tập hồi cứu về can thiệp nội mạch (phình động mạch chủ bụng Crawford loại II) bằng cách sử dụng stent graft có nhánh cho thấy sửa chữa theo giai đoạn làm giảm nguy cơ SCI so với các thủ thuật kết hợp (11,1% so với 37,5%).
Dẫn lưu dịch não tủy làm giảm áp lực trong khoang dưới nhện, do đó làm tăng áp lực tưới máu tủy sống (áp lực tưới máu tủy sống = áp lực động mạch trung bình – áp lực dịch não tủy) là một biện pháp hỗ trợ quan trọng để giảm thiếu máu cục bộ tủy sống sau quá trình can thiệp nội mạch của ĐMC ngực. Dẫn lưu dịch não tủy được thực hiện bằng cách đặt một ống dẫn lưu ngang với đĩa đệm L3-L4 vào khoang dưới nhện. Theo dõi chức năng thần kinh đối với thiếu máu cục bộ tủy sống trong quá trình phẫu thuật và trong giai đoạn hậu phẫu.
5.3. Các bước thủ thuật can thiệp đặt Stent graft ĐMC ngực
Can thiệp nội mạch ĐMC ngực thường được thực hiện với phương pháp vô cảm bằng giảm đau toàn thân kết hợp gây tê tại chỗ. Tỷ lệ thành công về mặt kỹ thuật cao.
a. Tạo đường vào mạch máu
Có thể thực hiện mở đường vào ĐM qua da hoặc phẫu thuật bộc lộ mạch máu: Thực hiện thủ thuật tạo đường vào mạch máu qua da bằng cách tạo các sợi chỉ chờ bằng dụng cụ đóng mạch qua da sau đó đưa một sheath có đường kính lớn vào ĐMC theo phương pháp Seldinger. ĐM đùi bên đối diện được đặt một sheath 6F theo phương pháp Seldinger để đưa ống thông pigtail chụp động mạch trong quá trình can thiệp.
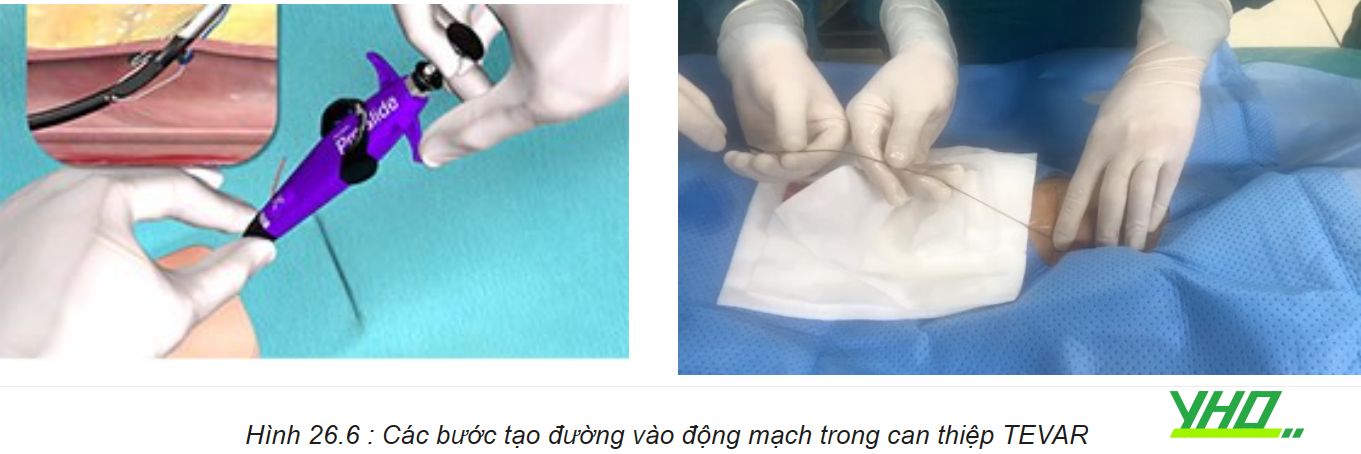
b. Đưa dây dẫn siêu cứng từ đường vào động mạch đùi đến gốc động mạch chủ
Sử dụng ống thông pigtail đưa đến vị trí gốc động mạch chủ sau đó dây dẫn thông thường được đưa ra và thay bằng dây dẫn siêu cứng đến gốc động mạch chủ đi trong lòng ống thông pigtail và thay ống thông pigtail ra ngoài.
c. Kỹ thuật đặt stent graft
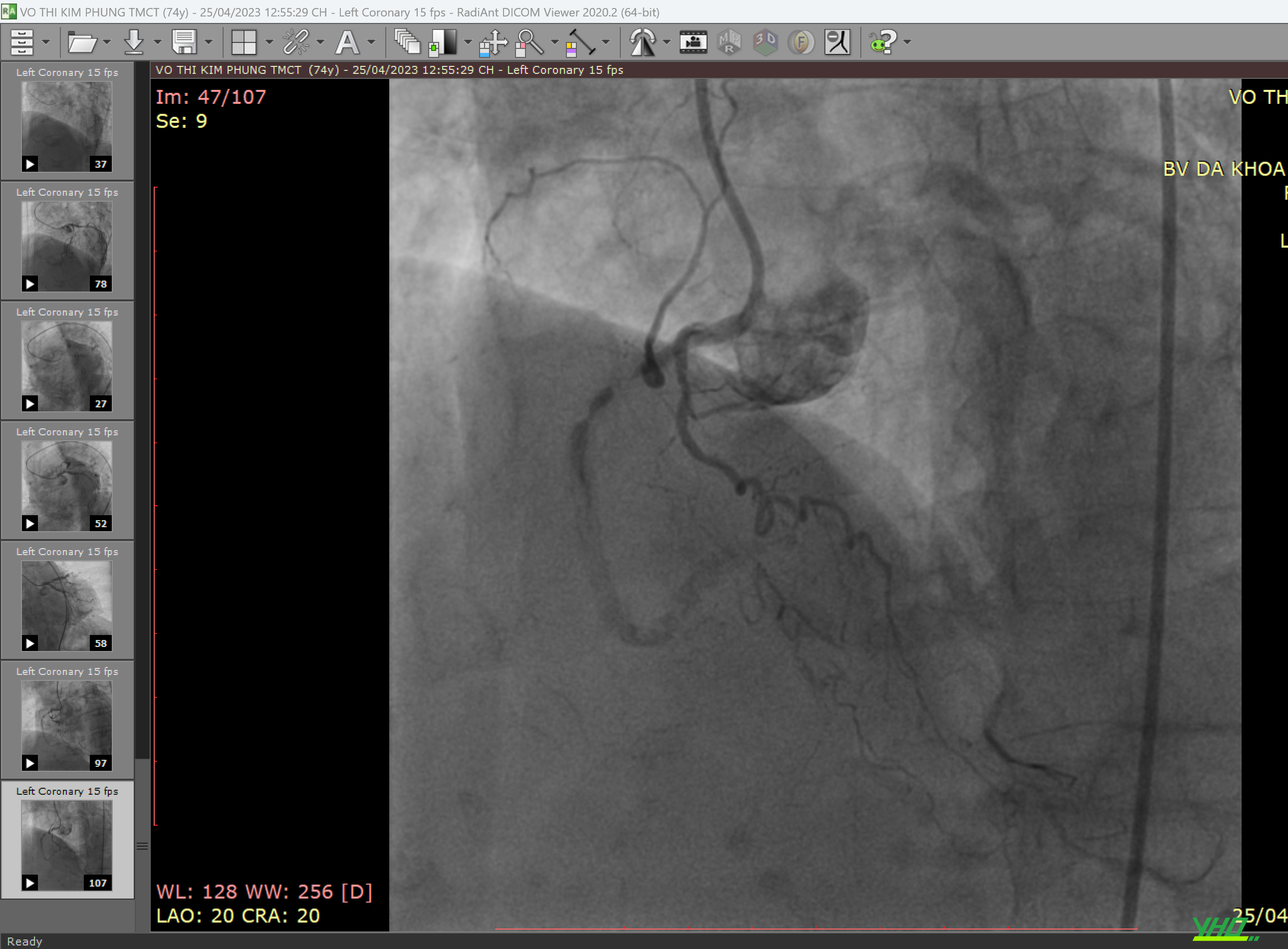
Trên nền dây dẫn siêu cứng hệ thống stent graft được đưa đến vị trí cần đặt, chụp động mạch chủ bằng ống thông pigtail đi từ đường ĐM đùi đối bên được sử dụng để định vị và thả Stent graft ĐMC chính xác tại các vị trí đích. Khi đặt stent graft tại vùng gần quai ĐMC, điều quan trọng là phải hiệu chỉnh một hình chiếu phù hợp thể hiện rõ vị trí xuất phát các mạch vùng quai ĐMC. Hình chiếu chếch trước nghiêng trái từ 30-60 độ thường được sử dụng. Đối với vùng hàn gắn đầu xa gần động mạch thân tạng, cần phải có hình chiếu bên. Mỗi loại Stent graft có trình tự các bước để đặt chính xác vào vị trí đích.
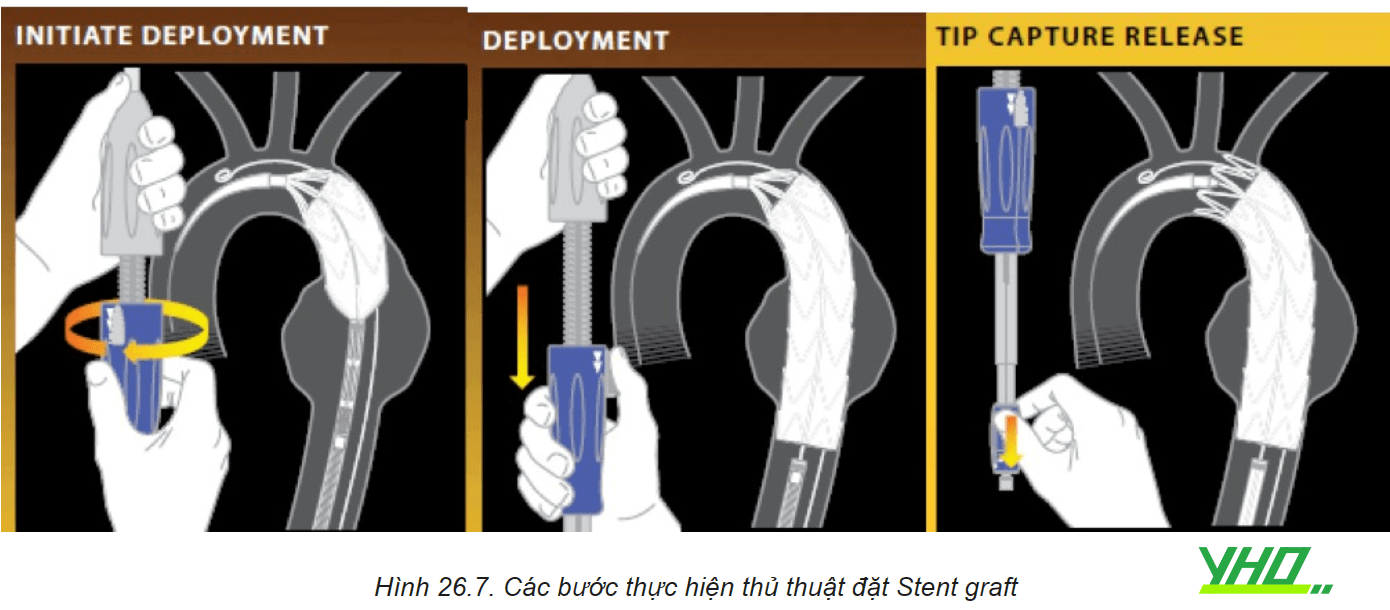
Trong khi thực hiện thủ thuật đặt Stent graft cần giảm huyết áp duy trì mức huyết áp trung bình 60 mmHg, giúp ngăn ngừa việc Stent graft bung sớm và dịch chuyển Stent về phía xa do áp lực của dòng máu.
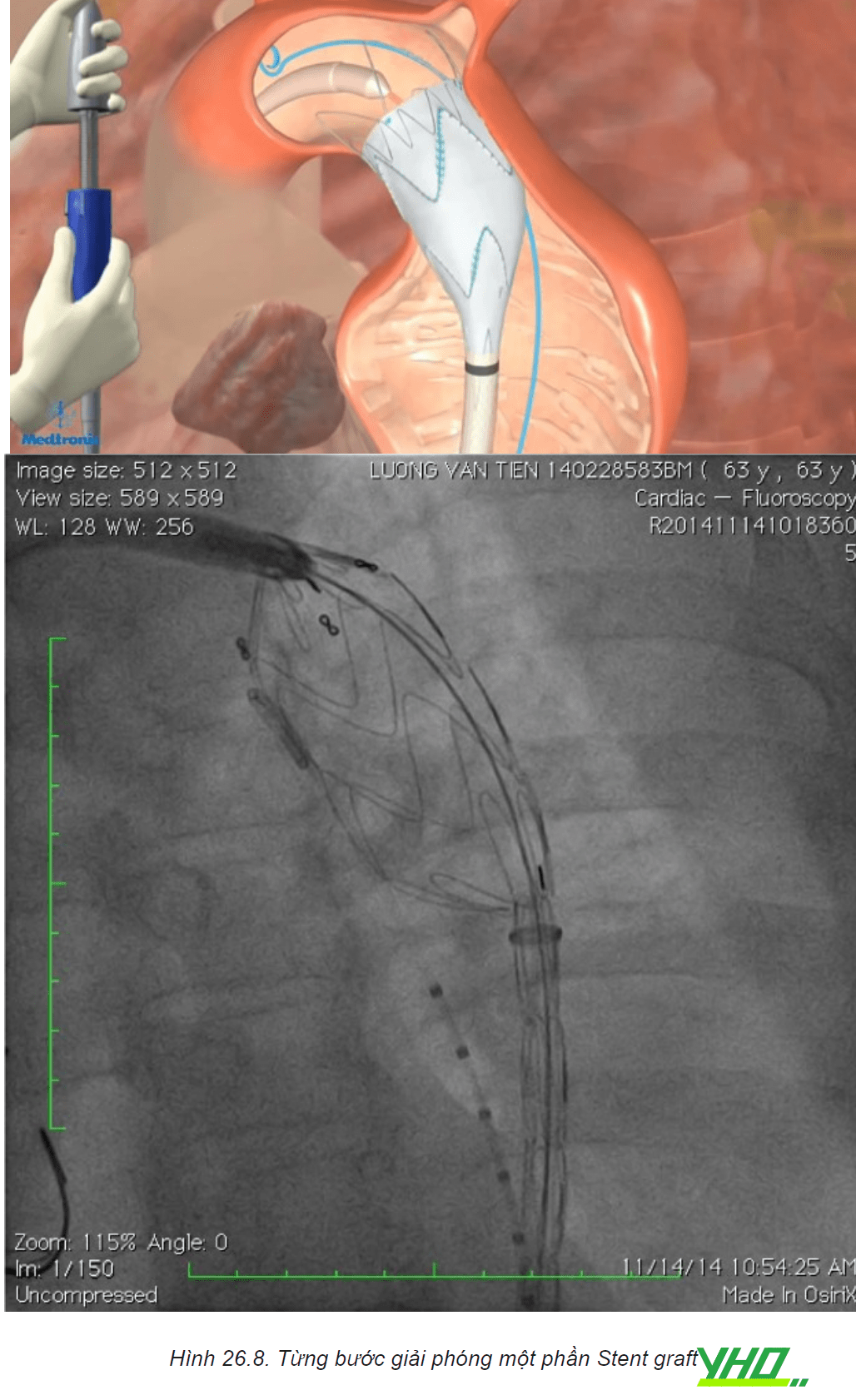
d. Nong bóng
Sau khi dụng cụ được đặt đúng vị trí hệ thống Stent graft thường được nong lại bằng bóng ở các vị trí hàn gắn đầu gần và xa, cũng như tại các điểm nối stent giúp cho Stent graft áp sát vào thành mạch.
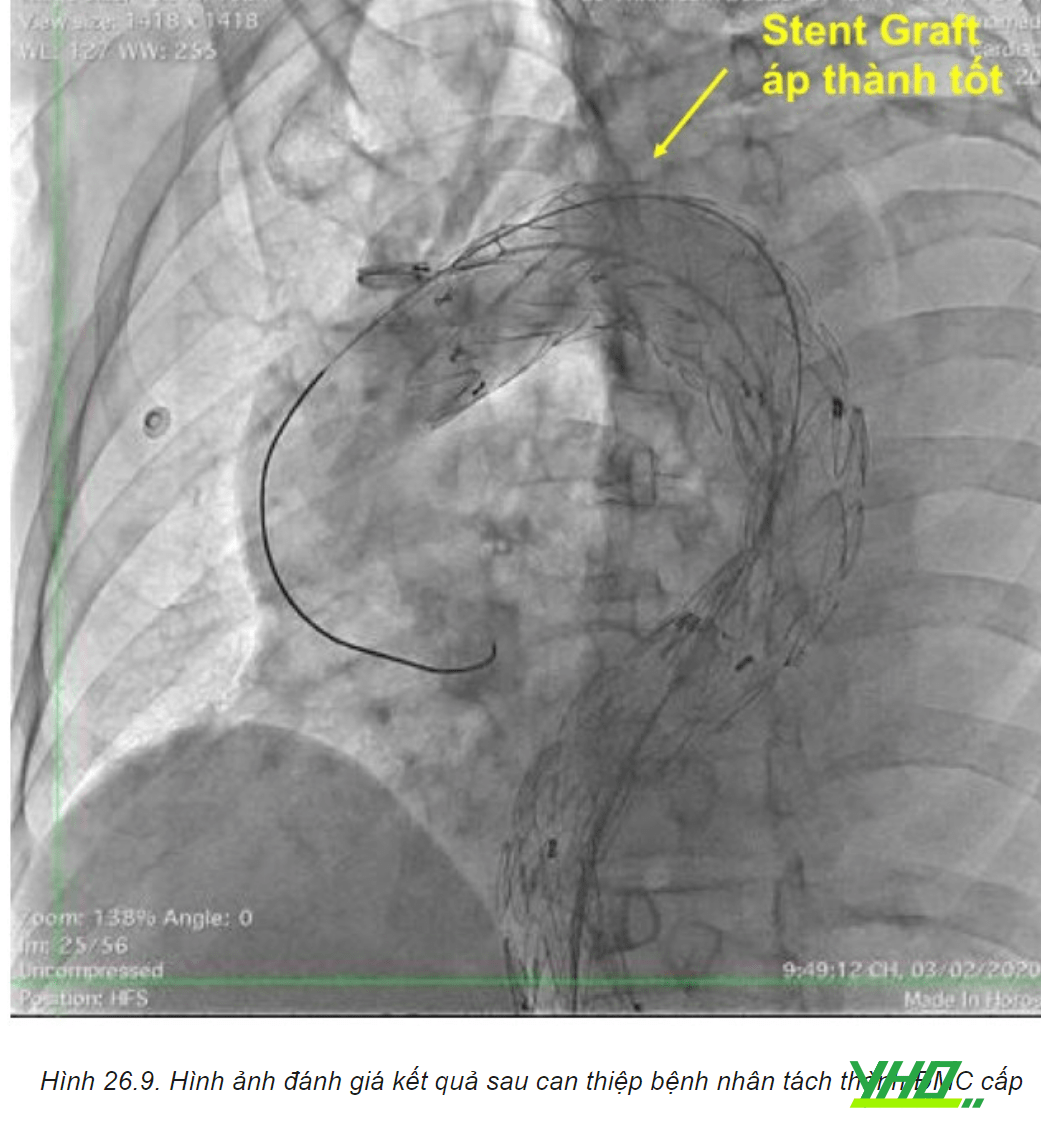
e. Chụp kiểm tra đánh giá kết quả
Chụp động mạch chủ được thực hiện khi kết thúc quy trình để đảm bảo loại trừ túi phình hiệu quả, bảo tồn các mạch thiết yếu và phát hiện hiện tượng dò mạch (endoleak). Endoleak là dòng dò vào trong túi phình sau khi đã được can thiệp nội mạch của động mạch chủ.
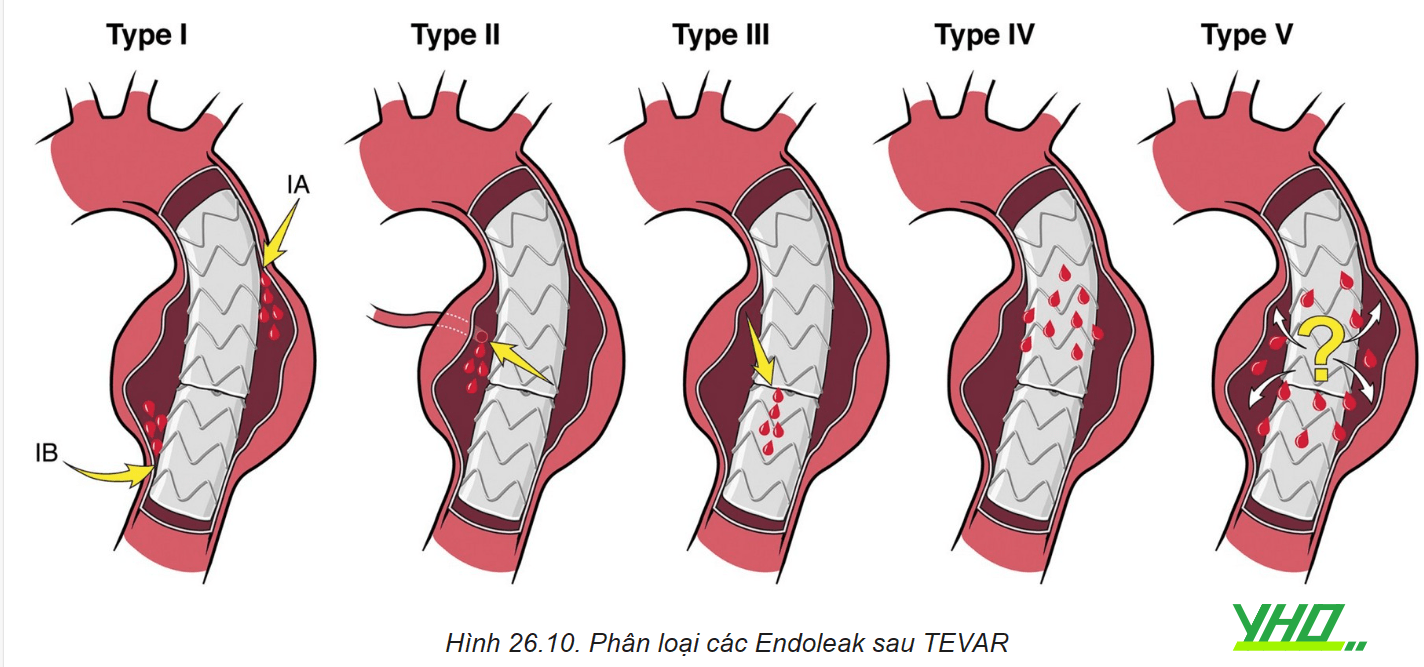
Phân loại Endoleak:
- Type I: rò qua phần kết nối đầu gần (IA) hoặc đầu xa (IB).
- Type II: rò qua các mạch nhánh.
- Type III: rò qua phần ghép nối các Stent graft.
- Type IV: rò qua màng của Stent graft.
- Type V: giãn khối phình nhưng không tìm thấy nguyên nhân rò.
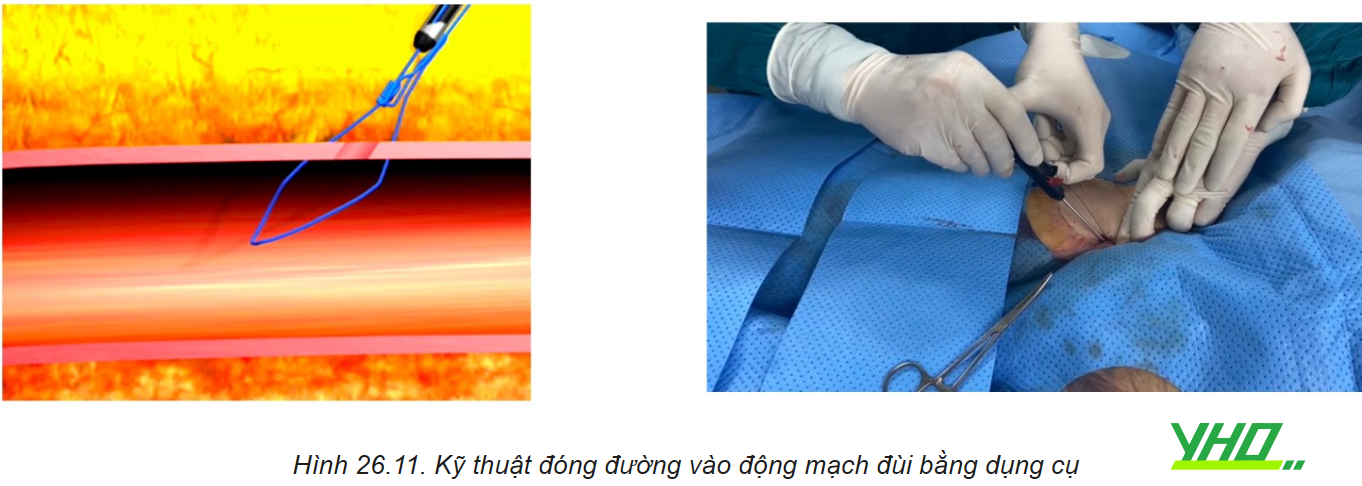
f. Đóng đường vào động mạch
Khi kết thúc thủ thuật sheath sẽ được lấy ra và phẫu thuật khâu mạch máu hoặc đóng lại bằng dụng cụ đóng mạch chuyên dụng qua da (Xin xem thêm chương 10).
6. TIÊU CHÍ ĐÁNH GIÁ THÀNH CÔNG THỦ THUẬT
6.1. Thành công về mặt kỹ thuật
Thành công về mặt kỹ thuật đối với can thiệp nội mạch điều trị bệnh lý ĐMC ngực bao gồm đưa Stent graft tới vị trí đích và đặt được dụng cụ đúng vị trí theo kế hoạch mà không có endoleak type 1 và type 3 trên chụp mạch, không có tắc nghẽn trong Stent graft, không phải thực hiện thêm các can thiệp khác hoặc phẫu thuật sửa chữa biến chứng cụ thể là:
- Đặt đúng vị trí dự kiến.
- Không có endoleak type I và III.
- Duy trì lòng mạch không có tắc nghẽn trong Stent graft (Chênh áp < 10 mmHg).
6.2. Thành công trên lâm sàng
Thành công trên lâm sàng được xác định trên cơ sở thành công về mặt thủ thuật đặt dụng cụ đúng vị trí đồng thời không có tử vong liên quan đến thủ thuật, liên quan đến bệnh lý động mạch chủ, không có endoleak type I hoặc III, di lệch Stent graft, nhiễm trùng, huyết khối, giãn khối phình, vỡ khối phình hoặc phải chuyển sang phẫu thuật mở.
7. BIẾN CHỨNG VÀ XỬ TRÍ BIẾN CHỨNG CỦA CAN THIỆP ĐỘNG MẠCH CHỦ NGỰC
Tỷ lệ tử vong quanh thủ thuật stent graft ĐMC ngực trong các trường hợp can thiệp thường quy là thấp, dao động từ 1,9 đến 3,1%. Tuy nhiên, bệnh nhân can thiệp động mạch chủ ngực vì các lý do cấp cứu, chẳng hạn như do vỡ động mạch chủ hoặc tách thành động mạch chủ, có tỷ lệ tử vong chu phẫu cao hơn, tăng độ phức tạp của thủ thuật can thiệp làm tăng đáng kể tỷ lệ tử vong và tỷ lệ biến chứng nghiêm trọng. Trong một nghiên cứu các biến chứng quanh thời gian thủ thuật (nhồi máu cơ tim, biến cố hô hấp như viêm phổi hoặc thở máy trong hơn 24 giờ, đột quỵ và liệt nửa người), tỷ lệ biến cố quanh thủ thuật là 9%.
Các biến chứng đặc trưng cho can thiệp đặt stent graft ĐMC ngực bao gồm biến chứng đường vào mạch máu và thiếu máu cục bộ liên quan đến huyết khối tắc mạch trong quá trình thủ thuật, hậu quả của che phủ các nhánh bên của động mạch chủ, hoặc tách thành động mạch chủ ngược dòng, có thể xảy ra trong quá trình thủ thuật hoặc có thể xảy ra sau đó. Trong một tổng quan hệ thống, tỷ lệ tách thành động mạch chủ ngược dòng là 2,5% và có liên quan đến tăng huyết áp, tiền sử phẫu thuật mạch máu, tách thành động mạch chủ cấp tính (so với mạn tính), tách thành động mạch chủ (so với phình động mạch) và sử dụng Stent graft có phần kim loại trần cố định đầu gần (so với có Stent graft không có phần kim loại trần đầu gần).
7.1. Rò động mạch chủ – phế quản hoặc rò động mạch chủ – động mạch phổi
Thường liên quan đến chèn ép phế quản do hậu quả của endoleak, là những biến chứng hiếm gặp.
7.2. Thiếu máu cục bộ tủy sống
Nguy cơ thiếu máu cục bộ tủy sống (Spiral Cord Ischemia – SCI) đã được báo cáo là từ 3% đến 11%. Một số nghiên cứu đã chứng minh tỷ lệ thiếu máu tuỷ với TEVAR thấp hơn so với phẫu thuật mở. Trong một đánh giá hồi cứu, được thực hiện trên 724 bệnh nhân tại một cơ sở duy nhất được điều trị bằng TEVAR (n = 352) hoặc phẫu thuật mở (OS; n = 372) đối với bệnh lý phình động mạch chủ ngực hoặc phình ĐM ngực bụng, không có sự khác biệt có ý nghĩa thống kê về tỷ lệ SCI được tìm thấy giữa hai phương pháp (4,3% so với 7,5%, tương ứng). Trong một đánh giá hồi cứu trên 424 bệnh nhân đã trải qua TEVAR, trong số 12 bệnh nhân bị thiếu máu cục bộ tủy sống, một nửa đã được phẫu thuật ĐMC hoặc can thiệp nội mạch trước đó. Sự khởi phát của thiếu máu cục bộ tủy sống xuất hiện trung bình 10,6 giờ sau khi thủ thuật. Mức độ che phủ của động mạch chủ ngực là yếu tố nguy cơ lớn nhất của thiếu máu cục bộ tủy sống. Các nghiên cứu khác đã xác định hạ huyết áp quanh phẫu thuật và thời gian thủ thuật kéo dài, là các yếu tố nguy cơ.
7.3. Thiếu máu não cục bộ
Vì vùng hàn gắn đầu gần sát với động mạch cảnh và động mạch đốt sống, đột quỵ tắc mạch có thể xảy ra sau TEVAR. Các yếu tố nguy cơ được báo cáo đối với đột quỵ do tắc mạch bao gồm đặt stent graft ở đầu gần, sự hiện diện của mảng xơ vữa di động trong phần quai và đột quỵ trước đó. Thuyên tắc qua động mạch đốt sống phát sinh từ dưới đòn có thể là nguồn gốc của đột quỵ tuần hoàn hố sau. Đột quỵ não trước sau can thiệp dao động từ 4% đến 8% tương đương với phẫu thuật mở.
7.4. Thiếu máu chi trên
Như đã mô tả ở trên, việc che phủ động mạch dưới đòn trái theo kế hoạch ở những bệnh nhân có nguy cơ phải được thực hiện trước bằng bắc cầu hoặc chuyển vị động mạch cảnh – dưới đòn. Triệu chứng thiếu máu chi trên là không thường xuyên sau khi bao phủ động mạch dưới đòn trái. Các triệu chứng có thể xảy ra ở một mức độ khác nhau nhưng cần can thiệp ở một số ít bệnh nhân.
Trong một tổng quan hệ thống bao gồm 4906 bệnh nhân, người ta cho rằng mặc dù tái thông mạch làm giảm tỷ lệ các biến chứng thiếu máu cục bộ sau này, nhưng tỷ lệ tử vong chu phẫu và các biến chứng khác lại tăng lên. Trong một nghiên cứu trên 111 bệnh nhân trải qua TEVAR mà không được phẫu thuật cầu nối tưới máu động mạch dưới đòn trái trước đó, 13/50 bệnh nhân trong nhóm bao phủ toàn bộ và 2/25 bệnh nhân trong nhóm bao phủ một phần bị thiếu máu động mạch sống nền nhưng không thấy liệt nửa người hoặc đột quỵ.
7.5. Thiếu máu cục bộ nội tạng
Thiếu máu cục bộ nội tạng có thể xảy ra với sự bao phủ của động mạch thân tạng, mặc dù các báo cáo đã cho rằng sự nguyên vẹn của hệ thống động mạch thân tạng cấp máu cho khối tá tụy cho phép mở rộng vùng che phủ đến sát động mạch mạc treo tràng trên phủ qua động mạch thân tạng mà không gây hậu quả. Tương tự, đặt stent xuống dưới mức động mạch mạc treo tràng trên hoặc động mạch thận cần tái thông các mạch này.
7.6. Biến chứng suy thận cấp
Trong một nghiên cứu trên 171 bệnh nhân, các yếu tố dự báo độc lập về tổn thương thận cấp, xảy ra ở 24 bệnh nhân (14%), bao gồm mức lọc cầu thận giảm trước thủ thuật, mức độ sửa chữa ĐMC ngực và truyền máu sau phẫu thuật, lượng thuốc cản quang. Tỷ lệ sống sót thấp hơn đáng kể ở những bệnh nhân có tổn thương thận cấp.
7.7. Hội chứng cấy ghép sau phẫu thuật
Hội chứng cấy ghép sau thủ thuật có thể xảy ra trong giai đoạn đầu sau thủ thuật và được đặc trưng bởi tăng bạch cầu, sốt và tăng các chất trung gian gây viêm như protein phản ứng C, IL-6 và TNF-alpha. Nó được cho là do sự hoạt hóa nội mô bởi nội bào. Đối với việc đặt Stent Graft động mạch chủ ngực, sự phát triển của tràn dịch màng phổi phản ứng một bên hoặc hai bên không phải là hiếm, với tỷ lệ được báo cáo là 37% đến 73%.
7.8. Các biến chứng muộn và kết quả
Các biến chứng muộn của việc đặt Stent Graft động mạch chủ ngực chủ yếu liên quan đến bệnh lý ĐMC được điều trị trước đó, cũng như hậu quả của các biến chứng liên quan đến thiết bị như endoleak, dò, di lệch thiết bị.
Một nghiên cứu hồi cứu về cơ sở dữ liệu Medicare của Hoa Kỳ đã xác định gần 12.000 bệnh nhân đã trải qua quá trình sửa chữa nội mạch của động mạch chủ ngực từ năm 2005 đến năm 2010 với các chỉ định khác nhau. Thời gian sống thêm trung bình là 57,6 tháng (khoảng tin cậy 95% từ 55 đến 61 tháng). Tỷ lệ tử vong sớm và muộn phụ thuộc vào bệnh lý động mạch chủ ban đầu. Bệnh nhân được can thiệp sửa chữa động mạch chủ nội mạch cấp cứu hoặc tổn thương ĐMC do chấn thương có tỷ lệ tử vong chu phẫu cao nhất nhưng cũng có tỷ lệ tử vong muộn thấp nhất, có lẽ do tuổi trẻ hơn và số bệnh đi kèm ít hơn. Những bệnh nhân phình động mạch xa vùng mạch lớn, đặc biệt là những bệnh nhân không cần bao phủ động mạch dưới đòn, có tỷ lệ tử vong chu phẫu thấp nhất, mặc dù họ có tỷ lệ tử vong muộn tương đối cao. Vỡ động mạch chủ có liên quan đến tỷ lệ tử vong sớm và muộn cao. Một phát hiện quan trọng của phân tích lớn này là trong số những bệnh nhân sống sót đến 180 ngày, 6% đến 12% bệnh nhân chết mỗi năm, tùy thuộc vào chẩn đoán bệnh lý động mạch chủ.
Tỷ lệ endoleak sau đặt stent động mạch chủ ngực thấp hơn so với can thiệp nội mạch của động mạch chủ bụng và được ước tính là 3,9 đến 15,3% . Tỷ lệ endoleak khi theo dõi 5 năm với thiết bị Gore TAG là khoảng 4,3%. Endoleak type I là loại phổ biến nhất. Trong một nghiên cứu trên 344 bệnh nhân đã trải qua TEVAR, endoleak type II phổ biến hơn và xảy ra phổ biến nhất ở các vị trí động mạch dưới đòn trái và nhánh ĐM liên sườn, tiếp theo là các mạch tạng. Trong số những bệnh nhân bị vỡ liên quan đến endoleak thứ phát, rất ít có liên quan đến endoleak loại II. Cần theo dõi liên tục đối với endoleak là cần thiết.
Sự di chuyển của Stent graft (>10 mm) có thể xảy ra, với tỷ lệ được công bố từ 1% đến 2,8% trong khoảng thời gian từ 6 đến 12 tháng. Các yếu tố dẫn đến di chuyển bao gồm kích thước Stent lớn hơn so với mạch quá mức và giải phẫu vùng hàn gắn xoắn vặn. Sự cố bẹp Stent cũng có thể xảy ra, chủ yếu ở những bệnh nhân chấn thương trẻ tuổi, có liên quan đến sự co thắt quá mức động mạch chủ gần hoặc Stent graft to quá mức tại thời điểm đặt thiết bị. Những bệnh nhân này có các triệu chứng của tắc động mạch chủ cấp tính. Trong trường hợp có nhiều stent chồng lên nhau, tách rời các miếng stent graft cũng đã được báo cáo. Nhiều vấn đề trong số này có thể được sử lý bằng các kỹ thuật can thiệp nội mạch.
Tỷ lệ tái can thiệp cần thiết sau khi đặt stent do di chuyển dụng cụ hoặc endoleak là 3,6% đến 24% và phụ thuộc vào thời gian theo dõi. Trong một nghiên cứu trên 585 bệnh nhân, 12% cần can thiệp lại khi theo dõi trung bình 5,6 tháng. Nguy cơ tái can thiệp khác nhau tùy thuộc vào chỉ định can thiệp ban đầu ở mức 21,3% đối với lóc tách cấp tính, 16,7% đối với lóc tách mạn tính, 10,8% đối với phình động mạch chủ thoái hóa, 8,1% đối với chấn thương và 1,5% đối với loét xuyên thành ĐMC. Đối với phình động mạch chủ thoái hóa, chủ yếu cần can thiệp lại để điều trị endoleak type I và type III. Việc sửa chữa sử dụng các thiết bị tiên tiến (có nhánh bên, đục lỗ…) có thể có tỷ lệ tái can thiệp cao hơn.
Tỷ lệ tử vong do mọi nguyên nhân trong một năm ở những bệnh nhân được điều trị phình động mạch chủ và tách thành động mạch chủ lần lượt là 20% và 10%. Những kết quả này không nên được so sánh trực tiếp với kết quả trước đây sau khi phẫu thuật sửa chữa. Các bệnh nhân trong loạt bệnh này có gánh nặng bệnh tật đi kèm nhiều hơn, và nhiều người không phải là lựa chọn để phẫu thuật. Thời gian theo dõi ngắn hạn chế so sánh trực tiếp với hiệu quả lâu dài của việc sửa chữa phẫu thuật thành công.
8. KẾT QUẢ CỦA CAN THIỆP VÀ BẰNG CHỨNG TỪ CÁC NGHIÊN CỨU LỚN
8.1. Các nghiên cứu so sánh giữa can thiệp nội mạch và phẫu thuật ở nhóm phình ĐMC ngực
Cheng D và cộng sự dựa trên phân tích gộp 42 nghiên cứu trên 5.888 bệnh nhân so sánh giữa can thiệp nội mạch và phẫu thuật cho thấy tỷ lệ tử vong do mọi nguyên nhân ở nhóm can thiệp thấp hơn so với phẫu thuật (OR: 0,44 khoảng tin cậy 95%: 0,33-0,59), biến chứng liệt tuỷ thấp hơn (OR: 0.42, 95% CI: 0,28 to 0,63).
Walsh và cộng sự nghiên cứu tổng quan hệ thống trên 17 nghiên cứu với tổng 1109 bệnh nhân (538 bệnh nhân can thiệp nội mạch) cho thấy tỷ lệ tử vong chu phẫu ở nhóm can thiệp nội mạch là 5,57% thấp hơn so với nhóm phẫu thuật là 16,5% với (OR: 0,39; 95% CI 0,228 – 0,578 P < 0,001), Các thương tổn thần kinh ở nhóm can thiệp là 5,4% còn ở nhóm phẫu thuật là 14% (0,39; 95% CI 0,25- 0,62; P <0,0001).
8.2. Can thiệp nội mạch ở bệnh nhân tách thành động mạch chủ Stanford B cấp có biến chứng
Qin và cộng sự đã thực hiện nghiên cứu đơn trung tâm của họ với 152 bệnh nhân tách thành ĐMC có biến chứng được can thiệp đặt Stent Graft thành công về mặt kỹ thuật đạt 94,7%, tỷ lệ tử vong trong viện là 2%, tỷ lệ đột quỵ 1,3% và tỷ lệ liệt 2 chân là 1,3%. tỷ lệ rò type I là 2,6% và tỷ lệ tách ngược là 1,3%.
Fattori và cộng sự tổng kết từ nghiên cứu sổ bộ 290 bệnh nhân đã báo cáo tỷ lệ tử vong cao hơn một chút là 10,9%, tỷ lệ đột quỵ (2,3%) và liệt (1,3%) vẫn ở mức thấp. Theo dõi dài hạn cho thấy có tới 30,6% bệnh nhân cần được tái can thiệp lần 2 và 13,4% bệnh nhân xuất hiện có rò. Tỷ lệ tử vong sau 5 năm là 15,5%.
8.3. Can thiệp nội mạch ở bệnh nhân tách thành động mạch chủ type B không biến chứng
Nghiên cứu INSTEAD (The INvestigation of STEnt grafts in patients with Aortic Dissection) thực hiện trên 140 bệnh nhân tách thành ĐMC có tình trạng lâm sàng ổn định không có hội chứng thiếu máu tạng một cách ngẫu nhiên được can thiệp nội mạch và một nhóm tiếp tục điều trị nội khoa với huyết áp mục tiêu dưới 120/80 mmHg. Kết quả sau 2 năm theo dõi không có sự khác biệt về tỷ lệ sống còn giữa 2 nhóm (tỷ lệ sống còn ở nhóm điều trị nội khoa đơn thuần là 89% so với nhóm đặt Stent Graft là 96%) tuy nhiên nhóm được can thiệp động mạch chủ tỷ lệ tái cấu trúc động mạch chủ cao hơn so với nhóm điều trị nội khoa (91,3% so với 19,4%). Tiếp tục theo dõi sau 5 năm trong nghiên cứu (INSTEAD – XL) nhóm được can thiệp đặt Stent Graft có tỷ lệ tử vong liên quan đến ĐMC thấp hơn so với nhóm điều trị nội khoa đơn thuần. So sánh về mức độ tái cấu trúc động mạch chủ thì cho thấy nhóm điều trị nội khoa chỉ có 22% bệnh nhân được huyết khối lòng giả hoàn toàn so với nhóm can thiệp đạt 90,6% bệnh nhân được huyết khối hoàn toàn lòng giả.
Nghiên cứu ADSORD (The Acute Dissection: Stent-graft OR Best medical therapy) là thử nghiệm ngẫu nhiên có đối chứng ở châu Âu những bệnh nhân tách thành ĐMC type B cấp không có biến chứng với tiêu chí đánh giá lòng giả không được huyết khối hoàn toàn hoặc không có huyết khối lòng giả sau 1 năm theo dõi, giãn động mạch chủ > 5 mm, hoặc đường kính chỗ giãn nhất ĐMC đoạn xuống > 55 mm, vỡ động mạch chủ, biến cố tụ máu ngoài lớp áo ngoài ĐMC trên chẩn đoán hình ảnh. Nghiên cứu gồm 60 bệnh nhân chia mỗi nhóm 30 bệnh nhân. Kết quả sau 1 năm:

Chú thích: TEVAR: Can thiệp sửa chữa động mạch chủ; BMT: Điều trị nội khoa tối ưu.
Khi đưa vào nghiên cứu giữa 2 nhóm không có sự khác biệt về đường kính lòng giả lớn nhất trung bình tương tự nhau (Nhóm có can thiệp 23,9 mm so với nhóm điều trị nội khoa 22,1 mm, p = 0,791) và đường kính lòng thật lớn nhất không khác nhau (nhóm can thiệp 22,5 so với nhóm điều trị nội khoa 23,6 mm, p = 0,83) tuy nhiên sau 1 năm theo dõi đường kính lòng giả lớn nhất trung bình của nhóm can thiệp nhỏ hơn nhóm điều trị nội khoa (18,5 mm so với 25,1 mm, p < 0,001) và đường kính lòng thật lớn nhất của nhóm can thiệp lớn hơn nhóm điều trị nội khoa đơn thuần (32,2 mm so với 25,5 mm với p < 0,001)
Đường kính lòng giả lớn nhất ở nhóm can thiệp giảm theo thời gian (giảm 7,0 mm) trong khi nhóm điều trị nội khoa thì đường kính này tăng lên (tăng 4,3 mm). Đường kính lòng thật lớn nhất ở nhóm can thiệp tăng 8,4 mm so với nhóm điều trị nội khoa 1,9 mm với p = 0,022.
9. CHĂM SÓC VÀ THEO DÕI SAU CAN THIỆP
9.1. Theo dõi ngay sau TEVAR
Khi thủ thuật được hoàn thành, bệnh nhân được chuyển đến một cơ sở theo dõi các biến chứng thần kinh và tình trạng huyết động nhằm phát hiện các biến chứng như đột quỵ, thiếu máu cục bộ tủy sống hoặc thiếu máu cục bộ tứ chi.
Trong trường hợp không có biến chứng, việc hồi phục thường nhanh chóng và bệnh nhân chỉ cần nằm viện từ hai đến ba ngày trước khi xuất viện.
9.2. Theo dõi lâu dài sau TEVAR
Chụp cắt lớp vi tính (CT) động mạch thường được thực hiện trong vòng một tháng sau khi thực hiện thủ thuật, sau đó đánh giá bằng hình ảnh sau sáu tháng và hàng năm sau đó. Can thiệp nội mạch động mạch chủ ngực (TEVAR) ở những bệnh nhân có giải phẫu phức tạp cần được theo dõi nghiêm ngặt hơn. CT không cản quang cho phép đo đường kính túi phình và trong hầu hết các trường hợp là đủ để ghi nhận loại trừ bệnh lý phình ĐMC hiệu quả. Chụp cộng hưởng từ là một phương pháp thay thế, mặc dù MRI có khả năng áp dụng hạn chế ở những bệnh nhân bị rối loạn chức năng thận.
Tái can thiệp động mạch chủ có thể cần thiết ở một số bệnh nhân sau khi can thiệp nội mạch ĐMC ngực. Khi có bằng chứng của Endoleak type I và III cần can thiệp ngay lập tức. Endoleak type II có thể chỉ cần quan sát theo dõi nếu túi phình không giãn ra.
10. TÓM TẮT
Việc can thiệp sửa chữa động mạch chủ ngực có thể được chỉ định cho các bệnh lý khác nhau của động mạch chủ ngực. Đối với những bệnh nhân có hoặc không có liên quan đến động mạch chủ bụng, can thiệp nội mạch đã được chấp nhận như một giải pháp thay thế hợp lý cho phẫu thuật mở. Mặc dù có tỷ lệ tái can thiệp đáng kể sau khi đặt Stent graft, tỷ lệ biến cố chu phẫu giảm của phương pháp can thiệp nội mạch làm cho kỹ thuật ngày càng được ưu tiên chỉ định.
Đánh giá nguy cơ trước can thiệp của bệnh nhân được can thiệp nội mạch ĐMC ngực đòi hỏi phải đánh giá nguy cơ chung và đánh giá định lượng và định tính tỉ mỷ về giải phẫu cung động mạch chủ và động mạch chủ xuống để xác định sự phù hợp cho việc can thiệp nội mạch.
Các dụng cụ can thiệp ĐMC có cấu tạo gồm các thành phần sau (hệ thống đưa dẫn, phần thân chính và phần mở rộng). Can thiệp nội mạch ĐMC được thực hiện bằng cách đưa dẫn dụng cụ đến vị trí và triển khai tuần tự đặt các thành phần thiết bị. Mặc dù các biến thể tồn tại từ thiết bị này sang thiết bị khác, không có lợi thế rõ ràng của thiết bị này so với thiết bị khác. Tất cả các dụng cụ can thiệp nội mạch đã được phê duyệt đã chứng minh thành công ngắn hạn và trung hạn trong điều trị phình động mạch chủ ngực.
Theo dõi định kỳ bằng các phương tiện chẩn đoán hình ảnh là bắt buộc sau thủ thuật can thiệp nội mạch ĐMC ngực để đánh giá tính toàn vẹn và vị trí của dụng cụ. Chụp cắt lớp vi tính để đánh giá dụng cụ khi theo dõi ban đầu, sau đó 6 và 12 tháng sau phẫu thuật, và hàng năm sau đó.
Tỷ lệ tử vong quanh phẫu thuật với đặt Stent graft ĐMC ngực thế hệ thứ hai trong các trường hợp có kế hoạch là thấp (<3%). Tỷ lệ tử vong quanh thủ thuật ở những bệnh nhân can thiệp nội mạc động mạch chủ ngực vì các lý do cấp cứu, chẳng hạn như do vỡ động mạch chủ hoặc tách thành động mạch chủ thì cao hơn. Các biến chứng chu phẫu cụ thể đối với việc đặt Stent graft liên quan đến vị trí đặt, đường vào mạch máu, thiếu máu cục bộ liên quan đến huyết khối tắc mạch trong quá trình đặt, hoặc do hậu quả của việc che các nhánh bên động mạch chủ. Nguy cơ thiếu máu cục bộ tủy sống tương đương với phẫu thuật mở với tỷ lệ từ 3% đến 11%.
Tái can thiệp không phải là hiếm gặp sau can thiệp nội mạch ĐMC ngực và có liên quan đến endoleak, di chuyển mảnh ghép, và sự tiến triển của bệnh lý ĐMC trước đó. Tiếp tục theo dõi là điều cần thiết để ngăn ngừa các biến cố động mạch chủ muộn.
TÀI LIỆU THAM KHẢO
- Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and man- agement of patients with Thoracic Aortic Disease: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiolo- gy, Society of Thoracic Surgeons, and Society for Vascular Circulation 2010; 121:e266.
- Nienaber CA, Kische S, Rousseau H, et al. Endovascular repair of type B aortic dissection: long-term results of the randomized investiga- tion of stent grafts in aortic dissection Circ Cardiovasc Interv 2013; 6:407.
- Bosiers MJ, Donas KP, Mangialardi N, et al. European Multicenter Registry for the Performance of the Chimney/Snorkel Technique in the Treatment of Aortic Arch Pathologic Ann Thorac Surg 2016; 101:2224.
- Ahmad W, Mylonas S, Majd P, Brunkwall JS. A current systematic evaluation and meta-analysis of chimney graft technology in aortic arch diseases. J Vasc Surg 2017; 66:1602.
- Hajibandeh S, Hajibandeh S, Antoniou SA, et al. Meta-analysis of Left Subclavian Artery Coverage With and Without Revascularization in Thoracic Endovascular Aortic Repair. J Endovasc Ther 2016; 23:634.
- Acher C, Acher CW, Marks E, Wynn M. Intraoperative neuroprotective interventions prevent spinal cord ischemia and injury in thoracic endovascular aortic repair. J Vasc Surg 2016; 63:1458.
- Buth J, Harris PL, Hobo R, et Neurologic complications associated with endovascular repair of thoracic aortic pathology: Incidence and risk factors. a study from the European Collaborators on Stent/Graft Techniques for Aortic Aneurysm Repair (EUROSTAR) registry. J Vasc Surg 2007; 46:1103.8. Scali ST, Beck AW, Butler K, et al. Pathology-specific secondary aortic interventions after thoracic endovascular aortic repair. J Vasc Surg 2014; 59:599.
- Higashigawa T, Kato N, Chino S, et Type A Aortic Dissection After Thoracic Endovascular Aortic Repair. Ann Thorac Surg 2016; 102:1536.
- Chen Y, Zhang S, Liu L, et al. Retrograde Type A Aortic Dissection After Thoracic Endovascular Aortic Repair: A Systematic Review and Meta-Analysis. J Am Heart Assoc 2017;
- Hosaka A, Motoki M, Kato M, et al. Quantification of aortic shagginess as a predictive factor of perioperative stroke and long-term prognosis after endovascular treatment of aortic arch J Vasc Surg 2019; 69:15.
- Perek B, Juszkat R, Kulesza J, Jemielity Stent grafts separation 6 years after endovascular repair of a thoracic aortic aneurysm. J Vasc Interv Radiol 2014; 25:1650.
- Etezadi V, Schiro B, Peña CS, et al. Endovascular treatment of descending thoracic aortic disease: single-center, 15-year experience. J Vasc Interv Radiol 2012; 23:468.
- Ehlert BA, Durham CA, Parker FM, et Impact of operative indication and surgical complexity on outcomes after thoracic endovascular aortic repair at National Surgical Quality Improvement Program Centers. J Vasc Surg 2011; 54:1629.
- Pearce BJ, Jordan WD Using IVUS during EVAR and TEVAR: improving patient outcomes. Semin Vasc Surg 2009; 22:172.