Can thiệp tổn thương tái hẹp trong stent
1. ĐẠI CƯƠNG
Mặc dù việc can thiệp đặt stent mạch vành mang lại sự cải thiện đáng kể về kết quả lâm sàng cho bệnh nhân, nhưng kết quả lâu dài của can thiệp đặt stent mạch vành vẫn có hạn chế đáng kể do nguy cơ tái hẹp trong stent (ISR – In Stent Restenosis) theo thời gian. ISR hiện được định nghĩa là tình trạng hẹp >50% liên quan đến stent được đặt trước đó, gặp khoảng 30% tổng số bệnh nhân được đặt stent kim loại trần (BMS-Bare Metal Stent). Tỷ lệ tái hẹp trong stent (ISR) cao liên quan đến stent kim loại trần (BMS) dẫn đến sự phát triển của stent phủ thuốc (DES- Drug Eluting Stent).
Bất chấp sự phát triển và hoàn thiện liên tục của công nghệ, từ stent kim loại trần (BMS) tới stent phủ thuốc (DES), tỷ lệ tái hẹp trong stent (ISR) vẫn khá thường gặp, chiếm khoảng 10% số ca can thiệp mạch vành qua da. Bên cạnh đó, việc áp dụng rộng rãi DES cho các động mạch nhỏ, tổn thương dài, tổn thương mạch vành phức tạp, bệnh tiểu đường và bệnh nhân có phẫu thuật bắc cầu trước đó trên thực tế đã là nguyên nhân dẫn đến một số lượng đáng kể bệnh nhân tái hiện tái hẹp của stent phủ thuốc (DES-ISR) trong thực hành lâm sàng hiện đại. Sự xuất hiện của DES- ISR là có nguy cơ và là thách thức cho điều trị tối ưu.
Có nhiều cơ chế gây ra ISR, bao gồm các yếu tố liên quan đến sinh học, cơ học, bệnh nhân và kỹ thuật của bác sĩ can thiệp. Các yếu tố cơ học chính gồm stent không giãn nở tốt hoặc gãy, trong khi các yếu tố sinh học bao gồm viêm tại chỗ dẫn đến tăng sinh nội mạc mới và xơ vữa tân mạch muộn. Hình ảnh nội mạch động mạch vành rất quan trọng để xác định cơ chế của ISR và điều chỉnh điều trị cho phù hợp. Các phương thức điều trị được đề xuất gồm đánh giá tình trạng vôi hóa và nong bóng áp lực cao, tiếp tục can thiệp mạch vành qua da với DES cho các trường hợp tái hẹp, nong bóng phủ thuốc, điều trị xơ vữa bằng laser hoặc khoan cắt các mảng xơ vữa, xạ nội mạch và tái thông mạch bằng phẫu thuật.
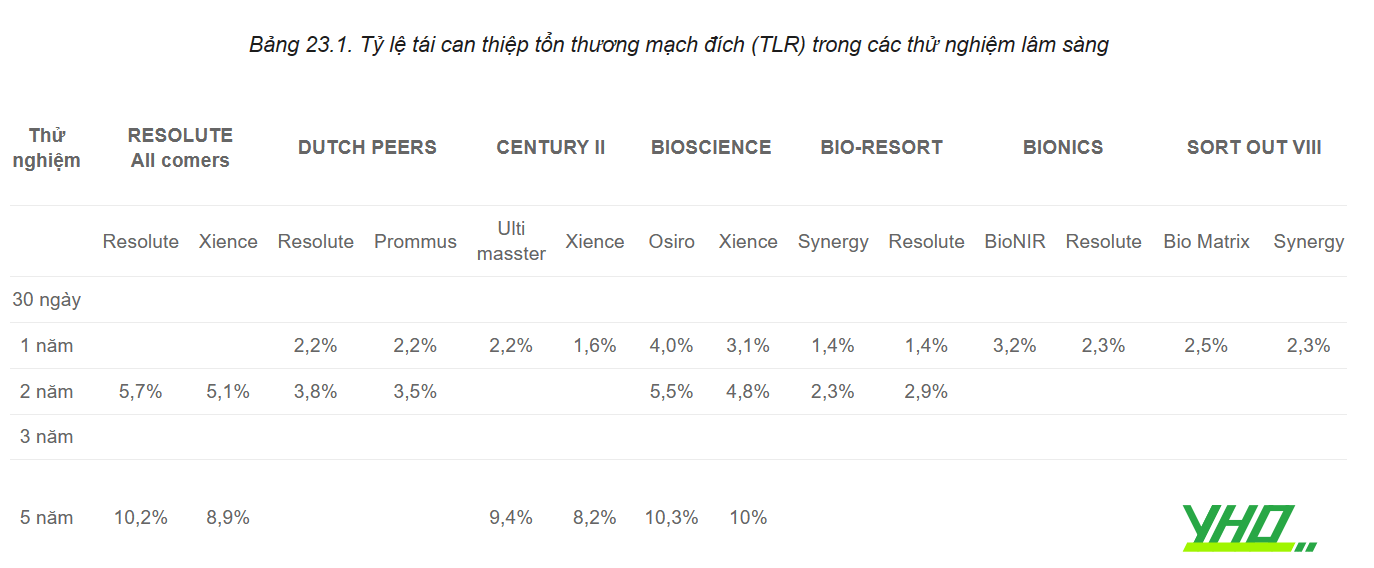
Bảng 23.1. Tỷ lệ tái can thiệp tổn thương mạch đích (TLR) trong các thử nghiệm lâm sàng

2. ĐỊNH NGHĨA, BỆNH SINH VÀ HÌNH THÁI TỔN THƯƠNG
2.1. Định nghĩa
Tái hẹp trong stent (ISR) được định nghĩa là sự tái hẹp dần dần trong stent được can thiệp trước đó. Trên chụp động mạch vành qua da, ISR là tình trạng hẹp >50% đường kính mạch trong stent và/hoặc rìa (quãng 5mm tiếp giáp với phía của stent). Định nghĩa lâm sàng của ISR bao gồm tình trạng hẹp >50% đường kính trong stent và một trong những điều sau: (1) các triệu chứng lâm sàng của cơn đau thắt ngực tái phát, (2) các dấu hiệu của thiếu máu cơ tim (như biến đổi điện tâm đồ), (3) có tình trạng thiếu máu động mạch vành với phân suất dự trữ vành (FFR – Fractional Flow Reserve) <0,80, (4) khảo sát bằng siêu âm trong lòng động mạch vành (IVUS – Intravascular Ultrasound) thì diện tích mặt cắt ngang tối thiểu dưới 4 mm2 (hoặc 6 mm2 đối với thân chung động mạch vành trái), hoặc (5) tái hẹp với đường kính lòng ống giảm ≥70% ngay cả khi không có triệu chứng hoặc dấu hiệu lâm sàng.
Qua nhiều năm, stent phủ thuốc (DES) đã thể hiện được tính ưu việt so với BMS, điều này đã dẫn tới sự hầu như không còn bệnh nhân được can thiệp đặt stent loại stent kim loại trần (BMS) trong thực hành lâm sàng thường quy. Thế hệ DES thứ hai đã được cải tiến trên công nghệ trước đó với sự thay đổi về thiết kế của stent, thành phần hợp kim (bao gồm cả độ dày của mắt stent), polymer và thuốc phủ trên stent. Những thay đổi này có liên quan đến việc cải thiện hiệu quả của DES thế hệ thứ hai so với thế hệ đầu tiên. Theo cơ sở dữ liệu từ nghiên cứu sổ bộ tim mạch quốc gia cho thấy có khoảng 10% các ca can thiệp mạch vành qua da ở Hoa Kỳ là để điều trị ISR. Thời gian xuất hiện của DES-ISR đã trở nên dài hơn, có thể kéo dài vài năm sau khi đặt stent. Sự tích lũy ISR trong nhiều năm, cùng với tình trạng xơ vữa mạch muộn và chậm tăng sinh nội mạc, có thể góp phần vào tỷ lệ ISR tương đối ổn định gặp phải trong thực hành lâm sàng mặc cho những cải tiến gần đây trong công nghệ DES. So với tái thông mạch các tổn thương nguyên phát, việc điều trị DES-ISR thường tăng độ phức tạp với kết quả lâm sàng xấu hơn.
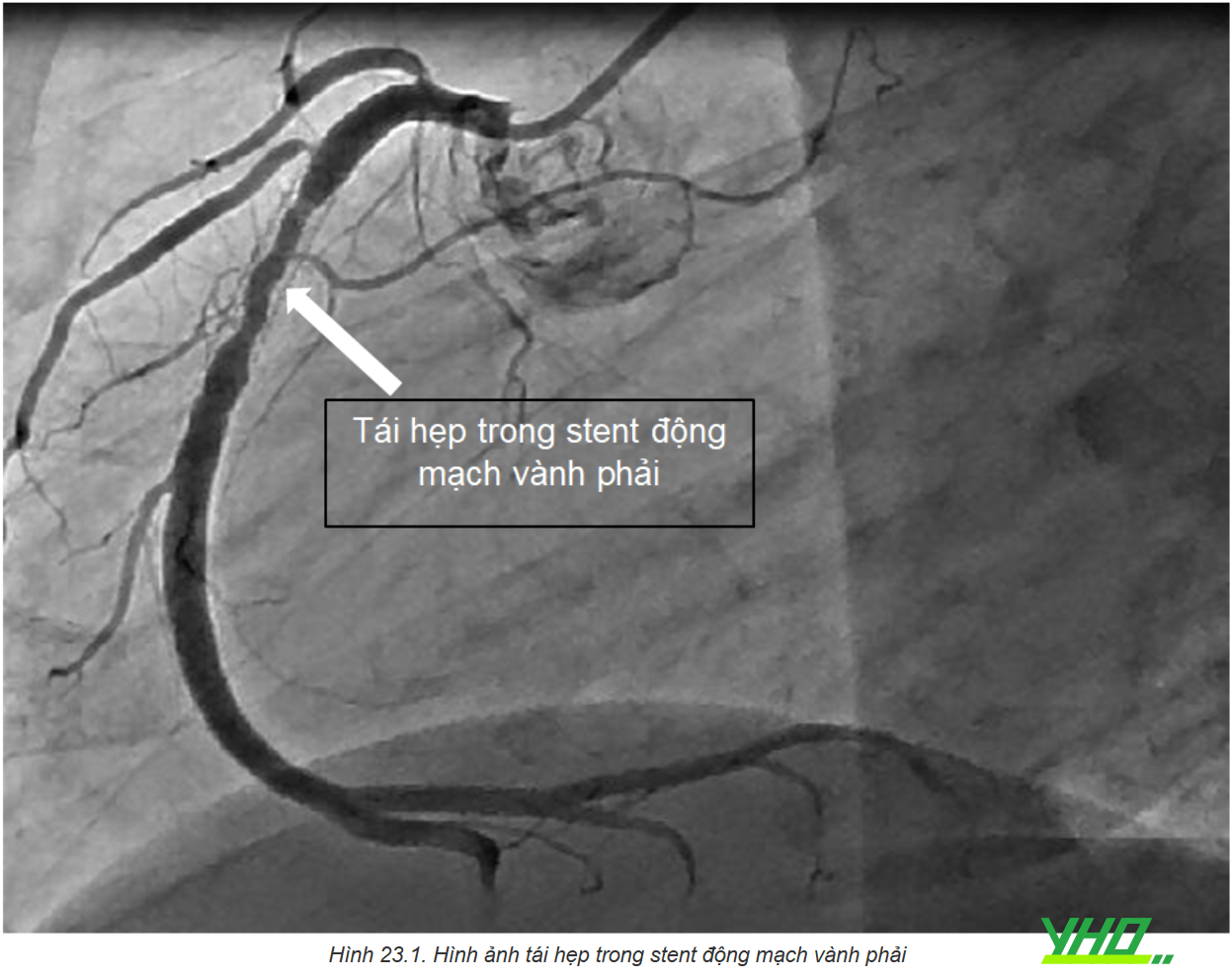
2.2. Bệnh sinh của tái hẹp trong stent phủ thuốc (DES-ISR)
Nhiều cơ chế kinh điển đối với bệnh sinh của tái hẹp trong stent kim loại trần (BMS-ISR) bao gồm các yếu tố sinh học, cơ học và kỹ thuật can thiệp, các cơ chế này cũng áp dụng cho DES-ISR. Trong khi DES giảm thiểu tăng sinh lớp áo trong mới so với BMS, thì phản ứng viêm tại chỗ và sự chậm lành nội mạc là những nguyên nhân chính dẫn đến sự hình thành tăng sinh lớp áo trong với DES-ISR. Có sự khác biệt đáng kể giữa BMS-ISR và DES-ISR về biểu hiện lâm sàng, bệnh sinh, hình thái tổn thương và đáp ứng với can thiệp. Trong BMS-ISR, mô lớp áo trong tăng sinh bao gồm các tế bào cơ trơn mạch máu và chất nền ngoại bào theo kiểu lan tỏa, thường gặp phải khoảng 6 tháng sau khi can thiệp. Ngược lại, với DES có lớp phủ thuốc gây ức chế và làm tăng sinh nội mạc muộn hơn so với BMS, hiện tượng này có thể kéo dài trong nhiều năm. Hơn nữa, DES có liên quan đến tổn thương khu trú hơn, thường ở vị trí các cạnh của stent so với đặc tính lan tỏa của BMS-ISR.
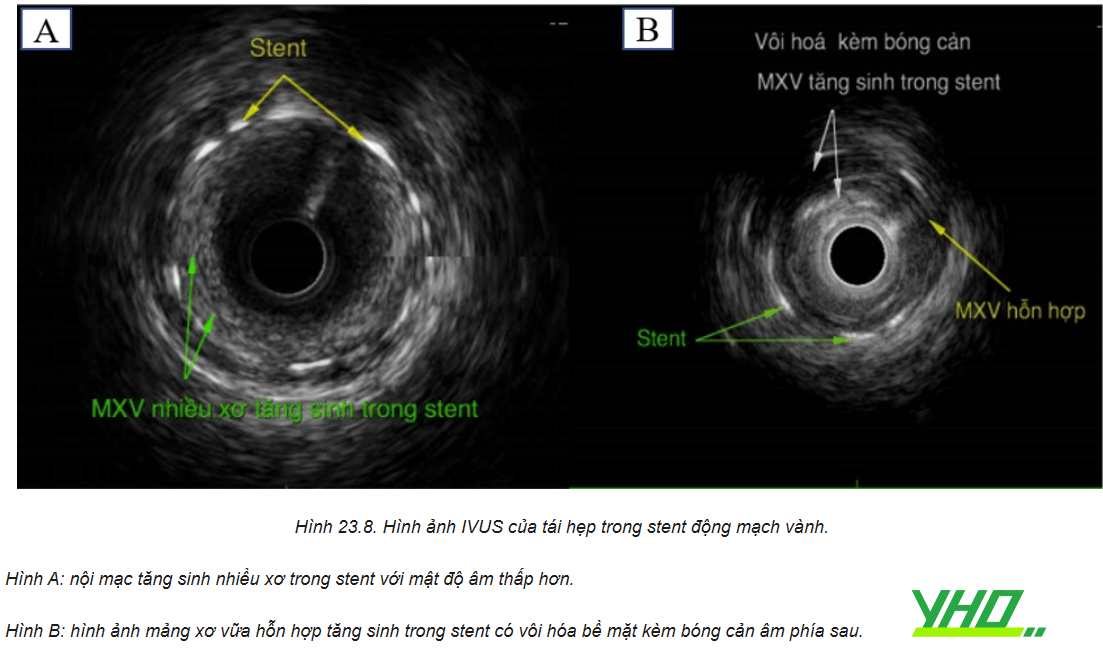
Nghiên cứu IVUS cho thấy trong khi BMS-ISR có mức độ cản âm của mô tín hiệu cao và đồng nhất, DES-ISR thường được thấy cản âm nhiều lớp với mức độ không đồng nhất. Bên cạnh đó, các nghiên cứu OCT (optical coherence tomography – chụp cắt lớp quang học (tạm dịch)) đã có cái nhìn chuyên sâu về sự khác biệt giữa ISR sớm được đặc trưng bởi tăng sản lớp nội mô đồng nhất, còn ISR muộn đặc trưng bởi các mảng xơ vữa tân mạch với vỏ xơ mỏng và tăng sinh lớp áo trong giàu lipid.
Xơ vữa tân sinh có thể xảy ra nhiều năm sau khi đặt stent và được đặc trưng bởi sự tích tụ của các đại thực bào có bọt lipid trong nội mạc, có hoặc không có sự hình thành lõi hoại tử, vôi hóa, có thể xảy ra nhiều năm sau khi đặt stent. Tái hẹp trong stent DES có thể gây ra bởi tỷ lệ cao mắc xơ vữa mạch tân sinh và mảng xơ vữa vỏ mỏng lan tỏa trong stent với DES, đặc biệt là DES thế hệ đầu tiên. Siêu âm trong lòng mạch là hạn chế để đánh giá mảng xơ vữa tân tạo; chụp OCT là chẩn đoán hình ảnh ưu tiên dùng để phát hiện xơ vữa tân mạch.
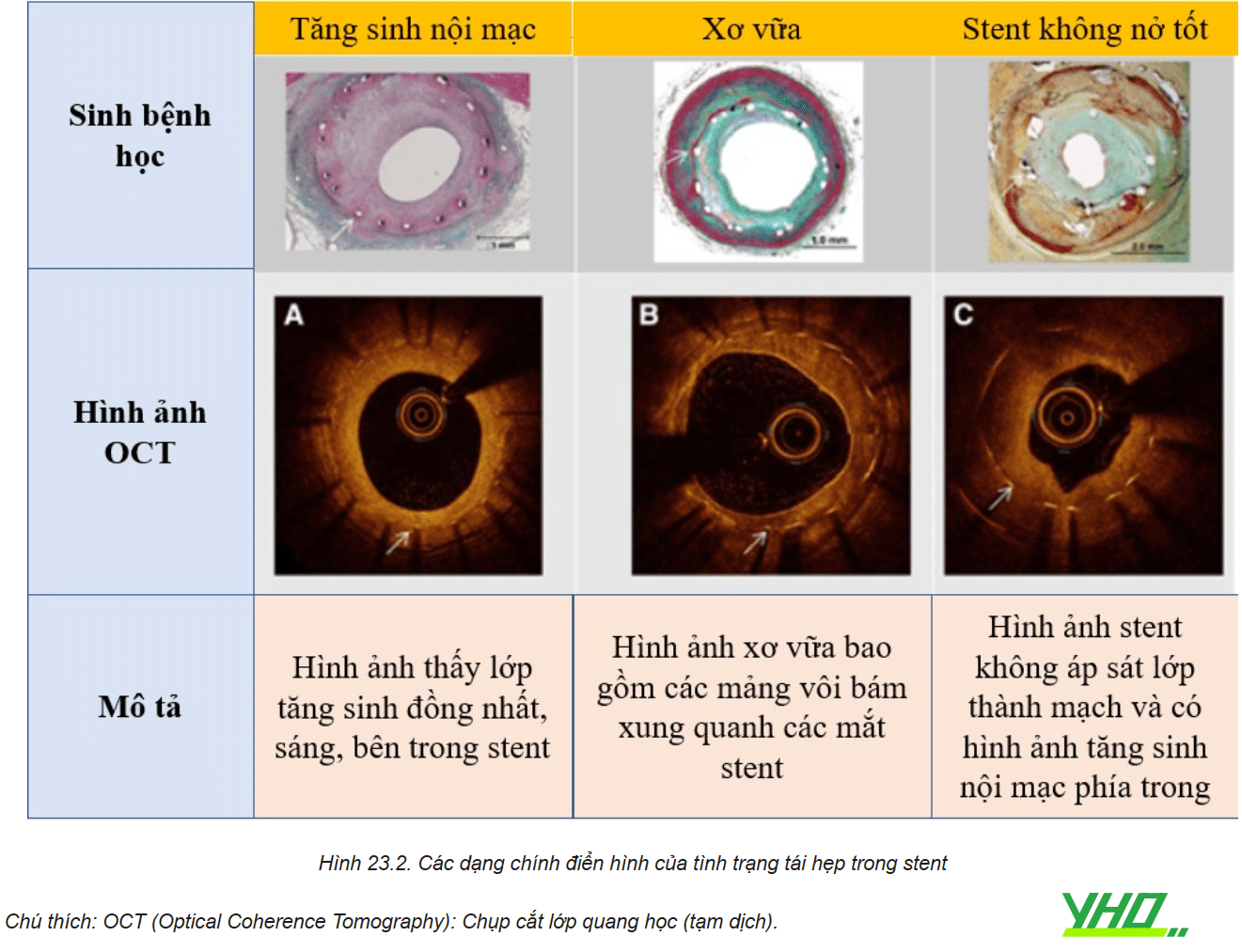
2.3. Phân loại hình thái tái hẹp trong stent (ISR)
Trong khi ISR có thể được xác định bằng chụp mạch đơn thuần, chẩn đoán hình ảnh trong lòng mạch vành có độ nhạy cao hơn để phát hiện và mô tả ISR đồng thời cung cấp cái nhìn sâu sắc về cơ chế của ISR. Phân loại chụp mạch được mô tả của Mehran và cộng sự là đặc hiệu cho BMS-ISR và 4 hình thái ISR. Phân loại bao gồm type 1: tái hẹp khu trú khi chiều dài vị trí tái hẹp <10mm, chia ra 4 dưới type khác; type 2: tái hẹp lan tỏa khi chiều dài vị trí tái hẹp >10mm; type 3: tái hẹp >10mm và mở rộng ra ngoài phía đầu stent; type 4: tổn thương tái hẹp gây tắc hoàn toàn trong stent.
Lược đồ phân loại này, dựa trên các yếu tố tiên lượng về tái thông mạch máu đối với BMS, ít liên quan đến DES. Các tiêu chí này không cung cấp cái nhìn sâu sắc về cơ chế thất bại của stent và không chỉ định điều trị áp dụng.

Do đó, chúng tôi đề xuất một hệ thống phân loại hiện đại hóa cụ thể cho DES-ISR (Bảng 23.2), dựa trên cơ chế hoạt động cụ thể của sự tái hẹp, để điều chỉnh liệu pháp thích hợp. Phân loại Waksman ISR phân biệt giữa các nguyên nhân cơ học (Loại I), sinh học (Loại II) hoặc hỗn hợp (Loại III), bao gồm tắc hoàn toàn mạn tính (Loại IV) và các tổn thương của DES-ISR đã được điều trị trước đó với > 2 stent (Loại V). Chúng tôi cho rằng điều quan trọng là phải phân loại chính xác và cá nhân hóa điều trị DES-ISR trên cơ sở phân loại này để cải thiện kết quả lâm sàng.

2.4. Các yếu tố nguy cơ của DES-IRS
Yếu tố liên quan làm tăng nguy cơ tái hẹp trong các mô hình khác nhau bao gồm bệnh cảnh lâm sàng (STEMI, NSTEMI, cơn đau thắt ngực không ổn định diễn ra hàng ngày), đặc điểm của bệnh nhân như tuổi từ 55 đến 60, có đái tháo đường kèm theo, có tiền sử can thiệp trước đó, giới nam, tổn thương nhiều nhánh động mạch vành, vị trí tổn thương (thân chung động mạch vành trái không được bảo vệ, cầu nối tĩnh mạch) và các đặc điểm của thủ thuật can thiệp (đường kính stent nhỏ hơn 2,5 mm, tổng chiều dài stent lớn hơn 40 mm).
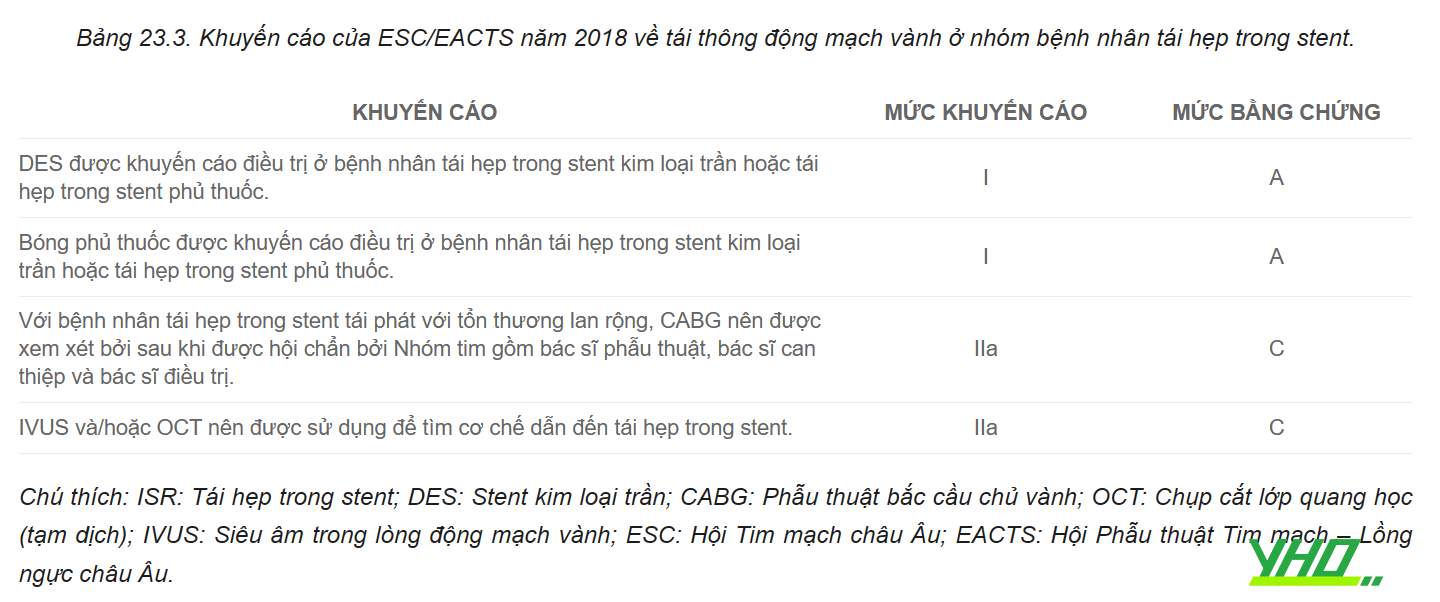
3. CHỈ ĐỊNH VÀ CHỐNG CHỈ ĐỊNH TÁI THÔNG ĐỘNG MẠCH VÀNH Ở BỆNH NHÂN TÁI HẸP TRONG STENT
3.1. Chỉ định và lựa chọn bệnh nhân
Chỉ định can thiệp tổn thương tái hẹp trong stent phải tuân theo các chỉ định tái tưới máu theo các khuyến cáo hiện hành của hội chứng vành cấp, hội chứng mạch vành mạn tính. Quyết định lựa chọn giữa PCI hay CABG ở bệnh nhân tái hẹp trong stent cần phải dựa vào nhiều yếu tố như: đặc điểm tổn thương giải phẫu, điểm SYNTAX; bệnh cảnh lâm sàng cụ thể, nguy cơ chảy máu; nguồn lực, kinh nghiệm của trung tâm và bác sĩ can thiệp; mong muốn của người bệnh…

4. DỤNG CỤ CAN THIỆP
Nhìn chung, can thiệp tổn thương tái hẹp trong stent ĐMV sử dụng những dụng cụ tương tự như can thiệp ĐMV cơ bản, gồm có: sheath đường vào mạch máu, guiding can thiệp, wire can thiệp, bóng nong, stent, và có thể sử dụng một số dụng cụ hỗ trợ khác như: IVUS, OCT, dụng cụ khoan phá mảng xơ vữa, xạ nội mạch,… Cụ thể có một số điểm cần lưu ý như sau:
4.1. Lựa chọn bóng nong
Phương pháp nong mạch bằng bóng là đại diện cho can thiệp ban đầu được thực hiện cho cả BMS-ISR và DES-ISR. Tuy nhiên, thủ thuật có các biến chứng liên quan đến cạnh stent và có tỷ lệ ISR tái phát cao (>50%). Việc sử dụng bóng áp lực cao là quan trọng nhất đối với các nguyên nhân cơ học. Phương pháp nong mạch bằng bóng áp lực cao có thể được sử dụng cho việc nong rộng stent bằng bóng với áp suất cao tới 40 atm. Nên chọn các bóng ngắn, không co giãn và có thể ngăn ngừa tổn thương cơ học theo chiều dọc. Tuy nhiên, cần cố gắng tránh các biến chứng liên quan đến cạnh stent như tình trạng lóc tách hoặc bóng bị trôi ra ngoài stent.
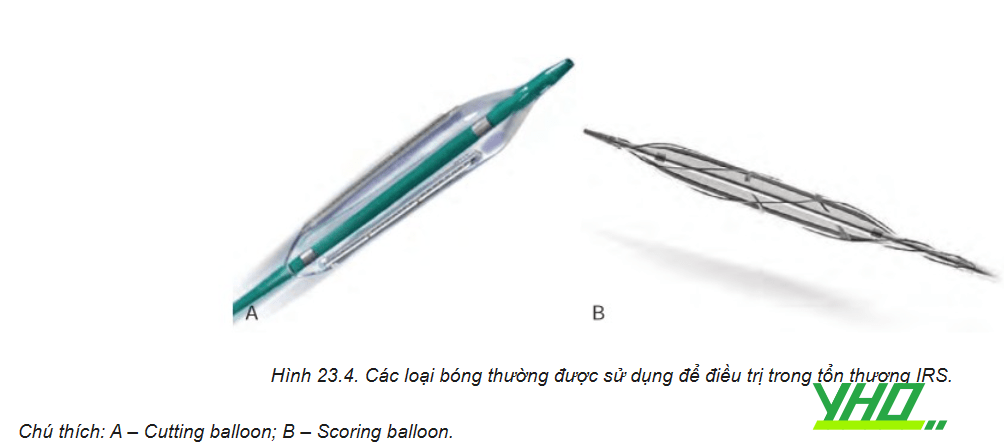
Bóng có lưới kim loại (scoring balloon) đã được chứng minh làm giảm thiểu tổn thương cơ học vào thành mạch và sự trôi bóng thường khi bơm bóng lên trên tổn thương mô sẹo xơ. Ở những bệnh nhân mắc DES-ISR, điều chỉnh đáp ứng tân tạo nội mạc bằng scoring balloon cải thiện hiệu quả kháng viêm của liệu pháp DCB (bóng phủ thuốc) đã được chứng minh bằng cải thiện tỷ lệ tái hẹp lòng mạch muộn thấp hơn, với kết quả lâm sàng tương tự sau 6 tháng ở những bệnh nhân đang điều trị tiền nong bằng scoring balloon hoặc liệu pháp tiêu chuẩn.
Bóng có gắn lưỡi dao (cutting balloon) sử dụng nhiều lưỡi để cắt khía tổn thương và cố định bóng tại đúng vị trí tránh hiện tượng trôi trượt bóng ra đầu stent gây lóc tách thành ĐMV phía đầu stent.
4.2. Các hệ thống khoan phá mảng xơ vữa với các tổn thương ISR vôi hóa
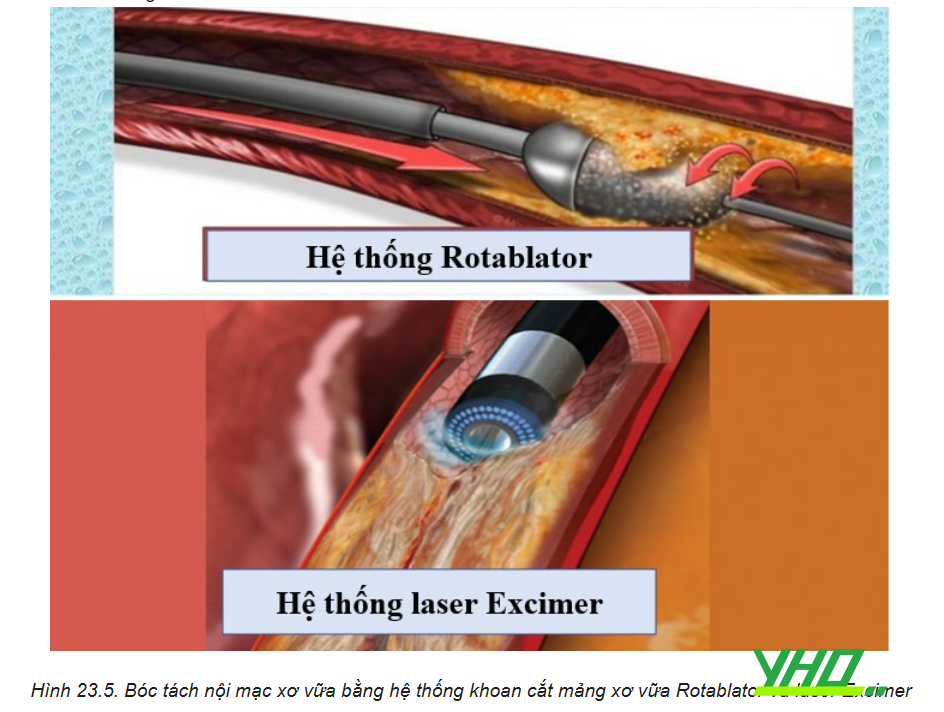
Các thiết bị làm giảm kích thước mảng xơ vữa và phì đại lớp áo trong trong tổn thương IRS là khoan bào (với xơ vữa vôi hóa) hoặc hiệu ứng laser. Trong khi dữ liệu lâm sàng còn hạn chế về việc sử dụng kỹ thuật trên cho DES-ISR, mở rộng thành mạch bằng khoan có thể mang lại lợi ích trong một số trường hợp như xơ vữa tân tạo vôi hóa hoặc stent không giãn nở bằng nong bóng áp lực cao. Nhiệt tạo ra trong quá trình khoan có thể tạo điều kiện cho sự giãn nở của mạch máu tổn thương, nhưng cần thận trọng để ngăn chặn các hạt kim loại bong ra hoặc mắc vào trong tổn thương nở kém.
Bóc nội mạc bằng laser Excimer tạo ra năng lượng ánh sáng đơn sắc, tạo ra nhiệt và sóng xung kích để phá vỡ và bóc tách mảng xơ vữa. Việc tiêm thuốc cản quang để tạo ra tổn thương và mục tiêu vi thể có thể dẫn đến tỷ lệ thành công cao hơn để mở rộng các stent đang bị ép bởi các lớp canxi bên ngoài. Dữ liệu hiện tại chỉ ra rằng kỹ thuật bóc nội mạc được dành tốt nhất để điều trị trước các stent không giãn nở hoặc ISR của các tổn thương vôi hóa.
4.3. Bóng phủ thuốc (Drug-Coated Balloon hay DCB)
Bóng phủ thuốc (DCB) có ưu điểm là tránh phải đặt thêm một lớp vật liệu kim loại khi điều trị ISR và được khuyến nghị bởi các hướng dẫn của Hiệp hội Tim mạch châu Âu như là một lựa chọn điều trị hàng đầu. DCBs sử dụng các loại thuốc ưa mỡ, chẳng hạn như paclitaxel, để ức chế sự tăng sinh lớp áo trong. Kết quả của các thử nghiệm mang tính bước ngoặt đối với DES-ISR so sánh cả DCB và các DES đã được tổng kết lại.
Với những quan tâm mới nhất về DCB với paclitaxel trong các can thiệp mạch ngoại vi và báo cáo về khả năng tử vong cao, chúng ta có thể thấy sự thay đổi khi áp dụng DCB với thuốc nhóm -limus để điều trị DES-ISR. Các nghiên cứu lâm sàng nhỏ sơ bộ sử dụng DCB có phủ sirolimus dựa trên cơ sở cho thấy kết quả sơ bộ đầy hứa hẹn. Tuy nhiên, các thử nghiệm ngẫu nhiên là cần thiết để chứng minh hiệu quả trên DES-ISR.
4.4. Đặt lại stent phủ thuốc (Drug Eluting Stent hay DES)
Một phân tích gộp đánh giá điều trị DES-ISR bằng đặt thêm một stent DES cho kết quả giảm tỷ lệ tái hẹp so với chỉ nong bóng đơn độc. Trong nghiên cứu sổ bộ ở Nhật Bản những sự kiện bất lợi là cao hơn đáng kể ở bệnh nhân điều trị với DCBs mà có >2 lớp stent, trong khi chỉ có sự khác biệt tối thiểu đã được ghi nhận trong các trường hợp giữa những người có 1 hoặc 2 lớp stent trước đó. Điều này chỉ dẫn thực hành của chúng tôi để tránh lớp thứ ba của stent để ủng hộ các phương thức thay thế trong hầu hết các bệnh cảnh lâm sàng. Không có bằng chứng rõ ràng hướng dẫn loại DES nào nên được sử dụng để điều trị ISR- DES và không có sự nhất trí về việc liệu loại stent có nên được thay đổi khi một DES bổ sung được đặt cho DES-ISR hay không. Thử nghiệm RIBS III (Restenosis Intrastent: Bal- loon Angioplasty Versus Elective Stenting) đã đánh giá tác động của việc lựa chọn một DES khác để điều trị ISR, với kết quả lâm sàng và hình ảnh mạch vành tốt hơn khi theo dõi 9 tháng trong nhóm thuần tập nhận được một DES khác loại.
4.5. Xạ trị nội mạch (Vascular Brachytherapy hay VBT)
Liệu pháp xạ nội mạch ức chế sự hình thành tăng sinh nội mạc mạch trong stent bằng cách sử dụng bức xạ β-Strontium-90 phóng xạ một cách cục bộ vị trí tổn thương thông qua cơ chế thủy lực với thiết bị Beta-Cath (Novoste, Norcross, GA), làm giảm phản ứng của mô tăng sinh. Phương pháp này cho kết quả ngắn hạn tốt nhưng về lâu dài có một tỷ lệ nhất định xuất hiện huyết khối. Việc sử dụng VBT hiện có sẵn ở một số lượng hạn chế các cơ sở. Negi và cộng sự đã cung cấp báo cáo đầu tiên về một chùm ca bệnh (186 bệnh nhân) được điều trị VBT cho DESs, với tỷ lệ tái thông mạch máu của tổn thương đích là 3,3% sau 6 tháng, 12,1% sau 1 năm và 19,4% sau 3 năm. Trong một nghiên cứu quan sát gần đây báo cáo rằng có sự giảm các biến cố bất lợi nghiêm trọng về tim mạch khi sử dụng liệu pháp điều trị xạ nội mạch để điều trị ISR.
Bóc mảng xơ vữa bằng laser Excimer trước khi VBT có thể cải thiện kết quả lâm sàng. Tuy nhiên, dữ liệu bị hạn chế với kỹ thuật này. VBT chủ yếu được sử dụng cho ISR tái phát và việc sử dụng nó nên được xem xét khi có nhiều lớp stent. Điều trị bằng VBT có thể được lặp lại khi cần thiết, với khoảng cách 12 tháng giữa các lần áp dụng. Sau khi điều trị bằng VBT, do nội mạc hóa chậm, bệnh nhân nên được duy trì điều trị kháng tiểu cầu suốt đời. Bệnh nhân điều trị nhiều lần với xạ nội mạch được đặt thêm stent DES sau đó để điều trị ISR kháng trị sẽ có nguy cơ cao bị tắc stent. Vì vậy, với những bệnh nhân thất bại với VBT, chúng tôi đề xuất điều trị VBT lặp lại, nong bóng trần hoặc nong bóng phủ thuốc
5. TIẾP CẬN CAN THIỆP TỔN THƯƠNG CHỖ TÁI HẸP TRONG STENT
5.1. Các bước tiếp cận tổn thương tái hẹp trong stent
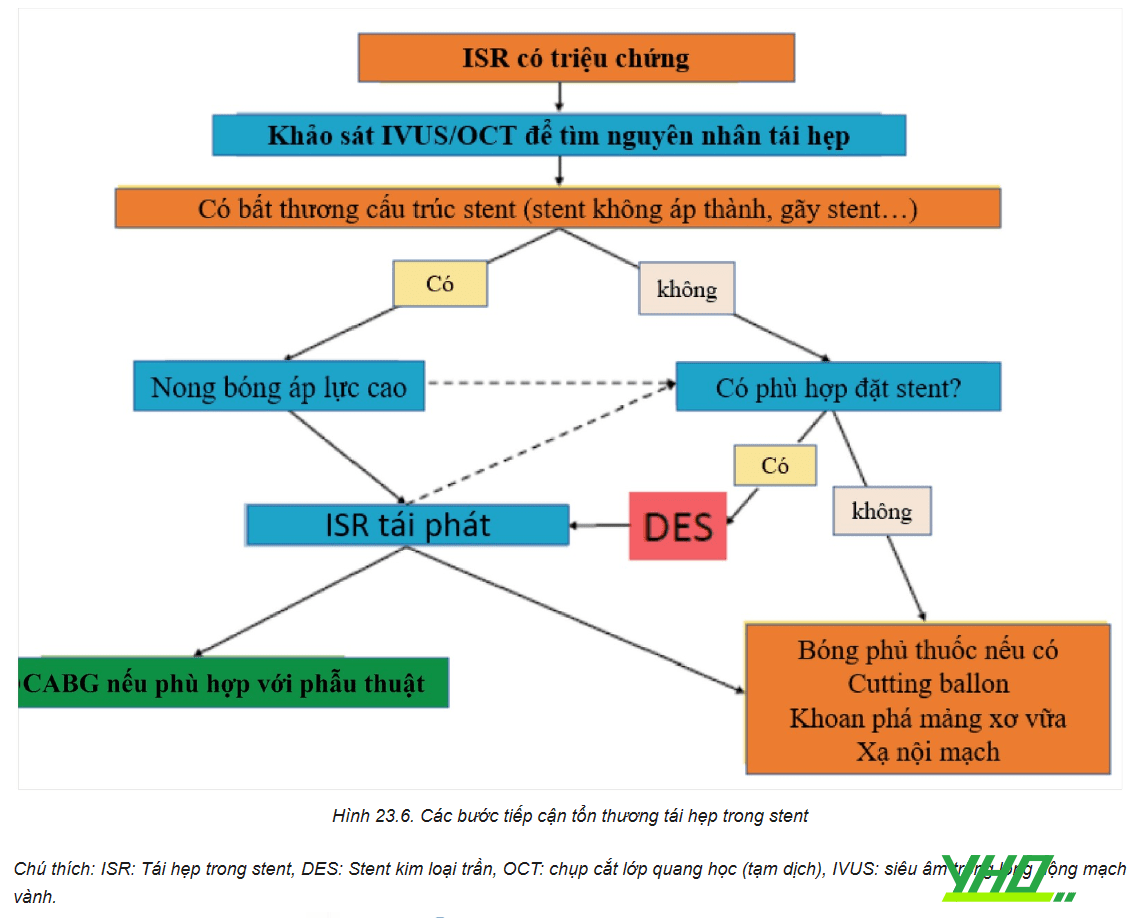
Bước đầu tiên trong việc tiếp cận tổn thương ISR nên là thực hiện chẩn đoán hình ảnh nội mạch bằng IVUS hoặc OCT. Hình ảnh cho phép đánh giá kích thước của stent và đánh giá các nguyên nhân cơ học gây ra ISR, có thể là stent không áp thành hoặc gãy/biến dạng stent. Nếu xác định có nguyên nhân cơ học gây tái hẹp thì sẽ tiến hành nong bóng áp lực cao. Sau đó tiến hành đánh giá tính khả thi của việc đặt DES thứ 2 cho bệnh nhân. Nếu không có bất thường về nguyên nhân cơ học thì tiến hành đánh giá tính khả thi của việc đặt DES thứ 2 cho bệnh nhân. Nếu việc can thiệp đặt thêm DES là khả thi: tiến hành đặt stent bằng DES.
Các trường hợp không phù hợp đặt stent lặp lại thì bác sĩ can thiệp sẽ tiến hành các kỹ thuật thay thế. Trong một số tình huống nhất định, chẳng hạn như ISR tái phát lặp lại với nhiều lớp kim loại stent cũ từ trước hoặc sự cần thiết phải tránh liệu pháp chống tiểu cầu kép lâu dài do nguy cơ chảy máu cao, việc đặt thêm DES là không mong muốn. Trong những tình huống này, bác sĩ can thiệp nên tiến hành các phương pháp thay thế như điều trị nong bóng phủ thuốc, dùng cutting balloon, khoan phá các mảng xơ vữa, xạ nội mạch hoặc chỉ định CABG nếu bệnh nhân phù hợp với phẫu thuật.
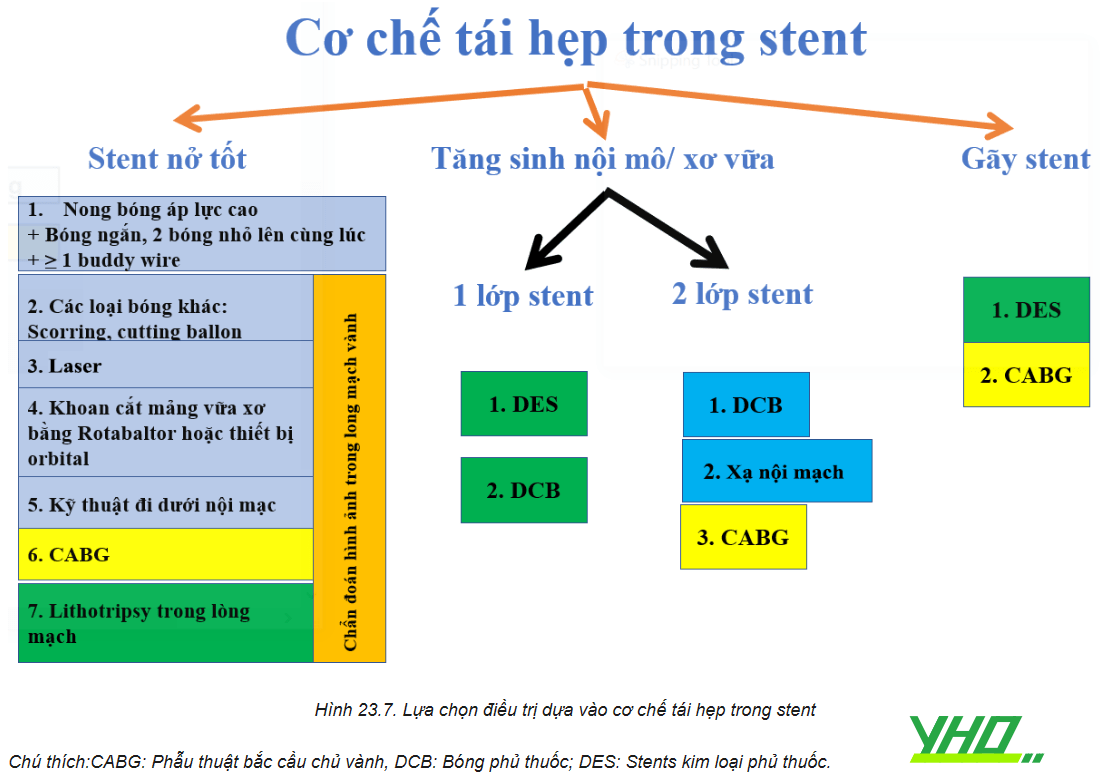
5.2. Vai trò của đánh giá hình ảnh trong lòng mạch
Việc xác định nguyên nhân của ISR bằng IVUS (siêu âm trong lòng mạch) hoặc OCT (chụp cắt lớp quang học) có vai trò quan trọng trong xác định chiến lược điều trị. Hình ảnh nội mạch vành có thể giúp phân biệt giữa nguyên nhân cơ học và nguyên nhân sinh học. Các nguyên nhân cơ học của ISR có thể liên quan đến việc stent không áp thành, kích thước stent nhỏ hơn kích thước lòng mạch thực sự hoặc gãy stent. Stent không nở tốt là một trong những yếu tố dự báo liên quan chặt chẽ nhất của ISR có ý nghĩa về mặt chức năng. Chuẩn bị tổn thương không đầy đủ trong vôi hóa động mạch vành nguyên phát có thể dẫn đến tình trạng nở kém của stent. Vì lý do này, việc xác định và phân loại tổn thương vôi hóa động mạch vành nặng là cần thiết trước khi đặt stent.
Trong trường hợp stent giãn nở kém thì quá trình đánh giá thành phần mô học của mạch vành tổn thương có thể là hướng dẫn lựa chọn thiết bị tối ưu. Mô mềm có nhiều khả năng đáp ứng với điều trị bằng phương pháp nong bóng áp lực cao, trong khi các tổn thương đã hóa vôi có thể cần điều trị bổ trợ, bao gồm các thiết bị khoan cắt Rota hoặc thiết bị phá vỡ cấu trúc mảng xơ vữa bằng sóng siêu âm. Stent đã nở tốt mà tái hẹp do sự tăng sản nội mạc quá mức có thể được điều trị tốt nhất bằng sử dụng bóng cắt mảng xơ vữa (cutting balloon), sau đó là nong bóng phủ thuốc (DCB) nếu có, hoặc đặt thêm DES được phủ loại thuốc khác so với stent trước đây, hoặc liệu pháp chiếu xạ nội mạch (VBT). Hình ảnh nội mạch có thể xác định số lượng lớp stent tại vị trí tổn thương, cũng như đánh giá sự giãn nở của mỗi lớp stent. Việc xác định rõ ràng số lượng các lớp stent bằng hình ảnh nội mạch cho phép lựa chọn phương pháp điều trị tối ưu. Trong trường hợp có nhiều lớp ISR, VBT là lựa chọn điều trị, vì nên tránh có nhiều lớp stent chồng lên stent. Một số nhóm tác giả đề xuất một cách tiếp cận điều trị theo cơ chế của ISR cho DES-ISR.
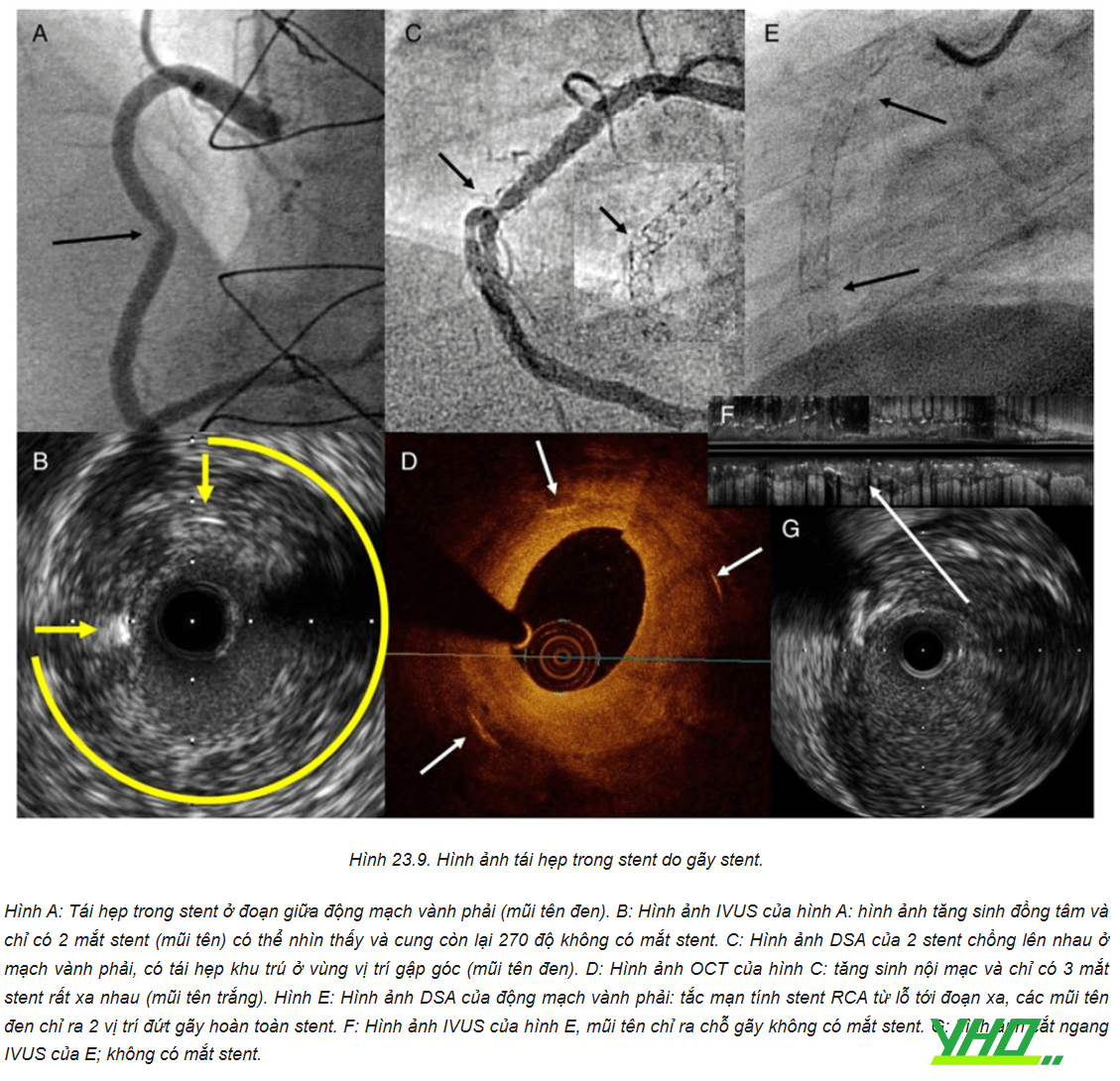
Gãy stent là một nguyên nhân của ISR được đánh giá tốt nhất bằng hình ảnh nội mạch và được đặc trưng bởi sự mất hình ảnh mắt của stent tại vị trí gãy. Tỷ lệ thực sự của gãy stent thường bị đánh giá thấp nhưng đã được báo cáo là từ 1% đến 8%, với tỷ lệ tái hẹp cao đi kèm do các kích thích cơ học cục bộ của mạch vành do stent bị gãy cùng với khả năng cung cấp thuốc tại chỗ giảm thứ phát do sự biến dạng của cấu trúc stent và lớp phủ polymer có thể làm tăng nguy cơ tái hẹp, dẫn đến viêm và tăng sản hệ nội mạc.
5.3. Tiếp cận nhóm tổn thương tắc mạn tính trong stent
Tổn thương tắc hoàn toàn mạn tính (Chronic Total Occlusion – CTO) trong stent chủ yếu do ISR, chiếm khoảng 11%–12% tổng số các ca can thiệp CTO, và là một thách thức trong can thiệp tái thông mạch đặc biệt là các tổn thương LAD có nhánh bên lớn hoặc động mạch RCA xoắn vặn. Mặc dù có tỷ lệ thành công với tổn thương CTO trong stent so với các tổn thương CTO không stent là như nhau, tuy vậy, nguy cơ tái hẹp sau đó ở tổn thương CTO trong stent là cao hơn.
a. Các lưu ý khi tiếp cận tổn thương CTO trong stent
- Kỹ thuật can thiệp với dây dẫn đi dưới nội mạch nên tuyệt đối tránh với các tổn thương CTO trong stent, vì nếu sau stent đi vào lòng thật để tái thông mạch máu sẽ cần phải “đập bẹp” stent cũ trước khi đặt stent mới. Tuy nhiên, việc đập bẹp CTO stent cũ là một lựa chọn nếu các phương pháp tiếp cận khác không thành công với kết quả tốt khi theo dõi ngắn hạn và trung hạn ở một số ca lâm sàng ghi nhận trước đây.
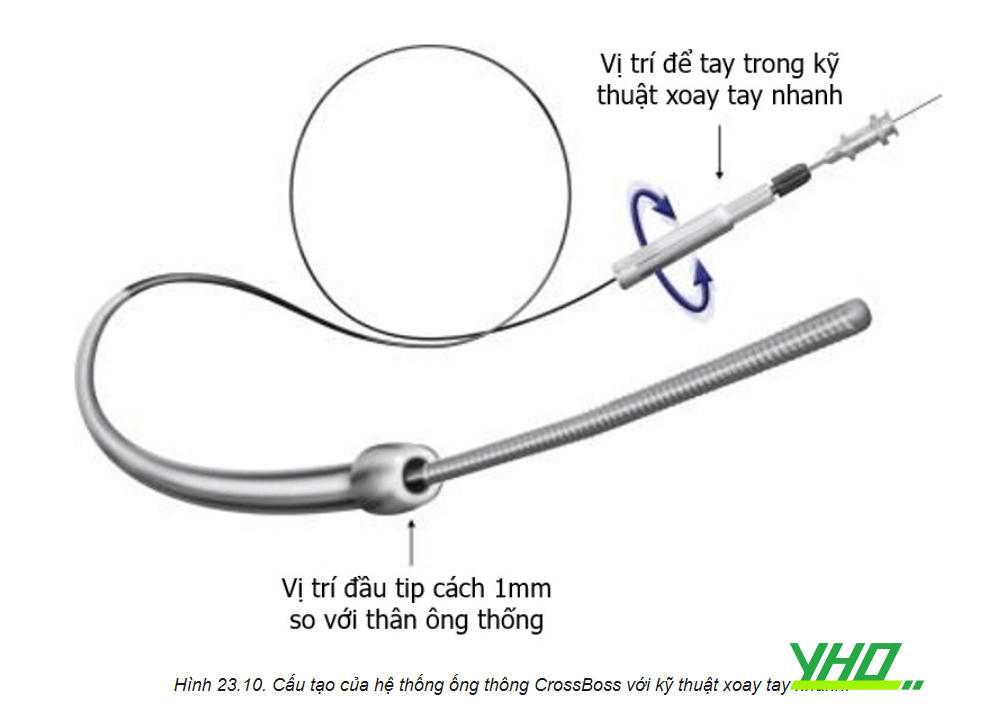
- Sử dụng ống thông CrossBoss được ưu tiên với tổn thương CTO trong stent. Ống thông CrossBoss rất thích hợp để xuyên qua tổn thương CTO trong stent bằng kỹ thuật xoay nhanh tay, vì các mắt stent cũ như là hàng rào ngăn cản ống thông CrossBoss đi lệch khỏi lòng mạch và dễ dàng tiếp cận lòng thật ở phía sau tổn thương CTO. Hiếm khi, ống thông CrossBoss có thể xuyên qua các mắt stent CTO để đi dưới nội mạc. Đôi khi, không thể xuyên qua tổn thương bằng ống thông CrossBoss, với trường hợp này, bác sĩ can thiệp cần sử dụng các dây dẫn cứng chẳng hạn như Pilot 200,…
b. Các thách thức trong can thiệp tổn thương CTO trong stent
Tiếp cận “mấu” ở đầu gần tổn thương CTO: Tổn thương CTO trong stent có thể bị vôi hóa và khó xuyên qua. Vì vậy để tiếp cận và xuyên qua tổn thương ở mấu gần cần sử dụng các kỹ thuật hỗ trợ và các dây dẫn có khả năng đâm xuyên tốt.
Xuyên qua tổn thương CTO trong stent: Tương tự như tổn thương CTO với mạch tự nhiên, các dây dẫn thường được bắt đầu từ dây dẫn có cấu tạo vỏ polymer, đầu nhọn, mềm và tăng dần lực đâm xuyên với các dây dẫn có vỏ polymer cứng hoặc dây dẫn có cấu trúc lõi cứng.
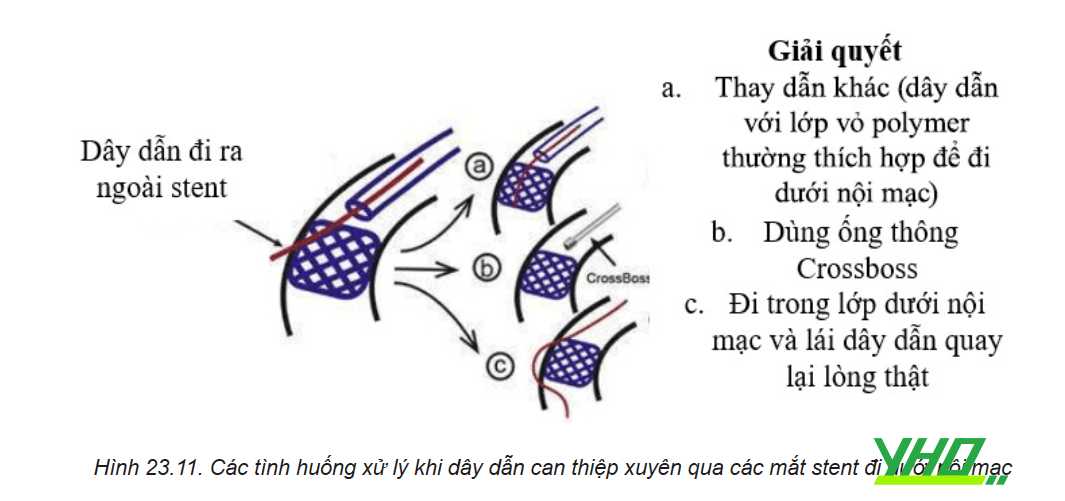
Việc thay đổi các mặt phẳng quan sát trong quá trình lái dây dẫn qua tổn thương là cần thiết để dây dẫn không đi ra ngoài stent cũ. Nếu dây dẫn đi ra ngoài mắt stent, có thể lựa chọn 3 cách sau:
- Thay đổi dây dẫn can thiệp (các dây vỏ bọc poly- mer thường dễ đi dưới lớp nội mạc hơn).
- Thay bằng ống thông CrossBoss.
- Tiếp tục đi dưới nội mạc và cố gắng tiếp cận lòng thật đoạn xa rồi tiến hành đập bẹp stent cũ và can thiệp đặt thêm DES mới.
Đi dây dẫn vào lòng thật ở đoạn xa: Nếu đúng lòng thật bằng cách test cản quang qua vi ống thông. Tiến hành thay các dây dẫn cứng bằng các dây dẫn can thiệp thường quy (Workhorse). Nếu đoạn xa vẫn còn ở lớp dưới nội mạc, có thể hỗ trợ đi vào lòng thật bằng bóng stingray nếu can thiệp xuôi dòng hoặc dùng kỹ thuật reverse CART nếu can thiệp ngược dòng.
6. TIÊU CHÍ ĐÁNH GIÁ THÀNH CÔNG CỦA THỦ THUẬT
Thành công của can thiệp động mạch vành được đánh giá dựa trên tiêu chí chụp mạch, thủ thuật và lâm sàng.
- Thành công về chụp mạch: Đường kính lòng mạch tối thiểu cuối cùng chỉ còn <10%.
- Thành công về thủ thuật: Chụp mạch thành công mà không có biến cố lâm sàng lớn tại viện (VD: tử vong, nhồi máu cơ tim (NMCT), phẫu thuật bắc cầu nối cấp cứu). NMCT thường được xác định bởi sóng Q mới xuất hiện và có tăng troponin gấp 3 lần giới hạn trên của bình thường. Troponin T và I có độ nhạy và độ đặc hiệu cao hơn CK-MB trong đánh giá hoại tử cơ Tăng các men tim không có sóng Q mới xuất hiện thì được tính là NMCT sau thủ thuật. Không có đồng thuận nào về mức tăng troponin đơn độc bao nhiêu là cần xử trí sau thủ thuật can thiệp.
- Thành công về lâm sàng: Thành công về chụp mạch và thành công về kèm theo giảm các dấu hiệu và/ hoặc triệu chứng của thiếu máu cơ tim sau can thiệp. Thành công lâm sàng dài hạn là tiếp tục giảm các dấu hiệu và triệu chứng thiếu máu cơ tim trên 6 tháng. Tái hẹp là nguyên nhân chính của hạn chế thành công dài hạn khi đã có thành công ngắn hạn.
7. BIẾN CHỨNG CỦA THỦ THUẬT VÀ XỬ TRÍ
Nhìn chung, can thiệp tổn thương tái hẹp trong stent (ISR) động mạch vành có thể gặp các biến chứng như trong can thiệp ĐMV cơ bản.
7.1. Biến chứng nói chung
- Tỉ lệ tử vong khoảng 0,1%.
- Nhồi máu cơ tim (NMCT) (1-3%), bệnh nhân ISR nhập viện vì NMCT ST chênh lên và NMCT không ST chênh lên có tỷ lệ thấp hơn so với bệnh nhân mạch tự nhiên.
- Phẫu thuật bắc cầu nối chủ vành cấp cứu (0,5-2%).
- Các biến chứng khi chụp chẩn đoán cũng có thể xảy ra khi can thiệp ĐMV, như chảy máu tại điểm chọc mạch đùi, đặc biệt với các dụng cụ mở đường vào lớn và dùng chống đông kéo dài (1:250 bệnh nhân), dị ứng thuốc cản quang, tai biến mạch não, NMCT, chấn thương mạch (VD: giả phình ĐM đùi, tắc ĐM quay).
7.2. Biến chứng khi đưa ống thông can thiệp Biến chứng trong quá trình đặt stent
Tính chất phức tạp của thủ thuật đặt stent đặt ra những vấn đề về kỹ thuật và biến chứng. Các biến chứng này có thể được xếp vào 6 nhóm:
- Rơi stent:
- Do nguyên nhân: ống thông hỗ trợ không tối ưu; không đưa stent qua được tổn thương (không nong rộng được do hẹp và canxi hoá nặng); không đưa stent qua được đoạn gần xoắn vặn hoặc vôi hóa (mạch cứng và gấp khúc nhiều).
- Giải pháp: cần nong chuẩn bị tổn thương trước chứ không nên đặt stent trực tiếp. Đưa bóng nong và nong trước giúp đưa stent đến tổn thương một cách thuận lợi. Khó khăn khi đưa bóng, ống thông không ổn định và nong bóng không tốt đoạn mạch xoắn vặn có thể gây ra biến chứng rơi stent.
- Stent chưa nở đủ:
- Do nguyên nhân: mạch vành vôi hoá hoặc mảng xơ vữa cứng trên nền đã có stent cũ. Hình ảnh có thể nhầm với stent chưa nở đủ là tách thành mạch xung quanh stent xuất phát từ rìa.
- Giải pháp: trong khi lên bóng, nếu stent chưa nở hết có thể bơm áp lực cao hơn hay dùng bóng ngắn và lớn hơn. Stent chưa nở tối ưu thường do nong bóng chuẩn bị chưa đủ. Trong trường hợp stent nở chưa tốt, sử dụng IVUS hoặc OCT để kiểm tra cơ chế hẹp tồn lưu: chưa áp sát, vôi hóa nặng. Stent không nở tốt sẽ làm tăng tái hẹp và nguy cơ huyết khối cấp.
- Không xử lý tiếp được sau khi lên stent:
- Tuột dây dẫn có thể làm cho không đưa được bóng vào nong thêm stent. Không thể đưa được dây vào lòng chính của stent sẽ làm stent bị méo. Đưa lại dây dẫn vào stent đã được đặt trước thường sử dụng một dây dẫn mềm với đầu uốn cong lớn có thể thò vào lòng chính của stent. Cố gắng tránh dây dẫn đi vào giữa mắt stent và thành mạch.
- Di lệch stent
- Là biến chứng hay gặp do khó khăn khi đưa stent đến vị trí tổn thương khi đã có stent cũ trước đó. Một số kỹ thuật lấy lại stent rơi như sử dụng thòng lọng (snare), dụng cụ như cái rổ, kẹp gắp, kẹp sinh thiết, hay một số dụng cụ gắp khác. Vì vậy, trong quá trình đẩy stent cần cảm nhận lực ma sát và sử dụng các thiết bị hỗ trợ nếu đẩy stent khó khăn.
- Vỡ mạch:
- Cần sử dụng bóng nong tại chỗ, stent có màng bọc. Xử lý tràn máu màng tim cấp bằng chọc tháo, có thể mở màng tim cấp cứu nếu tái phát nhanh. Nặng hơn có thể phải phẫu thuật cấp cứu khâu chỗ rách (vỡ) mạch vành
- Vỡ bóng:
- Do với các tổn thương tái hẹp trong stent, đa số các trường hợp bác sĩ can thiệp cần chuẩn bị trước tổn thương bằng bóng áp lực cao và lên bóng với áp suất lớn để nong tổn thương một cách tối ưu nhất, do đó có thể do vỡ hoặc thủng bóng.
- Giải pháp: Cần thay bóng mới khác. Nếu bóng vỡ khi stent đã được lên cố định tại vị trí mạch, thì cần làm xẹp bóng, xoay bóng 2 đến 3 lần bên trong stent sau đó rút nhẹ nhàng ra ngoài.
8. MỘT SỐ NGHIÊN CỨU VỀ ĐIỀU TRỊ TÁI HẸP TRONG STENT
8.1. Tái hẹp trong stent kim loại trần (BMS-ISR)
Việc điều trị BMS-ISR bằng việc nong bóng đơn thuần (POBA) hoặc đặt BMS lặp lại có tỷ lệ tái hẹp tái phát cao (gần 40%). Nong bằng cutting balloon không cho thấy bất kỳ lợi ích đáng kể nào và điều trị bằng liệu pháp khoan cắt mảng xơ vữa thậm chí dẫn đến kết quả kém hơn POBA, bên cạnh đó liệu pháp xạ nội mạch cũng đã bị loại bỏ do tính phức tạp và hiệu quả không rõ ràng. Phương pháp điều trị hiện nay là can thiệp đặt DES. Hiệu quả của can thiệp này xuất phát từ các thử nghiệm SISR năm 2006 và TAXUS V ISR năm 2006 thông qua so sánh đặt DES với liệu pháp xạ nội mạch. Trong thử nghiệm SISR, việc sử dụng SES (stent phủ thuốc sirolimus) đã có kết quả chụp mạch máu tốt hơn đáng kể và xu hướng giảm tỷ lệ tái hẹp tái phát lặp lại. Thử nghiệm TAXUS V ISR cho thấy giảm đáng kể tái can thiệp tổn thương mục tiêu, tỷ lệ tái hẹp tái phát và các biến cố tim mạch bất lợi chính (MACE) bao gồm tử vong tim mạch, nhồi máu cơ tim hoặc tái can thiệp tổn thương mục tiêu khi sử dụng stent phủ thuốc paclitaxel.
Các thử nghiệm ISAR-DESIRE và RIBS II đã so sánh điều trị BMS-ISR bằng đặt DES với POBA. Trong thử nghiệm ISAR-DESIRE, đặt thêm SES hoặc PES đã làm giảm đáng kể tái hẹp tái phát và tái can thiệp tổn thương mục tiêu POBA, trong khi so sánh trực tiếp 2 loại DES trong thử nghiệm trên, xu hướng các kết quả có lợi hơn đối với SES. Tương tự, nghiên cứu RIBS II cho thấy sự giảm đáng kể tình trạng tái hẹp tái phát và tái can thiệp tổn thương mục tiêu sau khi can thiệp bằng SES.
Ngược lại với can thiệp bằng DES, điều trị bằng nong bóng phủ thuốc (DCB) cho phép đưa các thuốc ngăn ngừa quá trình tăng sinh nội mô mạch máu vào nội mô vị trí ISR trong thời gian ngắn. Do thời gian tác dụng ngắn, DCB không ảnh hưởng nhiều đến tế bào tiền thân nội mô và quá trình tăng sinh nội mô của stent. Paclitaxel được sử dụng trong thực hành lâm sàng như một chất chống tăng sinh hiệu quả được phủ lên bề mặt của DCB.
8.2. Tái hẹp trong stent phủ thuốc (DES-ISR)
Nghiên cứu sổ bộ từ RIBS III tiến cứu đã so sánh các chiến lược được khuyến nghị hetero-DES (với thuốc phủ khác so với thuốc phủ của stent đầu) với 75% bệnh nhân và nhóm chứng (điều trị bằng can thiệp nong bóng đơn thuần, đặt BMS hoặc đặt DES với loại thuốc như stent đầu bị tái hẹp). Nhóm bệnh nhân được nhận hetero-DES cho thấy kết quả chụp mạch tốt hơn, giảm tỷ lệ tái hẹp tái phát và giảm các biến cố tim mạch bất lợi chính (MACE) so với nhóm chứng một cách có ý nghĩa thống kê.
Tương tự, can thiệp điều trị bằng bóng giải phóng paclitaxel (PEB) phủ iopromide trong DES-ISR cũng đã được nghiên cứu. Thử nghiệm PEPCAD-DES so sánh việc điều trị SES/PES-ISR bằng PEB phủ iopromide với nong bóng đơn thuần. Nghiên cứu ghi nhận PEB có kết quả hình ảnh chụp mạch tốt hơn đáng kể (giảm tỷ lệ tái hẹp tái phát và tỷ lệ tái thông mạch tái phát) cũng như giảm các kết cục lâm sàng chính như MACE và tỷ lệ huyết khối stent.
Trong thử nghiệm PEPCAD ISR ở Trung Quốc, PEB phủ iopromide ít nhất đã được chứng minh là có hiệu quả như PES trong điều trị DES-ISR. Habara và cộng sự đã chứng minh kết quả chụp mạch tốt hơn và giảm kết quả lâm sàng (thất bại của mạch máu mục tiêu) ở bệnh nhân BMS- ISR/ DES-ISR được điều trị bằng PEB phủ iopromide so với nong bóng đơn thuần. Trong nhóm PEB, kết quả tốt hơn đáng kể trong trường hợp BMS-ISR so với DES-ISR.
Trong nghiên cứu ISAR-DESIRE III, kết quả nghiên cứu cho thấy PEB không thua kém so với PES và PEB/PES có hiệu quả vượt trội hơn so với nong bóng đơn thuần trong điều trị SES-ISR, liên quan đến kết quả chính là hình ảnh chụp mạch.
Trong nghiên cứu hồi cứu Valentine, bệnh nhân có BMS-ISR/ DES-ISR được điều trị bằng PEB phủ shellac, theo dõi trong 6 đến 9 tháng, tỷ lệ gộp của tái can thiệp tổn thương mạch đích và MACE lần lượt là 8,6% và 11,1%. Trong một phân tích phụ về bệnh nhân được điều trị DES- ISR, một kết quả lâm sàng tốt hơn đáng kể (MACE và tái can thiệp tổn thương mạch đích) đã được ghi nhận ở những bệnh nhân PES-ISR so với những bệnh nhân SES-ISR.
8.3. So sánh các phương thức điều trị ISR
Hai phân tích tổng hợp lớn gần đây đã được thực hiện để làm rõ chiến lược nào là tốt nhất cho tổn thương ISR. Siontis và cộng sự phân tích 27 thử nghiệm với tổng số 5.923 bệnh nhân được theo dõi từ 6 tháng đến 1 năm. Kết cục chính của phân tích này là phần trăm hẹp đường kính trong stent khi theo dõi và kết cục phụ bao gồm tái hẹp ít nhất 50% trong stent, tỷ lệ tái can thiệp tổn thương mạch máu đích, nhồi máu cơ tim hoặc tử vong. Tất cả các phương thức điều trị ISR bao gồm nong bóng đơn thuần, khoan phá các mảng xơ vữa vôi, liệu pháp xạ nội mạch, đặt BMS, đặt DES và DCB. Can thiệp đặt EES (DES phủ everolimus) là vượt trội có ý nghĩa thống kê so với tất cả các phương thức điều trị khác ở cả kết cục chính cũng như kết cục phụ.
DCB dường như là phương pháp điều trị ưu tiên thứ hai nhưng không có sự khác biệt đáng kể so với SES hoặc PES. Giacoppo và cộng sự phân tích tổng hợp 24 thử nghiệm với tổng số 4.880 bệnh nhân. Kết cục chính là tỷ lệ tái can thiệp mạch máu đích và tắc lòng mạch muộn bằng chụp mạch. Cả DCB và DES đều ưu việt hơn các phương thức điều trị khác dựa trên kết cục lâm sàng được xác định trước. Kết quả chụp mạch ủng hộ DCB hoặc DES hơn tất cả các phương thức khác, tuy nhiên biến cố tắc lòng mạch muộn có vẻ thấp hơn một chút ở nhánh DCB so với DES.
8.4. Các hướng đi trong tương lai
Một số các kỹ thuật đang được nghiên cứu trong các thử nghiệm lâm sàng đóng góp những điều trị tiềm năng cho điều trị ISR gồm lithotripsy nội mạch cho các stent nở không tốt. Sự thích hợp của kết hợp bóc nội mạc bằng khoan với lithotripsy nội mạch cho tổn thương ISR với mảng xơ vữa tân sinh đã canxi hóa đã được báo cáo gần đây. Ngoài ra, thế hệ DCB phủ sirolimus mới cần được thử nghiệm lâm sàng cho điều trị DES-ISR. Những nghiên cứu bổ sung là cần thiết để đánh giá hiệu quả dài hạn và đối tượng lý tưởng cho các liệu pháp mới này. Cuối cùng, cách tốt nhất để điều trị DES-ISR là dự phòng nó. Vấn đề này có thể được giảm bớt với đặt stent DES dưới hướng dẫn hình ảnh và các cải tiến trong công nghệ stent.
9. THEO DÕI SAU CAN THIỆP
Tương tự với theo dõi sau can thiệp ở những trường hợp can thiệp ĐMV cơ bản (xem thêm tại Chương 17: Can thiệp động mạch vành cơ bản). Sau can thiệp tổn thương tái hẹp trong stent động mạch vành, đặc biệt ở những trường hợp can thiệp tổn thương tắc mạn tính trong stent cũ, khuyến cáo nên dùng thuốc kháng kết tập tiểu cầu kép trong tối thiểu 6 đến 12 tháng và statin liều cao để đạt đích điều trị rối loạn mỡ máu theo các khuyến cáo hiện hành.
TÀI LIỆU THAM KHẢO
- Bønaa KH, Mannsverk J, Wiseth R, Aaberge L, Myreng Y, Nygård O, Nilsen DW, Kløw NE, Uchto M, Trovik T, Bendz B, Stavnes S, Bjørnerheim R, Larsen AI, Slette M, Steigen T, Jakobsen OJ, Bleie Ø, Fossum E, Hanssen TA, Dahl-Eriksen Ø, Njølstad I, Rasmussen K, Wilsgaard T, Nordrehaug JE; NORSTENT Investigators. Drug-eluting or bare-metal stents for coronary artery disease.N Engl J Med. 2016; 375:1242–1252. doi: 1056/NEJMoa1607991.
- Byrne RA, Sarafoff N, Kastrati A, Schömig A. Drug-eluting stents in percutaneous coronary intervention: a benefit-risk assessment.Drug Saf. 2009; 32:749–770. doi: 2165/11316500-000000000-00000.
- Cutlip DE, Windecker S, Mehran R, Boam A, Cohen DJ, van Es GA, Steg PG, Morel MA, Mauri L, Vranckx P, McFadden E, Lansky A, Hamon M, Krucoff MW, Serruys PW; Academic Research Consortium. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation. 2007; 115:2344–2351. doi: 1161/CIRCULATIONAHA.106.685313.
- Piccolo R, Stefanini GG, Franzone A,Spitzer E, Blochlinger S, Heg D, Juni P, Windecker S. Safety and efficacy of resolute zotarolimus-eluting stents compared with everolimus-eluting stents: a meta-analysis.Circ Cardiovasc Interv. 2015; 8:e002223. doi: 10.1161/ CIRCINTERVENTIONS.114.002223.
- Cutlip DE, Chhabra AG, Baim DS, Chauhan MS, Marulkar S, Massaro J, Bakhai A, Cohen DJ, Kuntz RE, Ho KK. Beyond restenosis: five-year clinicaloutcomesfromsecond-generationcoronarystenttrials.Circulation. 2004; 110:1226–1230. doi: 1161/01.CIR.0000140721.27004.4B.
- Lee SY, Hong MK, Jang Formation and transformation of neointima after drug-eluting stent implantation: insights from optical coherence tomographic studies.Korean Circ J. 2017; 47:823–832. doi: 10.4070/kcj.2017.0157.
- Alfonso F, Byrne RA, Rivero F, Kastrati A. Current treatment of in-stent restenosis.J Am Coll Cardiol. 2014; 63:2659–2673. doi: 10.1016/j. jacc.2014.02.545.
- Kim MS, Dean LS. In-stent restenosis.Cardiovasc Ther. 2011; 29:190–198. doi: 10.1111/j.1755-5922.2010.00155.x
- Rosenthal N, Costa MA. Unravelling the endovascular microenvironment by optical coherence tomography.Eur Heart J. 2010; 31: 139–142. doi: 1093/eurheartj/ehp481.
- Nakamura D, Yasumura K, Nakamura H, Matsuhiro Y, Yasumoto K, Tanaka A, Matsunaga-Lee Y, Yano M, Yamato M, Egami Y, Shutta R, Sakata Y, Tanouchi J, Nishino M. Different neoatherosclerosis patterns in drug-eluting- and bare-metal stent restenosis- optical coherence tomography study.Circ J. 2019; 83:313–319. doi: 1253/circj.CJ-18-0701.
- Byrne RA, Joner M, Tada T, Kastrati A. Restenosis in bare metal and drug-eluting stents: distinct mechanistic insights from histopathology and optical intravascular Minerva Cardioangiol. 2012; 60:473–489.
- Jinnouchi H, Kuramitsu S, Shinozaki T, Tomoi Y, Hiromasa T, Kobayashi Y, Domei T, Soga Y, Hyodo M, Shirai S, Ando K. Difference of tissue characteristics between early and late restenosis after second-generation drug-eluting stents implantation- An optical coherence tomography study.Circ J. 2017; 81:450–457. doi: 1253/circj.CJ-16-1069.
- Tsigkas GG, Karantalis V, Hahalis G, Alexopoulos Stent restenosis, pathophysiology and treatment options: a 2010 update.Hellenic J Cardiol. 2011; 52:149–157.
- Song L, Mintz GS, Yin D, Yamamoto MH, Chin CY, Matsumura M, Fall K, Kirtane AJ, Parikh MA, Moses JW, Ali ZA, Shlofmitz RA, Maehara Neoatherosclerosis assessed with optical coherence tomography in restenotic bare metal and first- and second-generation drug-eluting stents.Int J Cardiovasc Imaging. 2017; 33:1115–1124. doi: 10.1007/s10554-017-1106-2.
- Goto K, Zhao Z, Matsumura M, Dohi T, Kobayashi N, Kirtane AJ, Rabbani LE, Collins MB, Parikh MA, Kodali SK, Leon MB, Moses JW, Mintz GS, Maehara A. Mechanisms and patterns of intravascular ultrasound in-stent restenosis among bare metal stents and first- and second-generation drug-eluting stents.Am J Cardiol. 2015; 116:1351–1357. doi: 1016/j.amjcard.2015.07.058.
- Nakano M, Otsuka F, Yahagi K, Sakakura K, Kutys R, Ladich ER, Finn AV, Kolodgie FD, Virmani R. Human autopsy study of drug-eluting stents restenosis: histomorphological predictors and neointimal characteristics.Eur Heart J. 2013; 34:3304–3313. doi: 10.1093/eurheartj/ eht241.
- Fujino A, Mintz GS, Matsumura M, Lee T, Kim SY, Hoshino M, Usui E, Yonetsu T, Haag ES, Shlofmitz RA, Kakuta T, Maehara A. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion.EuroIntervention. 2018; 13:e2182–e2189. doi: 4244/EIJ-D-17-00962.
- Alfonso F, Bastante T, Antuña P, de la Cuerda F, Cuesta J, García-Guimaraes M, Rivero Coronary lithoplasty for the treatment of undilatable calcified de novo and in-stent restenosis lesions.JACC Cardiovasc Interv. 2019; 12:497–499. doi: 10.1016/j.jcin.2018.12.025 .
- Chung WS, Park CS, Seung KB, Kim PJ, Lee JM, Koo BK, Jang YS, Yang JY, Yoon JH, Kim DI, Yoon YW, Park JS, Cho YH, Park SJ. The incidence and clinical impact of stent strut fractures developed after drug-eluting stent implantation.Int J Cardiol. 2008; 125:325–331. doi: 10.1016/j. ijcard.2007.02.033.
- Lemos PA, Saia F, Ligthart JM, Arampatzis CA, Sianos G, Tanabe K, Hoye A, Degertekin M, Daemen J, McFadden E, Hofma S, Smits PC, de Feyter P, van der Giessen WJ, van Domburg RT, Serruys Coronary restenosis after sirolimus-eluting stent implantation: morphological description and mechanistic analysis from a consecutive series of cases.Circulation. 2003; 108:257–260. doi: 10.1161/01. CIR.0000083366.33686.11.
- Rhee TM, Park KW, Lee JM, Lee MS, Jeon KH, Kang HJ, Koo BK, Rhew JY, Cha KS, Bae JH, Han KR, Park SH, Park WJ, Rha SW, Oh SK, Kwon HM, Seung KB, Ahn T, Kim SH, Kim Predictors and long-term clinical outcome of longitudinal stent deformation: insights from pooled analysis of korean multicenter drug-eluting stent cohort.Circ Cardiovasc Interv. 2017; 10:e005518. doi: 10.1161/ CIRCINTERVENTIONS.117.005518.
- Nam CW, Rha SW, Koo BK, Doh JH, Chung WY, Yoon MH, Tahk SJ, Lee BK, Lee JB, Yoo KD, Cho YK, Chung IS, Hur SH, Kim KB, Choi CU, Oh DJ. Usefulness of coronary pressure measurement for functional evaluation of drug-eluting stent restenosis.Am J Cardiol. 2011; 107: 1783–1786. doi: 1016/j.amjcard.2011.02.328.
- Mehran R, Dangas G, Abizaid AS, Mintz GS, Lansky AJ, Satler LF, Pichard AD, Kent KM, Stone GW, Leon MB. Angiographic patterns of in-stent restenosis: classification and implications for long-term Circulation. 1999; 100:1872–1878. doi: 10.1161/01.cir.100.18.1872.
- Solinas E, Dangas G, Kirtane AJ, Lansky AJ, Franklin-Bond T, Boland P, Syros G, Kim YH, Gupta A, Mintz G, Fahy M, Collins M, Kodali S, Stone GW, Moses JW, Leon MB, Mehran R. Angiographic patterns of drug-eluting stent restenosis and one-year outcomes after treatment with repeated percutaneous coronary intervention.Am J Cardiol. 2008; 102:311–315. doi: 10.1016/j.amjcard.2008.03.060 .
- Cassese S, De Luca G, Ribichini F, Cernigliaro C, Sansa M, Versaci F, Proietti I, Stankovic G, Stojkovic S, Fernandez-Pereira C, Tomai F, Vassanelli C, Antoniucci D, Serruys PW, Kastrati A, Rodriguez AE. ORAl iMmunosuppressive therapy to prevent in-Stent rEstenosiS (RAMSES) cooperation: a patient-level meta-analysis of randomized trials.Atherosclerosis. 2014; 237:410–417. doi: 10.1016/ j.atherosclerosis.2014.09.021.
- Kastrati A, Mehilli J, von Beckerath N, Dibra A, Hausleiter J, Pache J, Schühlen H, Schmitt C, Dirschinger J, Schömig A; ISAR-DESIRE Study Sirolimus-eluting stent or paclitaxel-eluting stent vs balloon angioplasty for prevention of recurrences in patients with coronary in-stent restenosis: a randomized controlled trial.JAMA. 2005; 293:165–171. doi: 10.1001/jama.293.2.165