Kiểm soát đường huyết và điện giải trong hồi sức
Trong môi trường hồi sức tích cực (ICU), nơi sự sống mong manh được níu giữ từng giây, phút, việc duy trì sự ổn định của các chỉ số sinh học trở thành yếu tố then chốt quyết định sự thành bại của quá trình điều trị. Chúng ta, những người làm trong ngành y, luôn trăn trở làm sao để tối ưu hóa từng can thiệp, từng phác đồ, nhằm mang lại cơ hội sống tốt nhất cho bệnh nhân. Giữa vô vàn các yếu tố cần kiểm soát, đường huyết và điện giải nổi lên như hai trụ cột quan trọng, ảnh hưởng sâu sắc đến chức năng của mọi cơ quan trong cơ thể.
Bài viết này đi sâu vào vai trò sống còn của việc kiểm soát đường huyết và điện giải ở bệnh nhân ICU. Chúng ta sẽ cùng nhau phân tích những thách thức đặc thù trong việc duy trì sự cân bằng này, từ tình trạng tăng đường huyết do stress đến những biến chứng nguy hiểm của hạ đường huyết. Bên cạnh đó, bài viết cũng sẽ làm rõ tầm quan trọng của việc nhận diện và điều trị kịp thời các rối loạn điện giải thường gặp như rối loạn kali máu (K+), rối loạn natri máu (Na+), cũng như các rối loạn khác, đồng thời nhấn mạnh sự cần thiết của việc cân bằng nước và điện giải một cách khoa học.
Không chỉ dừng lại ở việc mô tả các vấn đề, bài viết còn đề cập đến những yếu tố ảnh hưởng đến quá trình kiểm soát đường huyết và điện giải, bao gồm cả những tác động của stress, giấc ngủ và các vấn đề tâm lý khác. Cuối cùng, chúng ta sẽ cùng thảo luận về các phương pháp theo dõi đường huyết liên tục, đánh giá điện giải định kỳ và tầm quan trọng của việc điều chỉnh phác đồ điều trị một cách linh hoạt, dựa trên những bằng chứng khoa học mới nhất, nhằm tối ưu hóa kết quả điều trị cho bệnh nhân ICU. Hy vọng rằng, bài viết này sẽ cung cấp một cái nhìn toàn diện và sâu sắc, góp phần nâng cao hiệu quả chăm sóc và điều trị cho những bệnh nhân nặng, giúp họ vượt qua giai đoạn khó khăn nhất của cuộc đời.
Tổng Quan về Kiểm Soát Đường Huyết và Điện Giải trong ICU
Tầm Quan Trọng của Kiểm Soát Đường Huyết và Điện Giải
Trong môi trường Hồi Sức Tích Cực (ICU), nơi sự sống và cái chết đôi khi chỉ cách nhau một sợi chỉ mong manh, việc kiểm soát đường huyết và điện giải không chỉ là một phần của quy trình điều trị, mà là một yếu tố then chốt, quyết định đến sự thành bại của cả quá trình hồi phục. Tôi luôn cảm thấy một áp lực vô hình khi nghĩ về điều này, bởi vì mỗi quyết định, mỗi điều chỉnh nhỏ trong phác đồ điều trị đều có thể tạo ra sự khác biệt lớn, thậm chí là sự sống còn cho bệnh nhân.
Tại sao lại như vậy? Hãy thử hình dung, bệnh nhân ICU thường là những người đang ở trong tình trạng bệnh lý nghiêm trọng, cơ thể họ đang phải đối mặt với vô vàn thử thách: từ nhiễm trùng nặng, suy đa tạng, đến các biến chứng sau phẫu thuật lớn. Trong bối cảnh đó, sự ổn định nội môi, đặc biệt là đường huyết và điện giải, trở nên vô cùng quan trọng.
Tăng đường huyết trong ICU không chỉ đơn thuần là một con số cao trên máy đo đường. Nó là một dấu hiệu cho thấy cơ thể đang phải chịu đựng một lượng lớn stress, kích hoạt hàng loạt các phản ứng viêm, làm suy yếu hệ miễn dịch, và tạo điều kiện thuận lợi cho nhiễm trùng phát triển. Các nghiên cứu đã chỉ ra rằng tăng đường huyết có thể làm tăng tỷ lệ tử vong, kéo dài thời gian nằm viện, và làm chậm quá trình phục hồi chức năng.
Ngược lại, hạ đường huyết cũng không kém phần nguy hiểm. Nó có thể gây ra tổn thương não không hồi phục, đặc biệt là ở những bệnh nhân có bệnh lý nền về thần kinh. Sự thiếu hụt glucose đột ngột có thể dẫn đến co giật, hôn mê, và thậm chí tử vong.
Về mặt điện giải, sự mất cân bằng có thể gây ra những hậu quả nghiêm trọng trên tim mạch, thần kinh, và cơ bắp. Rối loạn kali máu (K+) có thể dẫn đến loạn nhịp tim, ngừng tim, và yếu cơ. Rối loạn natri máu (Na+) có thể gây ra phù não, co giật, và thay đổi tri giác. Các rối loạn điện giải khác, như magie và canxi, cũng có thể ảnh hưởng đến chức năng tim, thần kinh, và đông máu.
Điều đáng nói là, việc kiểm soát đường huyết và điện giải trong ICU không phải là một nhiệm vụ dễ dàng. Nó đòi hỏi sự hiểu biết sâu sắc về sinh lý bệnh, khả năng đánh giá chính xác tình trạng bệnh nhân, và kinh nghiệm lâm sàng vững vàng. Chúng ta phải luôn cảnh giác với những thay đổi nhỏ nhất trong các chỉ số sinh học, và sẵn sàng điều chỉnh phác đồ điều trị một cách linh hoạt.
Hơn nữa, tầm quan trọng của kiểm soát đường huyết và điện giải không chỉ giới hạn trong việc giảm tỷ lệ tử vong và biến chứng. Nó còn đóng vai trò quan trọng trong việc cải thiện chất lượng cuộc sống của bệnh nhân sau khi xuất viện. Một bệnh nhân được kiểm soát tốt đường huyết và điện giải trong ICU sẽ có khả năng phục hồi nhanh hơn, giảm nguy cơ mắc các bệnh lý mãn tính, và có thể trở lại cuộc sống bình thường một cách trọn vẹn hơn.
Nói tóm lại, việc kiểm soát đường huyết và điện giải trong ICU là một nghệ thuật, một khoa học, và một trách nhiệm cao cả. Nó đòi hỏi sự tận tâm, tỉ mỉ, và không ngừng học hỏi từ những người làm công tác hồi sức tích cực. Chỉ khi đó, chúng ta mới có thể mang lại cơ hội sống tốt nhất cho những bệnh nhân đang phải chiến đấu với bệnh tật hiểm nghèo.

Mục Tiêu Kiểm Soát Đường Huyết và Điện Giải trong ICU
Xác định mục tiêu kiểm soát đường huyết và điện giải trong ICU là một bước quan trọng, nền tảng để xây dựng phác đồ điều trị hiệu quả. Tuy nhiên, đây không phải là một công thức cứng nhắc áp dụng cho tất cả bệnh nhân, mà là một quá trình cá nhân hóa, dựa trên tình trạng bệnh lý cụ thể, các bệnh nền, và các yếu tố nguy cơ của từng người.
Về kiểm soát đường huyết, mục tiêu chung thường là duy trì mức đường huyết trong một khoảng hẹp, thường là 140-180 mg/dL (7.8-10.0 mmol/L). Khoảng mục tiêu này đã được chứng minh là mang lại lợi ích tốt nhất cho hầu hết bệnh nhân ICU, giúp giảm nguy cơ tử vong và các biến chứng liên quan đến tăng đường huyết. Tuy nhiên, có một số trường hợp ngoại lệ cần được xem xét.
Ví dụ, ở những bệnh nhân có tiền sử đái tháo đường type 1 hoặc type 2 được kiểm soát tốt trước khi nhập viện, chúng ta có thể cân nhắc mục tiêu đường huyết thấp hơn, khoảng 110-140 mg/dL (6.1-7.8 mmol/L). Tuy nhiên, cần phải theo dõi chặt chẽ để tránh nguy cơ hạ đường huyết, đặc biệt là ở những bệnh nhân có bệnh lý tim mạch hoặc thần kinh.
Ngược lại, ở những bệnh nhân có tổn thương não hoặc suy gan nặng, chúng ta có thể chấp nhận mục tiêu đường huyết cao hơn một chút, khoảng 180-200 mg/dL (10.0-11.1 mmol/L), để tránh nguy cơ hạ đường huyết, vì tình trạng này có thể làm trầm trọng thêm tổn thương não hoặc suy gan.
Điều quan trọng là phải nhớ rằng, việc kiểm soát đường huyết không chỉ là việc đạt được một con số mục tiêu. Nó còn là việc duy trì sự ổn định của đường huyết, tránh những biến động lớn, và ngăn ngừa cả tăng đường huyết và hạ đường huyết. Để đạt được điều này, chúng ta cần sử dụng các phương pháp theo dõi đường huyết liên tục, điều chỉnh liều insulin một cách linh hoạt, và phối hợp chặt chẽ với các chuyên gia dinh dưỡng để đảm bảo cung cấp đủ năng lượng cho bệnh nhân.
Về kiểm soát điện giải, mục tiêu là duy trì nồng độ các chất điện giải trong máu ở mức bình thường, hoặc gần bình thường, tùy thuộc vào tình trạng bệnh lý của bệnh nhân.
- Kali (K+): Mục tiêu thường là duy trì nồng độ kali máu trong khoảng 3.5-5.0 mEq/L. Rối loạn kali máu, cả tăng và hạ kali máu, đều có thể gây ra những hậu quả nghiêm trọng trên tim mạch, vì vậy việc kiểm soát kali máu là vô cùng quan trọng.
- Natri (Na+): Mục tiêu thường là duy trì nồng độ natri máu trong khoảng 135-145 mEq/L. Rối loạn natri máu có thể gây ra phù não, co giật, và thay đổi tri giác, đặc biệt là ở những bệnh nhân có bệnh lý thần kinh.
- Magie (Mg2+): Mục tiêu thường là duy trì nồng độ magie máu trong khoảng 1.5-2.5 mg/dL. Magie đóng vai trò quan trọng trong chức năng tim, thần kinh, và cơ bắp, và sự thiếu hụt magie có thể gây ra loạn nhịp tim, co giật, và yếu cơ.
- Canxi (Ca2+): Mục tiêu thường là duy trì nồng độ canxi máu trong khoảng 8.5-10.5 mg/dL. Canxi đóng vai trò quan trọng trong đông máu, chức năng tim, và dẫn truyền thần kinh, và sự rối loạn canxi máu có thể gây ra nhiều biến chứng khác nhau.
Việc điều chỉnh điện giải cần được thực hiện một cách cẩn thận, dựa trên nguyên nhân gây ra rối loạn, mức độ nghiêm trọng, và tình trạng bệnh lý của bệnh nhân. Chúng ta cần sử dụng các loại dịch truyền tĩnh mạch phù hợp, bổ sung các chất điện giải một cách từ từ, và theo dõi chặt chẽ các chỉ số sinh học để đảm bảo an toàn và hiệu quả.
Ngoài ra, việc cân bằng nước cũng rất quan trọng trong ICU. Chúng ta cần theo dõi lượng dịch vào và ra của bệnh nhân, đánh giá tình trạng hydrat hóa, và điều chỉnh lượng dịch truyền một cách phù hợp. Quá tải dịch có thể gây ra phù phổi, suy tim, và tăng áp lực nội sọ, trong khi thiếu dịch có thể gây ra giảm tưới máu các cơ quan, suy thận, và sốc.
Tóm lại, mục tiêu kiểm soát đường huyết và điện giải trong ICU là duy trì sự ổn định nội môi, giảm nguy cơ biến chứng, và cải thiện kết quả điều trị cho bệnh nhân. Để đạt được mục tiêu này, chúng ta cần có sự hiểu biết sâu sắc về sinh lý bệnh, khả năng đánh giá chính xác tình trạng bệnh nhân, và kinh nghiệm lâm sàng vững vàng. Đồng thời, chúng ta cũng cần phải cá nhân hóa phác đồ điều trị, theo dõi chặt chẽ các chỉ số sinh học, và phối hợp chặt chẽ với các chuyên gia khác để đảm bảo an toàn và hiệu quả.
Kiểm Soát Đường Huyết ở Bệnh Nhân ICU
Tăng Đường Huyết trong ICU
Tăng đường huyết trong ICU không chỉ là một con số trên máy xét nghiệm, mà là một dấu hiệu cảnh báo về tình trạng rối loạn chuyển hóa nghiêm trọng, có thể dẫn đến những hậu quả khôn lường. Chúng ta cần hiểu rõ về nguyên nhân, cơ chế bệnh sinh và tác động của nó để có thể can thiệp một cách hiệu quả.
Nguyên nhân của tăng đường huyết trong ICU thường rất đa dạng và phức tạp, phản ánh tình trạng bệnh lý nền và những can thiệp điều trị. Một trong những nguyên nhân hàng đầu là stress chuyển hóa, do tình trạng bệnh nặng gây ra. Khi cơ thể phải đối mặt với chấn thương, nhiễm trùng, phẫu thuật hoặc các tình huống nguy kịch khác, nó sẽ giải phóng một loạt các hormone như cortisol, glucagon và epinephrine. Những hormone này có tác dụng làm tăng sản xuất glucose từ gan (tân tạo đường) và giảm sử dụng glucose ở các mô ngoại vi, dẫn đến tăng đường huyết.
Ngoài ra, kháng insulin cũng đóng một vai trò quan trọng. Tình trạng bệnh nặng làm giảm độ nhạy của các tế bào đối với insulin, khiến glucose không thể đi vào tế bào để cung cấp năng lượng, từ đó làm tăng nồng độ glucose trong máu. Các yếu tố như viêm, cytokine và các chất trung gian gây viêm cũng góp phần vào tình trạng kháng insulin này.
Một nguyên nhân khác không thể bỏ qua là chế độ dinh dưỡng. Bệnh nhân ICU thường được nuôi dưỡng bằng đường tĩnh mạch (TPN) hoặc qua ống thông (enteral feeding) để đảm bảo cung cấp đủ năng lượng và protein. Tuy nhiên, việc cung cấp quá nhiều carbohydrate hoặc tốc độ truyền dịch quá nhanh có thể dẫn đến tăng đường huyết. Các loại thuốc như corticosteroid, vasopressor và một số loại thuốc khác cũng có thể làm tăng đường huyết.
Cơ chế bệnh sinh của tăng đường huyết trong ICU rất phức tạp và liên quan đến nhiều hệ thống trong cơ thể. Như đã đề cập, stress chuyển hóa và kháng insulin là hai yếu tố chính. Stress chuyển hóa kích hoạt hệ thống thần kinh giao cảm và trục hạ đồi – tuyến yên – thượng thận (HPA axis), dẫn đến giải phóng các hormone gây tăng đường huyết. Kháng insulin làm giảm khả năng của insulin trong việc kích thích vận chuyển glucose vào tế bào, làm tăng nồng độ glucose trong máu.
Tăng đường huyết cũng gây ra một loạt các rối loạn chuyển hóa khác, bao gồm tăng sản xuất các gốc tự do, rối loạn chức năng nội mô, tăng đông máu và suy giảm chức năng miễn dịch. Những rối loạn này có thể làm trầm trọng thêm tình trạng bệnh lý nền và làm tăng nguy cơ biến chứng.
Tác động của tăng đường huyết trong ICU là rất nghiêm trọng và có thể ảnh hưởng đến kết quả điều trị. Tăng đường huyết làm tăng nguy cơ nhiễm trùng, vì glucose là môi trường lý tưởng cho vi khuẩn phát triển. Nó cũng làm suy giảm chức năng của các tế bào miễn dịch, khiến cơ thể dễ bị tấn công bởi vi khuẩn và virus.
Tăng đường huyết cũng có thể gây ra rối loạn chức năng tim mạch, bao gồm tăng nguy cơ nhồi máu cơ tim, suy tim và rối loạn nhịp tim. Nó cũng làm tăng nguy cơ tổn thương thận cấp và làm chậm quá trình phục hồi chức năng thận.
Ngoài ra, tăng đường huyết còn có thể gây ra tổn thương thần kinh, bao gồm tăng nguy cơ đột quỵ, bệnh não do thiếu oxy và tổn thương thần kinh ngoại biên. Nó cũng làm chậm quá trình phục hồi chức năng thần kinh và làm tăng nguy cơ tàn tật.
Do đó, việc kiểm soát tăng đường huyết trong ICU là vô cùng quan trọng. Chúng ta cần xác định các yếu tố nguy cơ, theo dõi đường huyết chặt chẽ và áp dụng các biện pháp điều trị phù hợp để duy trì đường huyết trong phạm vi mục tiêu.
Hạ Đường Huyết trong ICU
Hạ đường huyết trong ICU, mặc dù ít được nhắc đến hơn so với tăng đường huyết, nhưng lại là một mối đe dọa tiềm ẩn, có thể gây ra những hậu quả nghiêm trọng và thậm chí đe dọa tính mạng của bệnh nhân. Chúng ta cần nhận thức rõ về nguyên nhân, cơ chế và tác động của nó để có thể phòng ngừa và xử trí kịp thời.
Nguyên nhân của hạ đường huyết trong ICU thường liên quan đến việc điều trị tăng đường huyết quá tích cực, hoặc do các yếu tố khác ảnh hưởng đến cân bằng glucose trong cơ thể. Một trong những nguyên nhân phổ biến nhất là sử dụng insulin quá liều. Khi chúng ta cố gắng kiểm soát tăng đường huyết bằng insulin, nếu không điều chỉnh liều lượng một cách cẩn thận, có thể dẫn đến hạ đường huyết. Đặc biệt, ở những bệnh nhân có chức năng gan hoặc thận suy giảm, insulin có thể tích lũy trong cơ thể và gây ra hạ đường huyết kéo dài.
Ngoài ra, giảm cung cấp glucose cũng là một nguyên nhân quan trọng. Bệnh nhân ICU thường có tình trạng ăn uống kém, hoặc được nuôi dưỡng bằng đường tĩnh mạch với tốc độ không đủ. Nếu không theo dõi sát sao lượng glucose được cung cấp và điều chỉnh kịp thời, có thể dẫn đến hạ đường huyết. Ngừng đột ngột nuôi dưỡng đường tĩnh mạch cũng có thể gây ra hạ đường huyết, đặc biệt ở những bệnh nhân đang sử dụng insulin.
Một số bệnh lý và thuốc cũng có thể gây ra hạ đường huyết. Suy gan làm giảm khả năng sản xuất glucose của gan, trong khi suy thận làm giảm khả năng đào thải insulin, cả hai đều có thể dẫn đến hạ đường huyết. Một số loại thuốc như sulfonylurea (thường dùng trong điều trị tiểu đường type 2) và pentamidine (thuốc điều trị viêm phổi do Pneumocystis) cũng có thể gây ra hạ đường huyết.
Cơ chế bệnh sinh của hạ đường huyết liên quan đến sự mất cân bằng giữa cung và cầu glucose. Khi nồng độ glucose trong máu giảm xuống dưới mức bình thường, cơ thể sẽ kích hoạt các cơ chế bảo vệ để tăng sản xuất glucose và giảm sử dụng glucose. Tuy nhiên, ở bệnh nhân ICU, các cơ chế này có thể bị suy yếu hoặc không đủ để bù đắp cho sự thiếu hụt glucose.
Khi nồng độ glucose trong máu giảm xuống dưới một ngưỡng nhất định, não bộ sẽ bị ảnh hưởng nghiêm trọng. Não bộ là cơ quan tiêu thụ glucose lớn nhất trong cơ thể và không có khả năng dự trữ glucose. Do đó, khi glucose không đủ, não bộ sẽ bị thiếu năng lượng và bắt đầu rối loạn chức năng.
Tác động của hạ đường huyết trong ICU có thể rất nghiêm trọng và ảnh hưởng đến nhiều hệ thống trong cơ thể. Tổn thương não là một trong những hậu quả đáng lo ngại nhất. Hạ đường huyết kéo dài hoặc nghiêm trọng có thể gây ra tổn thương não vĩnh viễn, dẫn đến suy giảm nhận thức, động kinh, hôn mê và thậm chí tử vong.
Hạ đường huyết cũng có thể gây ra rối loạn tim mạch, bao gồm tăng nhịp tim, tăng huyết áp và rối loạn nhịp tim. Nó cũng làm tăng nguy cơ nhồi máu cơ tim và đột quỵ.
Ngoài ra, hạ đường huyết còn có thể gây ra rối loạn thần kinh, bao gồm run, vã mồ hôi, lo lắng, đói cồn cào và yếu cơ. Nó cũng có thể gây ra rối loạn tâm thần, bao gồm lú lẫn, kích động và thay đổi hành vi.
Do đó, việc phòng ngừa và xử trí hạ đường huyết trong ICU là vô cùng quan trọng. Chúng ta cần theo dõi đường huyết chặt chẽ, điều chỉnh liều insulin và chế độ dinh dưỡng một cách cẩn thận, và nhận biết sớm các dấu hiệu của hạ đường huyết để có thể can thiệp kịp thời.
Các Phương Pháp Kiểm Soát Đường Huyết
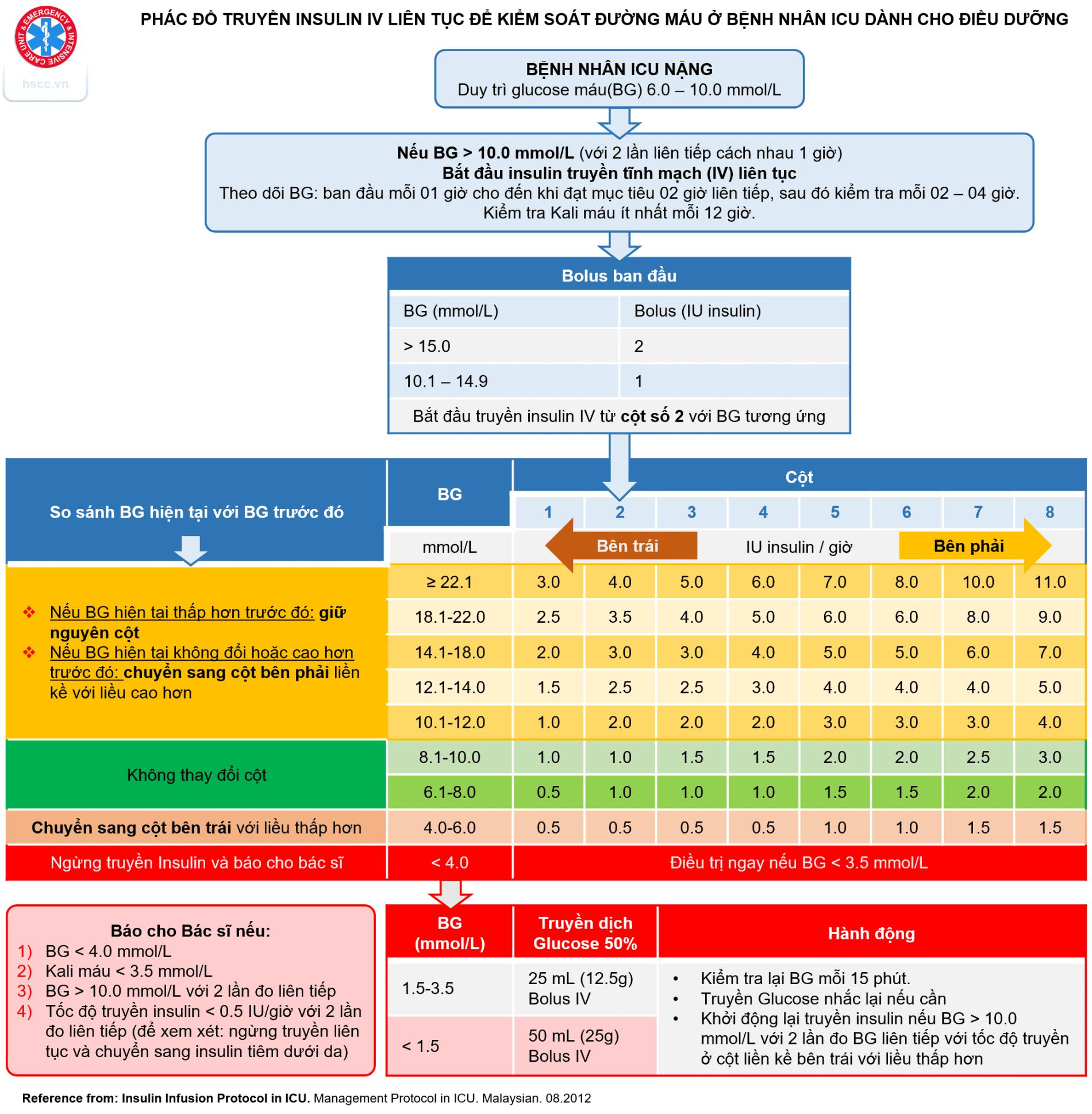
Kiểm soát đường huyết trong ICU là một thách thức không nhỏ, đòi hỏi sự phối hợp chặt chẽ giữa các bác sĩ, điều dưỡng và các chuyên gia dinh dưỡng. Mục tiêu là duy trì đường huyết trong một phạm vi an toàn, thường là từ 140-180 mg/dL (7.8-10 mmol/L), để giảm thiểu nguy cơ biến chứng do cả tăng và hạ đường huyết.
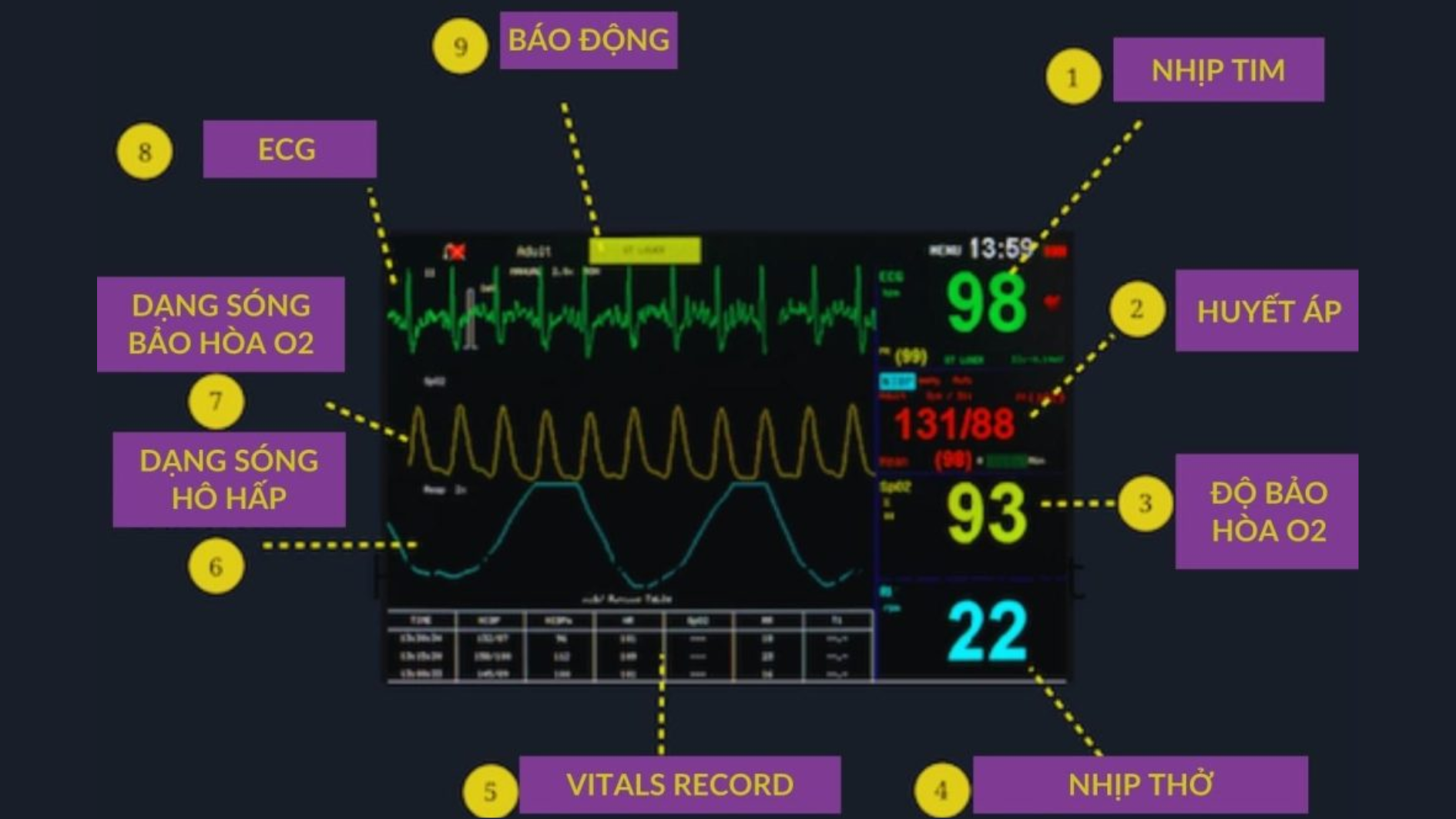
Theo dõi đường huyết liên tục (Continuous Glucose Monitoring – CGM) đang ngày càng trở nên phổ biến trong ICU. CGM sử dụng một cảm biến nhỏ được đưa vào dưới da để đo nồng độ glucose trong dịch kẽ liên tục, cung cấp thông tin chi tiết về xu hướng đường huyết và giúp phát hiện sớm các biến động bất thường. Điều này cho phép chúng ta điều chỉnh liều insulin một cách chính xác hơn và giảm thiểu nguy cơ hạ đường huyết. Tuy nhiên, CGM cũng có những hạn chế nhất định, như độ chính xác có thể bị ảnh hưởng bởi một số yếu tố như tình trạng mất nước, thuốc men và các bệnh lý nền. Do đó, kết quả CGM cần được đối chiếu với kết quả xét nghiệm đường huyết mao mạch định kỳ để đảm bảo tính chính xác.
Insulin truyền tĩnh mạch là phương pháp điều trị chính cho tăng đường huyết trong ICU. Insulin Regular là loại insulin thường được sử dụng nhất vì nó có tác dụng nhanh và thời gian tác dụng ngắn, cho phép chúng ta điều chỉnh liều lượng một cách linh hoạt. Insulin truyền tĩnh mạch có thể được sử dụng theo nhiều phác đồ khác nhau, từ phác đồ cố định đến phác đồ điều chỉnh theo đường huyết. Phác đồ điều chỉnh theo đường huyết, trong đó liều insulin được điều chỉnh dựa trên nồng độ glucose hiện tại và xu hướng đường huyết, thường được ưu tiên hơn vì nó giúp duy trì đường huyết ổn định hơn.
Dinh dưỡng đóng một vai trò quan trọng trong kiểm soát đường huyết. Chúng ta cần đảm bảo cung cấp đủ năng lượng và protein cho bệnh nhân, nhưng cũng cần kiểm soát lượng carbohydrate để tránh làm tăng đường huyết quá mức. Nuôi dưỡng đường tĩnh mạch (TPN) có thể làm tăng đường huyết nhanh chóng, đặc biệt nếu tốc độ truyền dịch quá nhanh. Do đó, chúng ta cần theo dõi đường huyết chặt chẽ và điều chỉnh tốc độ truyền dịch hoặc thành phần dinh dưỡng nếu cần thiết. Nuôi dưỡng qua ống thông (enteral feeding) thường ít gây tăng đường huyết hơn TPN, nhưng vẫn cần được theo dõi cẩn thận.
Các biện pháp hỗ trợ khác cũng có thể giúp kiểm soát đường huyết. Tập thể dục (nếu bệnh nhân đủ sức khỏe) có thể giúp cải thiện độ nhạy insulin và giảm đường huyết. Kiểm soát stress cũng rất quan trọng, vì stress có thể làm tăng nồng độ các hormone gây tăng đường huyết. Đảm bảo giấc ngủ đủ giấc cũng có thể giúp cải thiện kiểm soát đường huyết.
Phác đồ kiểm soát đường huyết cần được cá nhân hóa cho từng bệnh nhân, dựa trên tình trạng bệnh lý nền, chức năng gan thận, chế độ dinh dưỡng và các yếu tố khác. Chúng ta cần theo dõi đường huyết chặt chẽ và điều chỉnh phác đồ điều trị khi cần thiết để đạt được mục tiêu kiểm soát đường huyết và giảm thiểu nguy cơ biến chứng.
Kiểm Soát Điện Giải ở Bệnh Nhân ICU
Kiểm soát điện giải ở bệnh nhân ICU là một khía cạnh vô cùng quan trọng, không kém phần quan trọng so với kiểm soát đường huyết. Thậm chí, có thể nói rằng, sự cân bằng điện giải là nền tảng cho mọi hoạt động sống của tế bào, và khi nền tảng này bị lung lay, mọi hệ thống trong cơ thể đều có thể bị ảnh hưởng nghiêm trọng. Bệnh nhân ICU, với tình trạng bệnh lý phức tạp và đa dạng, thường dễ bị rối loạn điện giải do nhiều nguyên nhân khác nhau, từ bệnh nền, thuốc men sử dụng, đến các can thiệp điều trị. Việc hiểu rõ về các rối loạn điện giải thường gặp, nguyên nhân, hậu quả, và các phương pháp điều trị là điều kiện tiên quyết để đảm bảo sự sống còn và cải thiện kết quả điều trị cho bệnh nhân.
Rối Loạn Kali Máu (K+)
Kali (K+) là một cation nội bào quan trọng, đóng vai trò then chốt trong nhiều quá trình sinh lý, bao gồm duy trì điện thế màng tế bào, dẫn truyền thần kinh, co cơ (đặc biệt là cơ tim), và điều hòa cân bằng acid-base. Nồng độ kali trong máu được kiểm soát chặt chẽ bởi thận, hormone (insulin, aldosterone), và sự di chuyển kali giữa nội bào và ngoại bào. Rối loạn kali máu, bao gồm tăng kali máu (hyperkalemia) và hạ kali máu (hypokalemia), là những vấn đề thường gặp ở bệnh nhân ICU và có thể gây ra những hậu quả nghiêm trọng, thậm chí đe dọa tính mạng.
Hạ Kali Máu (Hypokalemia):
Hạ kali máu được định nghĩa là nồng độ kali trong máu dưới 3.5 mmol/L. Nguyên nhân gây hạ kali máu ở bệnh nhân ICU rất đa dạng, bao gồm:
- Giảm cung cấp: Do chế độ ăn uống không đủ kali, nuôi dưỡng tĩnh mạch không đầy đủ, hoặc kém hấp thu kali ở đường tiêu hóa.
- Tăng thải kali: Do sử dụng thuốc lợi tiểu (đặc biệt là lợi tiểu quai và thiazide), cường aldosterone (ví dụ, trong hội chứng Cushing), tăng bài tiết kali qua đường tiêu hóa (ví dụ, tiêu chảy, nôn mửa), hoặc do thẩm tách máu.
- Tái phân bố kali vào tế bào: Do sử dụng insulin (điều trị tăng đường huyết), kiềm hóa máu (alkalosis), hoặc do tác dụng của một số thuốc (ví dụ, thuốc chủ vận beta-adrenergic).
Triệu chứng của hạ kali máu rất đa dạng, tùy thuộc vào mức độ và tốc độ giảm kali máu. Các triệu chứng thường gặp bao gồm:
- Yếu cơ: Mệt mỏi, yếu cơ, chuột rút, thậm chí liệt cơ.
- Rối loạn tim mạch: Loạn nhịp tim (đặc biệt là rung nhĩ, rung thất), thay đổi trên điện tâm đồ (ECG) (sóng T dẹt hoặc đảo ngược, sóng U xuất hiện, đoạn ST chênh xuống), tăng nguy cơ ngộ độc digoxin.
- Rối loạn tiêu hóa: Táo bón, liệt ruột.
- Rối loạn thận: Giảm khả năng cô đặc nước tiểu, dẫn đến khát nước và đi tiểu nhiều.
Điều trị hạ kali máu cần dựa trên nguyên nhân và mức độ thiếu hụt kali. Các biện pháp điều trị bao gồm:
- Bổ sung kali: Có thể bổ sung kali bằng đường uống (kali clorua, kali phosphate) hoặc đường tĩnh mạch (kali clorua). Đường tĩnh mạch được ưu tiên trong trường hợp hạ kali máu nặng hoặc bệnh nhân không thể uống được.
- Điều trị nguyên nhân: Điều trị các bệnh lý gây tăng thải kali (ví dụ, cường aldosterone), ngừng sử dụng các thuốc lợi tiểu gây mất kali, kiểm soát tiêu chảy và nôn mửa.
- Theo dõi điện tâm đồ (ECG): Theo dõi ECG liên tục để phát hiện sớm các rối loạn nhịp tim.
Khi truyền kali tĩnh mạch, cần lưu ý:
- Tốc độ truyền: Tốc độ truyền kali không nên vượt quá 20 mmol/giờ để tránh gây kích ứng tĩnh mạch và tăng kali máu quá nhanh.
- Nồng độ kali: Nồng độ kali trong dung dịch truyền không nên vượt quá 40 mmol/L ở tĩnh mạch ngoại vi và 60 mmol/L ở tĩnh mạch trung tâm.
- Kiểm tra chức năng thận: Kiểm tra chức năng thận trước khi truyền kali, vì suy thận có thể làm giảm khả năng thải kali và tăng nguy cơ tăng kali máu.
- Theo dõi kali máu: Theo dõi kali máu định kỳ để điều chỉnh liều lượng và tốc độ truyền kali.
Tăng Kali Máu (Hyperkalemia):
Tăng kali máu được định nghĩa là nồng độ kali trong máu trên 5.5 mmol/L. Tăng kali máu là một tình trạng cấp cứu nội khoa, có thể gây ra các rối loạn nhịp tim nguy hiểm và ngừng tim. Nguyên nhân gây tăng kali máu ở bệnh nhân ICU bao gồm:
- Tăng cung cấp: Do truyền kali quá nhanh, truyền máu có chứa nhiều kali (ví dụ, máu bảo quản lâu), hoặc do sử dụng các thuốc bổ sung kali.
- Giảm thải kali: Do suy thận cấp hoặc mạn tính, giảm aldosterone (ví dụ, bệnh Addison), hoặc do sử dụng các thuốc ức chế hệ renin-angiotensin-aldosterone (ví dụ, thuốc ức chế men chuyển, thuốc chẹn thụ thể angiotensin).
- Tái phân bố kali ra khỏi tế bào: Do toan máu (acidosis), tiêu cơ vân, hội chứng ly giải u, bỏng nặng, hoặc do tác dụng của một số thuốc (ví dụ, thuốc chẹn beta-adrenergic, digitalis).
Triệu chứng của tăng kali máu thường không đặc hiệu và có thể bao gồm:
- Yếu cơ: Mệt mỏi, yếu cơ, liệt cơ (đặc biệt là liệt chu kỳ).
- Rối loạn tim mạch: Loạn nhịp tim (đặc biệt là nhịp chậm xoang, block nhĩ thất), thay đổi trên ECG (sóng T nhọn cao, phức bộ QRS giãn rộng, đoạn PR kéo dài), ngừng tim.
- Rối loạn tiêu hóa: Buồn nôn, nôn mửa, tiêu chảy.
Điều trị tăng kali máu cần được thực hiện khẩn trương để ngăn ngừa các biến chứng nguy hiểm. Các biện pháp điều trị bao gồm:
- Bảo vệ tim: Sử dụng canxi gluconate hoặc canxi clorua để ổn định màng tế bào tim và giảm nguy cơ rối loạn nhịp tim.
- Tái phân bố kali vào tế bào: Sử dụng insulin và glucose để đưa kali trở lại tế bào. Sử dụng bicarbonate natri để kiềm hóa máu, giúp kali di chuyển vào tế bào. Sử dụng thuốc chủ vận beta-adrenergic (ví dụ, albuterol) để kích thích bơm Na+-K+ ATPase, giúp kali di chuyển vào tế bào.
- Loại bỏ kali ra khỏi cơ thể: Sử dụng thuốc lợi tiểu quai (ví dụ, furosemide) để tăng thải kali qua thận. Sử dụng nhựa trao đổi ion (ví dụ, sodium polystyrene sulfonate) để gắn kali trong đường tiêu hóa và thải ra ngoài. Thẩm tách máu là biện pháp hiệu quả nhất để loại bỏ kali ra khỏi cơ thể, đặc biệt trong trường hợp suy thận.
- Ngừng sử dụng các thuốc làm tăng kali máu: Ngừng sử dụng các thuốc ức chế hệ renin-angiotensin-aldosterone, thuốc chẹn beta-adrenergic, và các thuốc bổ sung kali.
Theo dõi kali máu thường xuyên là rất quan trọng để đánh giá hiệu quả điều trị và điều chỉnh phác đồ điều trị.
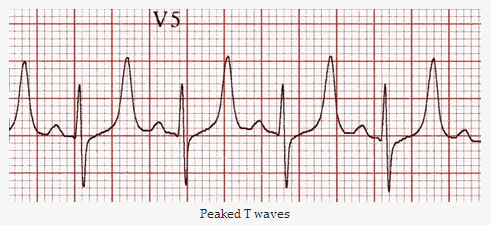
Rối Loạn Natri Máu (Na+)
Natri (Na+) là cation ngoại bào chính, đóng vai trò quan trọng trong duy trì áp lực thẩm thấu của dịch ngoại bào, điều hòa thể tích máu, và dẫn truyền thần kinh. Nồng độ natri trong máu được kiểm soát bởi thận, hormone (ADH, aldosterone), và cảm giác khát. Rối loạn natri máu, bao gồm tăng natri máu (hypernatremia) và hạ natri máu (hyponatremia), là những rối loạn điện giải thường gặp ở bệnh nhân ICU và có thể gây ra những hậu quả nghiêm trọng, đặc biệt là đối với hệ thần kinh trung ương.
Hạ Natri Máu (Hyponatremia):
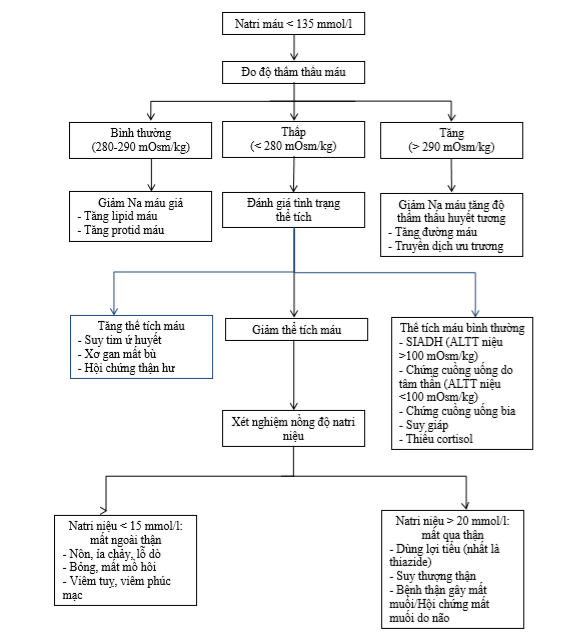
Hạ natri máu được định nghĩa là nồng độ natri trong máu dưới 135 mmol/L. Đây là rối loạn điện giải phổ biến nhất ở bệnh nhân nội trú và ICU. Nguyên nhân gây hạ natri máu rất đa dạng, bao gồm:
- Hạ natri máu giảm thể tích: Do mất natri qua thận (sử dụng thuốc lợi tiểu, bệnh Addison) hoặc ngoài thận (tiêu chảy, nôn mửa, bỏng).
- Hạ natri máu tăng thể tích: Do suy tim, xơ gan, hội chứng thận hư, gây ứ dịch và pha loãng natri.
- Hạ natri máu đẳng thể tích: Do hội chứng SIADH (hội chứng bài tiết ADH không thích hợp), suy giáp, hoặc do sử dụng một số thuốc (ví dụ, thuốc chống trầm cảm, thuốc chống loạn thần).
- Hạ natri máu giả: Do tăng lipid máu hoặc protein máu quá cao, làm sai lệch kết quả đo natri.
Triệu chứng của hạ natri máu phụ thuộc vào mức độ và tốc độ giảm natri máu. Các triệu chứng thường gặp bao gồm:
- Triệu chứng thần kinh: Nhức đầu, lú lẫn, buồn nôn, nôn mửa, co giật, hôn mê.
- Triệu chứng cơ: Yếu cơ, chuột rút.
- Triệu chứng tiêu hóa: Chán ăn.
Điều trị hạ natri máu cần dựa trên nguyên nhân, mức độ, và tốc độ giảm natri máu. Các biện pháp điều trị bao gồm:
- Hạn chế dịch: Trong trường hợp hạ natri máu tăng thể tích hoặc đẳng thể tích.
- Bổ sung natri: Trong trường hợp hạ natri máu giảm thể tích. Có thể bổ sung natri bằng đường uống (viên natri clorua) hoặc đường tĩnh mạch (dung dịch natri clorua).
- Điều trị nguyên nhân: Điều trị suy tim, xơ gan, hội chứng thận hư, suy giáp, hoặc ngừng sử dụng các thuốc gây hạ natri máu.
- Sử dụng thuốc lợi tiểu quai: Trong trường hợp hạ natri máu tăng thể tích.
- Sử dụng thuốc ức chế thụ thể V2 của ADH (vaptans): Trong trường hợp SIADH.
Khi điều trị hạ natri máu, cần lưu ý:
- Tốc độ điều chỉnh natri: Tốc độ điều chỉnh natri không nên vượt quá 8-12 mmol/L trong 24 giờ đầu tiên để tránh gây ra hội chứng hủy myelin cầu não (osmotic demyelination syndrome – ODS), một biến chứng thần kinh nghiêm trọng.
- Theo dõi natri máu: Theo dõi natri máu thường xuyên để điều chỉnh liều lượng và tốc độ truyền natri.
Tăng Natri Máu (Hypernatremia):
Tăng natri máu được định nghĩa là nồng độ natri trong máu trên 145 mmol/L. Tăng natri máu thường gặp ở bệnh nhân không thể tự bù nước (ví dụ, bệnh nhân hôn mê, bệnh nhân đặt nội khí quản) hoặc bệnh nhân mất nước quá nhiều. Nguyên nhân gây tăng natri máu bao gồm:
- Mất nước: Do tiêu chảy, nôn mửa, đổ mồ hôi nhiều, hoặc do sử dụng thuốc lợi tiểu.
- Giảm cung cấp nước: Do không đủ khả năng uống nước hoặc do hạn chế dịch.
- Tăng bài tiết nước tiểu: Do đái tháo nhạt (diabetes insipidus).
- Tăng cung cấp natri: Do truyền dung dịch ưu trương natri clorua hoặc bicarbonate natri.
Triệu chứng của tăng natri máu phụ thuộc vào mức độ và tốc độ tăng natri máu. Các triệu chứng thường gặp bao gồm:
- Triệu chứng thần kinh: Lú lẫn, kích thích, co giật, hôn mê.
- Triệu chứng cơ: Yếu cơ, tăng phản xạ.
- Khát nước: (nếu bệnh nhân còn tỉnh táo).
Điều trị tăng natri máu cần dựa trên nguyên nhân và mức độ tăng natri máu. Các biện pháp điều trị bao gồm:
- Bù nước: Bù nước bằng đường uống (nếu bệnh nhân còn tỉnh táo) hoặc đường tĩnh mạch (dung dịch nhược trương natri clorua hoặc dung dịch glucose 5%).
- Điều trị nguyên nhân: Điều trị đái tháo nhạt, ngừng sử dụng các thuốc lợi tiểu.
- Giảm cung cấp natri: Ngừng truyền dung dịch ưu trương natri clorua hoặc bicarbonate natri.
Khi điều trị tăng natri máu, cần lưu ý:
- Tốc độ điều chỉnh natri: Tốc độ điều chỉnh natri không nên vượt quá 10-12 mmol/L trong 24 giờ đầu tiên để tránh gây ra phù não.
- Theo dõi natri máu: Theo dõi natri máu thường xuyên để điều chỉnh liều lượng và tốc độ truyền dịch.
Các Rối Loạn Điện Giải Khác và Điều Trị
Ngoài rối loạn kali máu và natri máu, bệnh nhân ICU còn có thể gặp các rối loạn điện giải khác, bao gồm:
- Rối loạn canxi máu (Ca2+): Hạ canxi máu (hypocalcemia) và tăng canxi máu (hypercalcemia). Canxi đóng vai trò quan trọng trong co cơ, dẫn truyền thần kinh, đông máu, và cấu trúc xương.
- Rối loạn magie máu (Mg2+): Hạ magie máu (hypomagnesemia) và tăng magie máu (hypermagnesemia). Magie đóng vai trò quan trọng trong nhiều quá trình enzyme, co cơ, và dẫn truyền thần kinh.
- Rối loạn phosphate máu (PO43-): Hạ phosphate máu (hypophosphatemia) và tăng phosphate máu (hyperphosphatemia). Phosphate đóng vai trò quan trọng trong cấu trúc xương, sản xuất năng lượng (ATP), và chức năng tế bào.
Việc chẩn đoán và điều trị các rối loạn điện giải này cần dựa trên nguyên nhân, mức độ, và triệu chứng lâm sàng.
Cân Bằng Nước và Điện Giải
Cân bằng nước và điện giải là một quá trình phức tạp, được điều hòa bởi nhiều hệ thống khác nhau trong cơ thể. Bệnh nhân ICU thường dễ bị rối loạn cân bằng nước và điện giải do nhiều nguyên nhân, bao gồm:
- Bệnh nền: Suy tim, suy thận, xơ gan, hội chứng thận hư.
- Thuốc men: Thuốc lợi tiểu, thuốc ức chế hệ renin-angiotensin-aldosterone.
- Can thiệp điều trị: Truyền dịch, thẩm tách máu.
- Tình trạng bệnh lý cấp tính: Sốc, nhiễm trùng, bỏng.
Việc duy trì cân bằng nước và điện giải là rất quan trọng để đảm bảo chức năng của các cơ quan và hệ thống trong cơ thể. Các biện pháp để duy trì cân bằng nước và điện giải bao gồm:
- Theo dõi lượng dịch vào và ra: Theo dõi lượng dịch truyền vào, lượng nước tiểu, lượng dịch mất qua đường tiêu hóa, đường hô hấp, và da.
- Đánh giá tình trạng thể tích: Đánh giá tình trạng thể tích bằng cách khám lâm sàng (tình trạng da, niêm mạc, huyết áp, nhịp tim, tĩnh mạch cổ), đo áp lực tĩnh mạch trung tâm (CVP), và siêu âm tim.
- Đo điện giải đồ: Đo điện giải đồ thường xuyên để theo dõi nồng độ các điện giải trong máu.
- Điều chỉnh lượng dịch và điện giải: Điều chỉnh lượng dịch và điện giải truyền vào dựa trên tình trạng thể tích, điện giải đồ, và chức năng thận.
- Sử dụng thuốc lợi tiểu: Sử dụng thuốc lợi tiểu để điều chỉnh thể tích dịch trong trường hợp quá tải dịch.
- Hạn chế dịch: Hạn chế dịch trong trường hợp hạ natri máu tăng thể tích hoặc suy thận.
Việc kiểm soát điện giải và cân bằng nước là một phần không thể thiếu trong chăm sóc bệnh nhân ICU. Cần có sự hiểu biết sâu sắc về sinh lý bệnh, nguyên nhân gây rối loạn, và các phương pháp điều trị để đảm bảo kết quả điều trị tốt nhất cho bệnh nhân.
Các Yếu Tố Ảnh Hưởng Đến Kiểm Soát Đường Huyết và Điện Giải
Thật sự mà nói, khi đối diện với bệnh nhân nặng trong ICU, việc kiểm soát đường huyết và điện giải không chỉ là một quy trình máy móc, mà là một nghệ thuật cân bằng. Chúng ta không chỉ đơn thuần điều chỉnh các con số trên màn hình, mà còn phải hiểu rõ những yếu tố phức tạp, đa chiều tác động lên cơ thể người bệnh. Và trong số đó, stress, giấc ngủ và các vấn đề tâm lý đóng vai trò quan trọng, đôi khi bị bỏ qua, nhưng lại có ảnh hưởng sâu sắc đến sự ổn định nội môi của bệnh nhân.
Ảnh Hưởng của Stress và Giấc Ngủ
Stress, một phản ứng tự nhiên của cơ thể trước những tác nhân gây hại, lại trở thành một “kẻ thù” nguy hiểm trong môi trường ICU. Bệnh nhân trong ICU thường xuyên phải đối mặt với vô vàn áp lực: đau đớn, khó chịu, lo lắng về bệnh tật, sự cô lập, tiếng ồn từ máy móc, các thủ thuật xâm lấn… Tất cả những điều này kích hoạt hệ thống thần kinh giao cảm, dẫn đến hàng loạt thay đổi sinh lý có hại.
Stress và Đường Huyết:
Khi cơ thể trải qua stress, nó sẽ giải phóng các hormone như cortisol, glucagon và epinephrine (adrenaline). Những hormone này có tác dụng làm tăng đường huyết. Cortisol, được mệnh danh là “hormone stress”, kích thích quá trình tân tạo đường (gluconeogenesis) ở gan, tức là tạo ra glucose từ các nguồn không phải carbohydrate như protein và chất béo. Glucagon cũng có tác dụng tương tự, thúc đẩy gan giải phóng glucose vào máu. Epinephrine, ngoài việc tăng đường huyết, còn làm giảm độ nhạy insulin của các tế bào, khiến glucose khó được hấp thu vào tế bào để sử dụng, từ đó làm tăng đường huyết.
Hơn nữa, stress còn có thể làm tăng tình trạng kháng insulin. Insulin là hormone giúp glucose từ máu đi vào tế bào để cung cấp năng lượng. Khi cơ thể kháng insulin, tế bào trở nên “lờ” với tín hiệu của insulin, khiến glucose tích tụ trong máu, gây tăng đường huyết. Tình trạng này đặc biệt nguy hiểm ở bệnh nhân đái tháo đường hoặc có nguy cơ mắc đái tháo đường, vì nó có thể làm trầm trọng thêm tình trạng bệnh.
Nghiên cứu đã chỉ ra rằng, bệnh nhân ICU trải qua stress nặng thường có đường huyết cao hơn và khó kiểm soát hơn so với những bệnh nhân ít stress hơn. Điều này không chỉ làm tăng nguy cơ nhiễm trùng, suy đa tạng, mà còn kéo dài thời gian nằm viện và tăng tỷ lệ tử vong.
Stress và Điện Giải:
Stress không chỉ ảnh hưởng đến đường huyết, mà còn tác động đến sự cân bằng điện giải. Cortisol, ngoài tác dụng tăng đường huyết, còn có tác dụng giữ muối và nước ở thận, đồng thời tăng thải kali. Điều này có thể dẫn đến tình trạng tăng natri máu (hypernatremia) và hạ kali máu (hypokalemia).
Hạ kali máu đặc biệt nguy hiểm, vì kali đóng vai trò quan trọng trong hoạt động của tim, cơ và thần kinh. Hạ kali máu có thể gây ra rối loạn nhịp tim, yếu cơ, thậm chí liệt cơ hô hấp. Tăng natri máu cũng có thể gây ra nhiều vấn đề, như khát nước, lú lẫn, co giật và hôn mê.
Ngoài ra, stress còn có thể ảnh hưởng đến sự cân bằng canxi và magie. Stress có thể làm tăng thải canxi qua nước tiểu, dẫn đến hạ canxi máu (hypocalcemia). Hạ canxi máu có thể gây ra co cứng cơ, co giật và rối loạn nhịp tim. Tương tự, stress cũng có thể làm giảm magie máu, gây ra các triệu chứng như run, yếu cơ và rối loạn nhịp tim.
Giấc Ngủ và Sự Ổn Định Nội Môi:
Giấc ngủ, tưởng chừng như một nhu cầu sinh lý đơn giản, lại đóng vai trò vô cùng quan trọng trong việc duy trì sự ổn định nội môi của cơ thể. Thiếu ngủ, một tình trạng phổ biến ở bệnh nhân ICU, có thể gây ra hàng loạt rối loạn, ảnh hưởng nghiêm trọng đến sức khỏe.
Giấc Ngủ và Đường Huyết:
Thiếu ngủ có thể làm tăng tình trạng kháng insulin, tương tự như stress. Khi cơ thể không được nghỉ ngơi đầy đủ, các tế bào trở nên ít nhạy cảm hơn với insulin, khiến glucose tích tụ trong máu. Nghiên cứu đã chỉ ra rằng, chỉ cần một đêm mất ngủ cũng có thể làm tăng đáng kể đường huyết vào ngày hôm sau.
Hơn nữa, thiếu ngủ còn có thể làm rối loạn quá trình điều hòa hormone liên quan đến đường huyết. Ví dụ, thiếu ngủ có thể làm giảm nồng độ hormone leptin, hormone báo hiệu cảm giác no, và tăng nồng độ hormone ghrelin, hormone kích thích cảm giác đói. Điều này có thể dẫn đến ăn quá nhiều, đặc biệt là các loại thực phẩm giàu carbohydrate, làm tăng đường huyết.
Giấc Ngủ và Điện Giải:
Giấc ngủ cũng đóng vai trò quan trọng trong việc điều hòa điện giải. Trong khi ngủ, cơ thể tiết ra hormone ADH (hormone chống bài niệu), giúp thận giữ nước và điện giải. Thiếu ngủ có thể làm giảm tiết ADH, dẫn đến tăng thải nước và điện giải qua nước tiểu, gây ra các rối loạn điện giải như hạ natri máu, hạ kali máu.
Ngoài ra, giấc ngủ còn ảnh hưởng đến hoạt động của hệ thần kinh tự chủ, hệ thống điều khiển các chức năng tự động của cơ thể, bao gồm cả việc điều hòa điện giải. Thiếu ngủ có thể làm mất cân bằng hệ thần kinh tự chủ, gây ra các rối loạn điện giải.
Ảnh Hưởng của Các Vấn Đề Tâm Lý
Không chỉ stress và giấc ngủ, các vấn đề tâm lý như lo âu, trầm cảm, hoảng sợ cũng có thể ảnh hưởng đáng kể đến kiểm soát đường huyết và điện giải ở bệnh nhân ICU.
Lo Âu và Đường Huyết:
Lo âu kích hoạt hệ thần kinh giao cảm, tương tự như stress, dẫn đến tăng tiết các hormone như cortisol và epinephrine, làm tăng đường huyết. Bệnh nhân lo âu thường có xu hướng ăn uống thất thường, bỏ bữa hoặc ăn quá nhiều, đặc biệt là các loại thực phẩm không lành mạnh, làm ảnh hưởng đến kiểm soát đường huyết.
Trầm Cảm và Đường Huyết:
Trầm cảm có thể làm thay đổi hành vi ăn uống, dẫn đến tăng cân hoặc giảm cân, ảnh hưởng đến độ nhạy insulin và kiểm soát đường huyết. Bệnh nhân trầm cảm thường ít vận động, làm giảm khả năng sử dụng glucose của cơ thể, gây tăng đường huyết. Ngoài ra, một số thuốc điều trị trầm cảm có thể gây tăng đường huyết hoặc hạ đường huyết.
Hoảng Sợ và Điện Giải:
Các cơn hoảng sợ có thể gây ra thở nhanh và sâu, dẫn đến giảm CO2 trong máu (alkalosis hô hấp). Alkalosis hô hấp có thể làm giảm nồng độ canxi ion hóa trong máu, gây ra các triệu chứng như co cứng cơ, co giật. Ngoài ra, hoảng sợ có thể làm tăng tiết mồ hôi, dẫn đến mất nước và điện giải, gây ra các rối loạn điện giải.
Ảnh Hưởng Gián Tiếp:
Các vấn đề tâm lý còn có thể ảnh hưởng gián tiếp đến kiểm soát đường huyết và điện giải thông qua việc giảm tuân thủ điều trị. Bệnh nhân lo âu, trầm cảm thường ít quan tâm đến việc tuân thủ chế độ ăn uống, uống thuốc đúng giờ, hoặc thực hiện các xét nghiệm theo dõi. Điều này có thể làm cho việc kiểm soát đường huyết và điện giải trở nên khó khăn hơn.
Các Yếu Tố Khác
Ngoài stress, giấc ngủ và các vấn đề tâm lý, còn có nhiều yếu tố khác có thể ảnh hưởng đến kiểm soát đường huyết và điện giải ở bệnh nhân ICU.
Thuốc:
Một số loại thuốc có thể ảnh hưởng đến đường huyết và điện giải. Corticosteroid, thường được sử dụng để điều trị các bệnh viêm, có thể làm tăng đường huyết và gây ra các rối loạn điện giải như hạ kali máu. Thuốc lợi tiểu, được sử dụng để điều trị phù, có thể gây ra các rối loạn điện giải như hạ natri máu, hạ kali máu. Một số thuốc kháng sinh, thuốc chống nấm cũng có thể gây ra các rối loạn điện giải.
Bệnh Lý Kèm Theo:
Các bệnh lý kèm theo như suy thận, suy gan, suy tim có thể ảnh hưởng đến khả năng điều hòa đường huyết và điện giải của cơ thể. Suy thận làm giảm khả năng thải nước và điện giải, dẫn đến các rối loạn điện giải như tăng kali máu, tăng magie máu. Suy gan làm giảm khả năng sản xuất glucose, dẫn đến hạ đường huyết. Suy tim làm giảm lưu lượng máu đến thận, ảnh hưởng đến khả năng điều hòa điện giải.
Chế Độ Dinh Dưỡng:
Chế độ dinh dưỡng không phù hợp có thể ảnh hưởng đến đường huyết và điện giải. Ăn quá nhiều carbohydrate có thể làm tăng đường huyết. Ăn quá ít protein có thể làm giảm khả năng sản xuất albumin, protein giúp giữ nước trong máu, dẫn đến phù và các rối loạn điện giải.
Tình Trạng Nhiễm Trùng:
Nhiễm trùng có thể gây ra stress, làm tăng đường huyết và gây ra các rối loạn điện giải. Nhiễm trùng nặng có thể dẫn đến sốc nhiễm trùng, một tình trạng nguy hiểm có thể gây ra suy đa tạng và rối loạn điện giải nghiêm trọng.
Tuổi Tác:
Người lớn tuổi thường có chức năng thận suy giảm, làm giảm khả năng điều hòa điện giải. Người lớn tuổi cũng có thể có các bệnh lý kèm theo, làm tăng nguy cơ rối loạn đường huyết và điện giải.
Di Truyền:
Một số người có yếu tố di truyền làm tăng nguy cơ mắc đái tháo đường hoặc các rối loạn điện giải.
Tóm lại, kiểm soát đường huyết và điện giải ở bệnh nhân ICU là một quá trình phức tạp, đòi hỏi sự hiểu biết sâu sắc về các yếu tố ảnh hưởng, không chỉ là các con số trên màn hình mà còn là sự thấu hiểu về con người, về những áp lực mà họ đang phải đối mặt. Chỉ khi đó, chúng ta mới có thể đưa ra những quyết định điều trị đúng đắn và giúp bệnh nhân vượt qua giai đoạn khó khăn này.
Theo Dõi và Đánh Giá
Theo dõi và đánh giá là trái tim của mọi nỗ lực kiểm soát đường huyết và điện giải trong ICU. Nó không chỉ là việc ghi chép các con số, mà còn là quá trình suy luận, phân tích để đưa ra những quyết định điều trị kịp thời và chính xác. Chúng ta cần hiểu rằng, mỗi bệnh nhân là một cá thể riêng biệt, phản ứng khác nhau với các phác đồ điều trị, và việc theo dõi sát sao giúp chúng ta cá nhân hóa liệu pháp, tối ưu hóa kết quả.
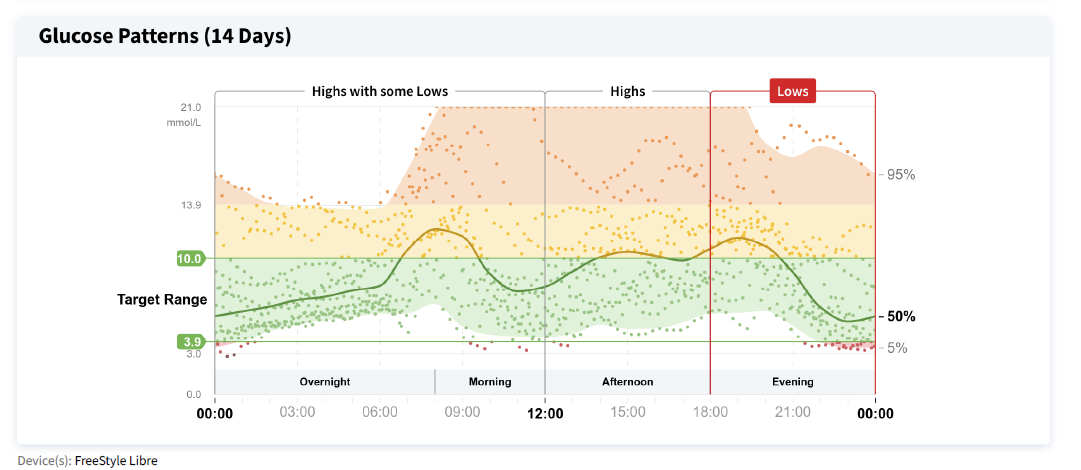
Theo Dõi Đường Huyết Liên Tục
Theo dõi đường huyết liên tục (Continuous Glucose Monitoring – CGM) đã cách mạng hóa cách chúng ta quản lý đường huyết ở bệnh nhân ICU. Thay vì chỉ dựa vào các kết quả đo đường huyết mao mạch ngón tay (finger-stick glucose testing) vài lần một ngày, CGM cung cấp một bức tranh toàn cảnh, liên tục về biến động đường huyết của bệnh nhân.
-
Ưu điểm của CGM:
- Phát hiện sớm các biến động: CGM có thể phát hiện các đợt tăng hoặc hạ đường huyết tiềm ẩn mà các phương pháp đo đường huyết thông thường có thể bỏ sót. Điều này đặc biệt quan trọng trong ICU, nơi bệnh nhân có thể trải qua các biến động đường huyết nhanh chóng và khó lường do tình trạng bệnh lý nghiêm trọng, thuốc men, và các can thiệp y tế.
- Cảnh báo sớm: Nhiều hệ thống CGM có chức năng cảnh báo khi đường huyết vượt quá ngưỡng an toàn (ví dụ, >180 mg/dL hoặc <70 mg/dL). Điều này cho phép nhân viên y tế can thiệp kịp thời để ngăn ngừa các biến chứng.
- Cá nhân hóa điều trị: Dữ liệu CGM cung cấp thông tin chi tiết về cách bệnh nhân phản ứng với insulin và các yếu tố khác ảnh hưởng đến đường huyết. Điều này giúp chúng ta điều chỉnh phác đồ insulin một cách chính xác, đáp ứng nhu cầu cụ thể của từng bệnh nhân.
- Giảm số lần đo đường huyết mao mạch: Mặc dù CGM không hoàn toàn thay thế việc đo đường huyết mao mạch, nó có thể giúp giảm tần suất đo, giảm sự khó chịu cho bệnh nhân và giảm gánh nặng công việc cho nhân viên y tế.
-
Nhược điểm và thách thức của CGM:
- Độ chính xác: Mặc dù công nghệ CGM đã tiến bộ vượt bậc, độ chính xác của nó vẫn chưa hoàn hảo. Các yếu tố như vị trí đặt cảm biến, tình trạng hydrat hóa của bệnh nhân, và một số loại thuốc có thể ảnh hưởng đến độ chính xác của CGM. Do đó, cần phải kiểm tra định kỳ kết quả CGM bằng cách đo đường huyết mao mạch, đặc biệt khi có sự khác biệt lớn giữa hai phương pháp.
- Chi phí: Hệ thống CGM thường đắt hơn so với các phương pháp đo đường huyết thông thường. Điều này có thể là một rào cản đối với việc sử dụng rộng rãi CGM trong các cơ sở y tế có nguồn lực hạn chế.
- Yêu cầu đào tạo: Việc sử dụng và diễn giải dữ liệu CGM đòi hỏi nhân viên y tế phải được đào tạo bài bản. Cần phải hiểu rõ về các nguyên tắc hoạt động của CGM, cách giải quyết các vấn đề kỹ thuật, và cách sử dụng dữ liệu CGM để điều chỉnh phác đồ điều trị.
- Nguy cơ nhiễm trùng: Mặc dù hiếm gặp, việc đặt cảm biến CGM có thể gây ra nhiễm trùng tại chỗ. Cần tuân thủ nghiêm ngặt các quy trình vô khuẩn khi đặt và thay cảm biến.
-
Các yếu tố cần xem xét khi sử dụng CGM:
- Lựa chọn hệ thống CGM phù hợp: Có nhiều hệ thống CGM khác nhau trên thị trường, mỗi hệ thống có những ưu điểm và nhược điểm riêng. Cần lựa chọn hệ thống phù hợp với nhu cầu và nguồn lực của cơ sở y tế.
- Vị trí đặt cảm biến: Vị trí đặt cảm biến CGM có thể ảnh hưởng đến độ chính xác của kết quả. Nên chọn vị trí có đủ mô dưới da và tránh các vùng có sẹo hoặc tổn thương da.
- Hiệu chuẩn CGM: Hầu hết các hệ thống CGM yêu cầu hiệu chuẩn định kỳ bằng cách đo đường huyết mao mạch. Tuân thủ đúng hướng dẫn của nhà sản xuất về tần suất và phương pháp hiệu chuẩn.
- Diễn giải dữ liệu CGM: Cần phải diễn giải dữ liệu CGM một cách cẩn thận, xem xét các yếu tố như xu hướng đường huyết, tốc độ thay đổi đường huyết, và các sự kiện lâm sàng khác.
- Tích hợp dữ liệu CGM vào hồ sơ bệnh án: Dữ liệu CGM nên được tích hợp vào hồ sơ bệnh án điện tử để tất cả các thành viên trong nhóm điều trị có thể dễ dàng truy cập và xem xét.
Đánh Giá Điện Giải Định Kỳ
Rối loạn điện giải là một vấn đề phổ biến ở bệnh nhân ICU, có thể gây ra nhiều biến chứng nghiêm trọng, thậm chí tử vong. Việc đánh giá điện giải định kỳ là rất quan trọng để phát hiện sớm và điều trị kịp thời các rối loạn này.
-
Các điện giải cần theo dõi:
- Kali (K+): Kali là một cation nội bào quan trọng, đóng vai trò then chốt trong việc duy trì điện thế màng tế bào, dẫn truyền thần kinh, và co cơ. Hạ kali máu (hypokalemia) và tăng kali máu (hyperkalemia) đều có thể gây ra rối loạn nhịp tim nguy hiểm.
- Natri (Na+): Natri là cation ngoại bào chính, đóng vai trò quan trọng trong việc điều hòa thể tích dịch ngoại bào, áp suất thẩm thấu, và dẫn truyền thần kinh. Hạ natri máu (hyponatremia) và tăng natri máu (hypernatremia) có thể gây ra các triệu chứng thần kinh như lú lẫn, co giật, và hôn mê.
- Canxi (Ca2+): Canxi đóng vai trò quan trọng trong nhiều quá trình sinh lý, bao gồm co cơ, đông máu, dẫn truyền thần kinh, và cấu trúc xương. Hạ canxi máu (hypocalcemia) và tăng canxi máu (hypercalcemia) có thể gây ra các triệu chứng thần kinh, tim mạch, và cơ xương.
- Magie (Mg2+): Magie là một cation nội bào quan trọng, tham gia vào nhiều phản ứng enzyme, tổng hợp protein, và chức năng thần kinh cơ. Hạ magie máu (hypomagnesemia) và tăng magie máu (hypermagnesemia) có thể gây ra các rối loạn nhịp tim, co giật, và yếu cơ.
- Phosphate (PO43-): Phosphate đóng vai trò quan trọng trong cấu trúc xương, chuyển hóa năng lượng, và chức năng tế bào. Hạ phosphate máu (hypophosphatemia) và tăng phosphate máu (hyperphosphatemia) có thể gây ra các rối loạn cơ xương, hô hấp, và tim mạch.
-
Tần suất đánh giá điện giải:
Tần suất đánh giá điện giải phụ thuộc vào tình trạng lâm sàng của bệnh nhân, các bệnh lý nền, và các thuốc đang sử dụng.
- Bệnh nhân ổn định: Ở những bệnh nhân ổn định, không có rối loạn điện giải trước đó, có thể đánh giá điện giải hàng ngày hoặc cách ngày.
- Bệnh nhân có rối loạn điện giải: Ở những bệnh nhân có rối loạn điện giải, cần đánh giá điện giải thường xuyên hơn, có thể mỗi 4-6 giờ, cho đến khi điện giải ổn định.
- Bệnh nhân sử dụng thuốc ảnh hưởng đến điện giải: Một số loại thuốc, như thuốc lợi tiểu, corticosteroid, và insulin, có thể ảnh hưởng đến điện giải. Ở những bệnh nhân sử dụng các thuốc này, cần theo dõi điện giải chặt chẽ hơn.
-
Phương pháp đánh giá điện giải:
- Xét nghiệm máu: Xét nghiệm máu là phương pháp chính để đánh giá nồng độ điện giải trong máu. Cần lấy máu đúng kỹ thuật và gửi mẫu đến phòng xét nghiệm một cách nhanh chóng để đảm bảo kết quả chính xác.
- Điện tâm đồ (ECG): ECG có thể giúp phát hiện các rối loạn nhịp tim do rối loạn điện giải, đặc biệt là kali và canxi.
- Đánh giá lâm sàng: Cần kết hợp kết quả xét nghiệm điện giải với đánh giá lâm sàng toàn diện để đưa ra chẩn đoán chính xác và lựa chọn phương pháp điều trị phù hợp. Các triệu chứng lâm sàng của rối loạn điện giải có thể bao gồm mệt mỏi, yếu cơ, chuột rút, buồn nôn, nôn, lú lẫn, co giật, và rối loạn nhịp tim.
-
Các yếu tố cần xem xét khi đánh giá điện giải:
- Bệnh lý nền: Một số bệnh lý nền, như suy thận, suy tim, và bệnh phổi tắc nghẽn mạn tính (COPD), có thể làm tăng nguy cơ rối loạn điện giải.
- Thuốc men: Nhiều loại thuốc có thể ảnh hưởng đến điện giải, bao gồm thuốc lợi tiểu, corticosteroid, insulin, và thuốc kháng sinh.
- Tình trạng dinh dưỡng: Suy dinh dưỡng hoặc nuôi ăn tĩnh mạch không đúng cách có thể dẫn đến rối loạn điện giải.
- Tình trạng hydrat hóa: Mất nước hoặc thừa dịch có thể ảnh hưởng đến nồng độ điện giải trong máu.
- Chức năng thận: Thận đóng vai trò quan trọng trong việc điều hòa điện giải. Suy thận có thể làm giảm khả năng bài tiết hoặc tái hấp thu điện giải, dẫn đến rối loạn điện giải.
Điều Chỉnh Phác Đồ Điều Trị
Việc theo dõi đường huyết và điện giải liên tục, kết hợp với đánh giá lâm sàng tỉ mỉ, cho phép chúng ta điều chỉnh phác đồ điều trị một cách linh hoạt và chính xác. Đây không phải là một quá trình tĩnh, mà là một vòng lặp liên tục: theo dõi, đánh giá, điều chỉnh, và lặp lại.
-
Điều chỉnh phác đồ insulin:
- Dựa trên dữ liệu CGM: Dữ liệu CGM cung cấp thông tin chi tiết về xu hướng đường huyết, tốc độ thay đổi đường huyết, và phản ứng của bệnh nhân với insulin. Dựa trên những thông tin này, chúng ta có thể điều chỉnh liều insulin, tốc độ truyền insulin, và thời điểm tiêm hoặc truyền insulin.
- Sử dụng các thuật toán điều chỉnh insulin: Một số cơ sở y tế sử dụng các thuật toán điều chỉnh insulin (insulin adjustment algorithms) để giúp chuẩn hóa và tối ưu hóa việc điều chỉnh phác đồ insulin. Các thuật toán này thường dựa trên dữ liệu CGM và các yếu tố lâm sàng khác để đưa ra các khuyến nghị về liều insulin.
- Xem xét các yếu tố khác: Ngoài dữ liệu CGM, cần xem xét các yếu tố khác như tình trạng dinh dưỡng, thuốc men, và các bệnh lý nền khi điều chỉnh phác đồ insulin.
-
Điều chỉnh phác đồ điều trị điện giải:
- Dựa trên kết quả xét nghiệm điện giải: Kết quả xét nghiệm điện giải cho biết nồng độ các điện giải trong máu. Dựa trên những kết quả này, chúng ta có thể điều chỉnh phác đồ điều trị điện giải để đưa nồng độ điện giải về mức bình thường.
- Sử dụng các hướng dẫn điều trị điện giải: Có nhiều hướng dẫn điều trị điện giải khác nhau, được phát triển bởi các tổ chức y tế uy tín. Các hướng dẫn này cung cấp các khuyến nghị về cách điều trị các rối loạn điện giải khác nhau, bao gồm liều lượng, tốc độ truyền, và đường dùng của các chất điện giải.
- Xem xét các yếu tố khác: Ngoài kết quả xét nghiệm điện giải, cần xem xét các yếu tố khác như chức năng thận, tình trạng tim mạch, và các thuốc đang sử dụng khi điều chỉnh phác đồ điều trị điện giải.
-
Tầm quan trọng của giao tiếp:
Giao tiếp hiệu quả giữa các thành viên trong nhóm điều trị là rất quan trọng để đảm bảo việc điều chỉnh phác đồ điều trị được thực hiện một cách an toàn và hiệu quả. Các bác sĩ, điều dưỡng, dược sĩ, và chuyên gia dinh dưỡng cần phải trao đổi thông tin thường xuyên về tình trạng của bệnh nhân, kết quả xét nghiệm, và các điều chỉnh phác đồ điều trị.
-
Ví dụ minh họa:
- Tăng đường huyết kéo dài mặc dù đã tăng liều insulin: Nếu bệnh nhân liên tục có đường huyết cao mặc dù đã tăng liều insulin, cần xem xét các nguyên nhân khác như nhiễm trùng, kháng insulin, hoặc sử dụng corticosteroid. Có thể cần phải tăng liều insulin hơn nữa, thay đổi loại insulin, hoặc điều trị các nguyên nhân gây tăng đường huyết.
- Hạ kali máu không đáp ứng với bổ sung kali: Nếu bệnh nhân bị hạ kali máu và không đáp ứng với việc bổ sung kali qua đường uống hoặc đường tĩnh mạch, cần xem xét các nguyên nhân gây mất kali như sử dụng thuốc lợi tiểu, tiêu chảy, hoặc nôn mửa. Có thể cần phải ngừng hoặc giảm liều thuốc lợi tiểu, điều trị tiêu chảy hoặc nôn mửa, và bổ sung kali với liều cao hơn.
- Hạ natri máu kèm theo phù: Nếu bệnh nhân bị hạ natri máu và có dấu hiệu phù, cần xem xét tình trạng thừa dịch. Có thể cần phải hạn chế dịch, sử dụng thuốc lợi tiểu, hoặc điều trị các nguyên nhân gây thừa dịch như suy tim hoặc suy thận.
Việc theo dõi và đánh giá đường huyết, điện giải, và điều chỉnh phác đồ điều trị một cách liên tục là một quá trình phức tạp, đòi hỏi sự hiểu biết sâu sắc về sinh lý bệnh, dược lý, và các nguyên tắc điều trị. Tuy nhiên, đây là một trong những yếu tố quan trọng nhất để cải thiện kết quả điều trị cho bệnh nhân ICU.